1 . 硫铁矿(主要成分FeS2)是接触法制硫酸的主要原料,请回答:
(1)基态下Fe2+共有_____ 种不同空间运动状态的电子。
(2)Fe2+形成的配合物亚铁氰化钾K4[Fe(CN)6]又称黄血盐,可用于检验Fe3+,与CN-互为等电子体的阴离子为_________ (任写一种);含有120molσ键的K4[Fe(CN)6]的物质的量为_____ mol。
(3)H 2SO4的酸性强于H2SO3酸性的原因是_______ 。
(4)FeS2晶体的晶胞结构如图所示。在晶胞中,Fe2+位于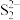 所形成的
所形成的______ (填“正四面体”或“正八面体”)空隙;若晶胞参数为 a nm,密度为ρg∙cm−3,阿伏加德罗常数的值为NA ,则FeS2的摩尔质量 M=_______ (用含 a、ρ、 NA的代数式表示)。

(1)基态下Fe2+共有
(2)Fe2+形成的配合物亚铁氰化钾K4[Fe(CN)6]又称黄血盐,可用于检验Fe3+,与CN-互为等电子体的阴离子为
(3)H 2SO4的酸性强于H2SO3酸性的原因是
(4)FeS2晶体的晶胞结构如图所示。在晶胞中,Fe2+位于
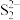 所形成的
所形成的
您最近一年使用:0次
名校
解题方法
2 . 全球首次在350公里时速的奥运版复兴号高铁列车上依托5G技术打造的超高清直播演播室,实现了超高清信号的长时间稳定传输。请回答下列问题:
(1)5G芯片主要材质是高纯硅。基态Si原子价层电子的运动状态有_______ 种,若其电子排布式表示为[ Ne]3s2 违背了
违背了_______ 。
(2)高纯硅制备过程中会有SiHCl3、SiCl4等中间产物生成。沸点:SiHCl3_______ SiCl4(填“>”或“<”),与SiCl4互为等电子体的离子为_______ (任写1种即可)。已知电负性:H>Si,则SiHCl3充分水解的化学方程式为_______ 。
(3)复兴号高铁车体材质用到Mn、Co等元素。
①Mn的一种配合物化学式为[ Mn(CO)5( CH3CN)],下列说法正确的是_______ (填字母标号)。
A. CH3CN与Mn原子配位时,提供孤电子对的是C原子
B. Mn原子的配位数为6
C. CH3CN中C原子的杂化类型为sp2、sp3
D. CH3CN中σ键与π键数目之比为5:2
②已知r(Co2+) =65 pm,r(Mn2+) =67 pm,推测MnCO3比CoCO3的分解温度_______ (填“高”或“低”),解释原因_______ 。
(4)时速600公里的磁浮列车需用到超导材料。超导材料TiN具有NaCl型结构(如图) ,晶胞参数(晶胞边长)为aD(1D= 10 -10m) ,其中阴离子( N3- )采用面心立方最密堆积方式,则r(Ti3+)为_______ D,该氮化钛的密度_______ g· cm-3(列出计算式即可)。

(1)5G芯片主要材质是高纯硅。基态Si原子价层电子的运动状态有
 违背了
违背了(2)高纯硅制备过程中会有SiHCl3、SiCl4等中间产物生成。沸点:SiHCl3
(3)复兴号高铁车体材质用到Mn、Co等元素。
①Mn的一种配合物化学式为[ Mn(CO)5( CH3CN)],下列说法正确的是
A. CH3CN与Mn原子配位时,提供孤电子对的是C原子
B. Mn原子的配位数为6
C. CH3CN中C原子的杂化类型为sp2、sp3
D. CH3CN中σ键与π键数目之比为5:2
②已知r(Co2+) =65 pm,r(Mn2+) =67 pm,推测MnCO3比CoCO3的分解温度
(4)时速600公里的磁浮列车需用到超导材料。超导材料TiN具有NaCl型结构(如图) ,晶胞参数(晶胞边长)为aD(1D= 10 -10m) ,其中阴离子( N3- )采用面心立方最密堆积方式,则r(Ti3+)为

您最近一年使用:0次
2022-04-14更新
|
1935次组卷
|
11卷引用:陕西师范大学附属中学、渭北中学等2023届高三上学期期初检测联考化学试题
陕西师范大学附属中学、渭北中学等2023届高三上学期期初检测联考化学试题北京市第二中学2022届高三下学期五月模拟考试化学试题陕西师范大学附属中学、渭北中学等2022-2023学年高三上学期期初检测化学联考试题山西省临汾市2022届高考考前适应性训练考试(二)理科综合化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考押题预测卷01(全国甲卷)广东省茂名市普通高中毕业班2022届高三下学期模拟考试化学试题广东省广州市第六中学2022届高三第三次模拟考试化学试题广西南宁市第二中学2021-2022学年高三下学期收网题理综化学试题(已下线)第21练 新高考模式综合练(广东卷)-2022年【暑假分层作业】高二化学(2023届一轮复习通用)新疆乌鲁木齐市第四中学2021-2022学年高二下学期期末考试化学试题
名校
解题方法
3 . 黄铜矿(主要成分为CuFeS2)是生产铜、铁和硫酸的原料。回答下列问题:
(1)基态Cu原子的价电子排布式为_______ 。
(2)血红素是吡咯(C4H5N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡咯和血红素的结构如图所示:
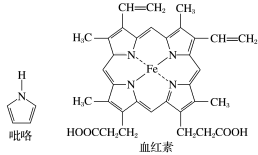
①已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为_______ 。
②1mol吡咯分子中所含的σ键总数为_______ 个。
③C、N、O三种元素的简单氢化物中,沸点由低到高的顺序为_______ (填化学式)。
④血液中O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过_______ 键相结合的。
(3)黄铜矿冶炼铜时产生的SO2可经过SO2→SO3→H2SO4途径形成酸雨。SO2的立体构型为_______ 。H2SO4的酸性强于H2SO3的原因是_______ 。
(1)基态Cu原子的价电子排布式为
(2)血红素是吡咯(C4H5N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡咯和血红素的结构如图所示:

①已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为
②1mol吡咯分子中所含的σ键总数为
③C、N、O三种元素的简单氢化物中,沸点由低到高的顺序为
④血液中O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过
(3)黄铜矿冶炼铜时产生的SO2可经过SO2→SO3→H2SO4途径形成酸雨。SO2的立体构型为
您最近一年使用:0次
2021-01-29更新
|
178次组卷
|
2卷引用:陕西省榆林市第十二中学2020-2021学年高二下学期第二次月考(5月底)化学试题
名校
4 . 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
⑴富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如图所示,分子中碳原子轨道的杂化类型为___ ;1 mol C60分子中σ键的数目为____ 个。

⑵多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓(GaAs)、硫化镉(CdS)薄膜电池等。
第一电离能:As____ Se(填“>”“<”或“=”),理由是____________ 。
⑶三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在太阳能电池制造中得到广泛应用。已知NF3与NH3的空间构型都是三角锥形,NH3易与Cu2+形成配离子,但NF3不易与Cu2+形成配离子,其原因是___________________ 。
⑴富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如图所示,分子中碳原子轨道的杂化类型为

⑵多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓(GaAs)、硫化镉(CdS)薄膜电池等。
第一电离能:As
⑶三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在太阳能电池制造中得到广泛应用。已知NF3与NH3的空间构型都是三角锥形,NH3易与Cu2+形成配离子,但NF3不易与Cu2+形成配离子,其原因是
您最近一年使用:0次
10-11高三上·江苏泰州·阶段练习
5 . 下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。

(1)请写出上图中d单质对应元素原子的电子排布式______ 。
(2)单质a、f对应的元素以原子个数比1 :1形成的分子(相同条件下对H2的相对密度为13)中含___ 个 键和
键和___ 个 键。
键。
(3)a与b的元素形成的10电子中性分子X的空间构型为_________________ ;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为_____________ ,其中X与Ag+之间以__________ 键结合。
(4)下图是上述六种元素中的一种元素形成的含氧酸的结构:请简要说明该物质易溶于水的两个数原因_________________ 。


(1)请写出上图中d单质对应元素原子的电子排布式
(2)单质a、f对应的元素以原子个数比1 :1形成的分子(相同条件下对H2的相对密度为13)中含
 键和
键和 键。
键。(3)a与b的元素形成的10电子中性分子X的空间构型为
(4)下图是上述六种元素中的一种元素形成的含氧酸的结构:请简要说明该物质易溶于水的两个数原因

您最近一年使用:0次



