名校
解题方法
1 . A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,相关信息如下表:
请用化学用语填空:
(1)A元素在元素周期表中的位置___________ ;C元素和F元素的电负性比较,较小的是___________ (填元素符号)。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为___________ ,B元素所形成的单质分子中σ键与π键数目之比为___________ 。
(3)F元素原子的价电子的轨道表示式是___________ ;G的高价阳离子的溶液与H单质反应的离子方程式为___________ ;元素X与元素E在周期表中呈对角线关系,且元素X的最高价氧化物的水化物也具有两性,试写出X元素的最高价氧化物的水化物与D元素的最高价氧化物的水化物反应的化学方程式___________ 。
| 元素 | 元素相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为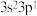 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
(1)A元素在元素周期表中的位置
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为
(3)F元素原子的价电子的轨道表示式是
您最近一年使用:0次
名校
2 . 现有五种元素,其中Y、Z、W为同周期主族元素,Q为第四周期元素,这五种元素的原子序数依次增大。请根据下列相关信息,回答问题。
(1)Q位于第_______ 族,它位于周期表的_______ 区。
(2)离子 的空间构型为:
的空间构型为:_______ ;化合物2W的价层电子对互斥模型为_______ 。
(3)比较 和
和 的键角
的键角 的大小:
的大小:
_______ (填“>”或“<”) ,请用价层电子对互斥理论解释:
,请用价层电子对互斥理论解释:_______ 。
(4)化合物 中,Y元素原子的杂化形式有
中,Y元素原子的杂化形式有_______ ,该化合物中σ键和π键的个数之比为_______ 。
| X元素的核外电子数和电子层数相等,也是宇宙中含量最丰富的元素 |
| Y元素基态原子的最外层中p能级的电子数等于前一能层中电子总数 |
| Z元素基态原子的未成对电子数目是同周期中最多的 |
| W元素基态原子最外能层的p能级中有一个轨道填充2个电子 |
| Q在周期表的第七列 |
(2)离子
 的空间构型为:
的空间构型为:(3)比较
 和
和 的键角
的键角 的大小:
的大小:
 ,请用价层电子对互斥理论解释:
,请用价层电子对互斥理论解释:(4)化合物
 中,Y元素原子的杂化形式有
中,Y元素原子的杂化形式有
您最近一年使用:0次
名校
解题方法
3 . 请回答下列有关问题。
(1)Fe元素按周期表分区属于___________ 区元素
(2)地壳中含量最多的三种元素O、Si、Al中,电负性最大的是___________ 。
(3)钠在火焰上灼烧产生的黄光是一种___________ (填字母)
A.吸收光谱 B.发射光谱
(4)Cu的基态原子的电子排布式是___________ 。
(5)钛被称为继铁、铝之后的第三金属,基态钛原子价电子层的电子排布图是___________ 。
(6)基态Fe3+与Fe2+离子中未成对的电子数之比为___________
(7)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为________ 。
(8)H2O分子的空间构型为___________
(1)Fe元素按周期表分区属于
(2)地壳中含量最多的三种元素O、Si、Al中,电负性最大的是
(3)钠在火焰上灼烧产生的黄光是一种
A.吸收光谱 B.发射光谱
(4)Cu的基态原子的电子排布式是
(5)钛被称为继铁、铝之后的第三金属,基态钛原子价电子层的电子排布图是
(6)基态Fe3+与Fe2+离子中未成对的电子数之比为
(7)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为
(8)H2O分子的空间构型为
您最近一年使用:0次
解题方法
4 . A、B、C、D、E、F六种元素均位于元素周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子占据四个原子轨道;D元素原子的成对电子总数是未成对电子总数的3倍;E与D位于同一主族;F位于第Ⅷ族,在地壳中含量排金属中第二位。
(1)F2+的价电子排布图为_______ 。
(2)B、C、D元素的第一电离能由大到小的顺序是_______ (用元素符号表示)。
(3)B、C、D的某些氢化物的分子中都含有18个电子,B的这种氢化物的中心原子杂化方式为_______ ,等物质的量B、C、D的这种氢化物的分子中含有σ键的个数之比为_______ 。
(4)D常见的两种单质D2和D3,其中_______ (填化学式)在水中的溶解度更大。
(5)B、E可形成分子式为BE2的化合物,其电子式为_______ 。
(6)实验室合成一种由B和C两种元素形成的化合物,该化合物具有三维骨架结构,其中每个B原子与4个C原子形成共价键,每个C原子与3个B原子形成共价键。其化学式为_______ , 预测该化合物熔点_______ 金刚石(填“高于”或“低于”)。
(1)F2+的价电子排布图为
(2)B、C、D元素的第一电离能由大到小的顺序是
(3)B、C、D的某些氢化物的分子中都含有18个电子,B的这种氢化物的中心原子杂化方式为
(4)D常见的两种单质D2和D3,其中
(5)B、E可形成分子式为BE2的化合物,其电子式为
(6)实验室合成一种由B和C两种元素形成的化合物,该化合物具有三维骨架结构,其中每个B原子与4个C原子形成共价键,每个C原子与3个B原子形成共价键。其化学式为
您最近一年使用:0次
名校
5 . 铁元素在地壳中含量丰富,应用广泛:回答以下问题:
(1)基态Fe的价电子排布式为_______ ,其中未成对电子数目为_______ 。
(2)水溶液中 发生水解,水解过程中出现双核阳离子
发生水解,水解过程中出现双核阳离子 。
。

①该双核阳离子中, 原子的配位数为
原子的配位数为_______ ,配体 的空间构型为
的空间构型为_______ ,其键角_______ 109°28′ (填“大于”、“小于”或“等于”)。
②用 可检验溶液中
可检验溶液中 的存在,l mol中
的存在,l mol中 中含有的π键数目为
中含有的π键数目为_______ NA。
(3)铁的氧化物有多种,科研工作者常使用 来表示各种铁氧化物。如图为某种铁的氧化物样品的晶胞结构,其化学式为
来表示各种铁氧化物。如图为某种铁的氧化物样品的晶胞结构,其化学式为_______ 。

(1)基态Fe的价电子排布式为
(2)水溶液中
 发生水解,水解过程中出现双核阳离子
发生水解,水解过程中出现双核阳离子 。
。
①该双核阳离子中,
 原子的配位数为
原子的配位数为 的空间构型为
的空间构型为②用
 可检验溶液中
可检验溶液中 的存在,l mol中
的存在,l mol中 中含有的π键数目为
中含有的π键数目为(3)铁的氧化物有多种,科研工作者常使用
 来表示各种铁氧化物。如图为某种铁的氧化物样品的晶胞结构,其化学式为
来表示各种铁氧化物。如图为某种铁的氧化物样品的晶胞结构,其化学式为
您最近一年使用:0次
名校
6 . 我国部分城市灰霾天比较多,引起灰霾的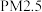 微细粒子包含
微细粒子包含 、
、 、有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量可知,目前造成我国灰霾天气的主要原因是交通污染。
、有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量可知,目前造成我国灰霾天气的主要原因是交通污染。
(1)基态Zn2+的核外电子排布式为___________ 。
(2) 的空间结构是
的空间结构是___________ 。
(3)灰霾中含有大量有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有 、
、 、
、 、HCOOH、
、HCOOH、 等二次污染物。
等二次污染物。
①下列说法正确的是___________ (填序号)。
A. 分子在四氯化碳里的溶解度高于在水中的溶解度
分子在四氯化碳里的溶解度高于在水中的溶解度
B. 分子中碳原子均采取
分子中碳原子均采取 杂化
杂化
C.相同压强下,HCOOH的沸点比 的低
的低
② 中含
中含 键的数目为
键的数目为___________ (设 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(4)水分子的VSEPR模型是___________ ,空间结构为___________ 。
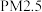 微细粒子包含
微细粒子包含 、
、 、有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量可知,目前造成我国灰霾天气的主要原因是交通污染。
、有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量可知,目前造成我国灰霾天气的主要原因是交通污染。(1)基态Zn2+的核外电子排布式为
(2)
 的空间结构是
的空间结构是(3)灰霾中含有大量有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有
 、
、 、
、 、HCOOH、
、HCOOH、 等二次污染物。
等二次污染物。①下列说法正确的是
A.
 分子在四氯化碳里的溶解度高于在水中的溶解度
分子在四氯化碳里的溶解度高于在水中的溶解度B.
 分子中碳原子均采取
分子中碳原子均采取 杂化
杂化C.相同压强下,HCOOH的沸点比
 的低
的低②
 中含
中含 键的数目为
键的数目为 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。(4)水分子的VSEPR模型是
您最近一年使用:0次
2021-02-19更新
|
482次组卷
|
3卷引用:广东省东莞市东华高级中学2022-2023学年高二下学期3月月考化学试题
名校
解题方法
7 . 氢原子是最轻的原子,人们曾预言它可能是所有元素之母。碳是地球上组成生命的最基本的 元素之一。按要求回答:
(1)宇宙中含量最多的元素是氢和______ 。基态碳原子的核外电子占有______ 个原子轨道。
(2)光化学烟雾中除了含有 NOx 外,还含有 HCOOH、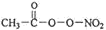 (PAN)等二次污染物。
(PAN)等二次污染物。
①PAN 中 C 的杂化方式有______ 。1mol PAN 中含有的σ键数目为______ 。组成PAN 的元素的电负性大小顺序为______ 。
②相同压强下,HCOOH 的沸点比 CH3OCH3______ (填“高”或“低”),
(3)水溶液中有 H3O+、H5O2+、H9O4+ 等微粒的形式。请画出 H5O2的结构式:______ 。
(4)硅和碳在同一主族。下图为 SiO2晶胞中 Si 原子沿 z 轴方向在 xy 平面的投影图(即俯视图),其 中 O原子略去,Si 原子旁标注的数字表示每个 Si 原子位于 z 轴的高度,则 SiA 与 SiB 之间的距离是______ nm。
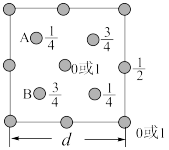 (d 的单位为 nm)
(d 的单位为 nm)
(1)宇宙中含量最多的元素是氢和
(2)光化学烟雾中除了含有 NOx 外,还含有 HCOOH、
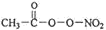 (PAN)等二次污染物。
(PAN)等二次污染物。①PAN 中 C 的杂化方式有
②相同压强下,HCOOH 的沸点比 CH3OCH3
(3)水溶液中有 H3O+、H5O2+、H9O4+ 等微粒的形式。请画出 H5O2的结构式:
(4)硅和碳在同一主族。下图为 SiO2晶胞中 Si 原子沿 z 轴方向在 xy 平面的投影图(即俯视图),其 中 O原子略去,Si 原子旁标注的数字表示每个 Si 原子位于 z 轴的高度,则 SiA 与 SiB 之间的距离是
 (d 的单位为 nm)
(d 的单位为 nm)
您最近一年使用:0次
2020-03-27更新
|
221次组卷
|
4卷引用:菏泽一中2020届高三3月份化学质量检测
名校
解题方法
8 . A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是_______ (用对应的元素符号表示);基态D原子的电子排布式为______ 。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取_____ 杂化;BC3-的立体构型为______ (用文字描述)。
(3)1mol AB-中含有的π键个数为______ 。
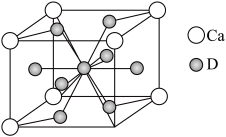
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比______ 。
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________ (填数值);氢在合金中的密度为________ (保留2位有效数字)。
(1)A、B、C的第一电离能由小到大的顺序是
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取
(3)1mol AB-中含有的π键个数为
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比

(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=
您最近一年使用:0次
2019-12-08更新
|
180次组卷
|
12卷引用:江西省临川一中2020届高三上学期第一次联考化学试题
江西省临川一中2020届高三上学期第一次联考化学试题(已下线)2014年高考化学指导冲关 第13练物质结构与性质练习卷(已下线)2014届高考化学二轮专题冲刺第16讲 物质结构与性质练习卷(已下线)2014高考名师推荐化学--预测172016届四川省新津中学高三下学期入学考试化学试卷2018版化学(苏教版)高考总复习专题十一课时跟踪训练--微粒间作用力与物质性质【全国百强校】重庆市第一中学校2019届高三上学期期中考试理科综合化学试题【市级联考】湖北省鄂州市2019届高三上学期期中考试理科综合化学试题(已下线)第11章 单元测试(测)-《2020年高考一轮复习讲练测》广东省梅州市五华县2020届高三上学期期末质检理综化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编(已下线)第十一章 能力提升检测卷-2021年高考化学一轮复习讲练测
9 . 已知A,B,C,D,E、F六种元素的原子序数依次增大,其中A元素的原子半径在短周期元素中最小;B原子核外电子有6种不同的运动状态;D原子L层上有2对成对电子。E元素在地壳中含量居第二位,F 与E位于同一周期,且是该周期元素中电负性最大的元素。
根据以上信息回答下列问题:
(1)E元素可分别与D元素、F元素形成两种常见化合物,这两种化合物的熔沸点高低顺序为____________ (用化学式表示),原因是_____________________ 。
(2)C的氢化物比下周期同族元素的氢化物沸点还要高,其原因是____________ 。
(3)1 mol B2A2分子中含σ键的数目是____________ 。
(4)图(Ⅰ)是B元素的单质晶体的一个晶胞,该晶胞中含有_____ 个原子,该晶体类型为________ 。
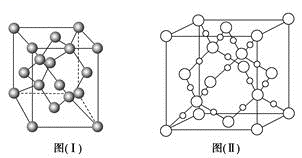
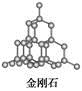
(5)E单质存在与金刚石结构类似的晶体,晶体中原子之间以_________ 相结合,其晶胞中共有8个原子,其中在面心位置贡献______ 个原子。
(6)BD2在高温高压下所形成的晶体其晶胞如图(Ⅱ)所示。该晶体的类型属于_______ (填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为__________ 。
根据以上信息回答下列问题:
(1)E元素可分别与D元素、F元素形成两种常见化合物,这两种化合物的熔沸点高低顺序为
(2)C的氢化物比下周期同族元素的氢化物沸点还要高,其原因是
(3)1 mol B2A2分子中含σ键的数目是
(4)图(Ⅰ)是B元素的单质晶体的一个晶胞,该晶胞中含有


(5)E单质存在与金刚石结构类似的晶体,晶体中原子之间以
(6)BD2在高温高压下所形成的晶体其晶胞如图(Ⅱ)所示。该晶体的类型属于
您最近一年使用:0次
10-11高二下·江西吉安·阶段练习
解题方法
10 . X、Y、Z、Q、W五种元素的原子序数依次递增。已知:
①W的原子序数为29,其余的均为短周期主族元素;
②X原子的价电子排布为nsnnpn;
③Y元素是空气中含量最多的元素;
④Z元素的电负性大于Y元素,Z原子核外的成对电子数与未成对电子数之比为3:1;
⑤Q元素的电离能数据见下表(单位:kJ/mol)。
(1)W元素位于周期表的_____ 区,W2+ 的核外电子排布式是___________________ 。
(2)X、Y、Z三种元素的第一电离能数值由小到大的顺序为_________ (用元素符号作答)。
(3)Q元素在周期表中的位置为______ (填周期数和族序数),它的稳定价态为_____ 。
(4)常温下,Y单质的化学性质很稳定,原因是___________________________________ 。
(5)X的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为________ 。
①W的原子序数为29,其余的均为短周期主族元素;
②X原子的价电子排布为nsnnpn;
③Y元素是空气中含量最多的元素;
④Z元素的电负性大于Y元素,Z原子核外的成对电子数与未成对电子数之比为3:1;
⑤Q元素的电离能数据见下表(单位:kJ/mol)。
| I1 | I2 | I3 | I4 | I5 | ...... |
| 578 | 1817 | 2745 | 11575 | 14380 | ...... |
(1)W元素位于周期表的
(2)X、Y、Z三种元素的第一电离能数值由小到大的顺序为
(3)Q元素在周期表中的位置为
(4)常温下,Y单质的化学性质很稳定,原因是
(5)X的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为
您最近一年使用:0次



