解题方法
1 . 三氯化六氨合钴(Ⅲ)(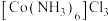 )是一种重要的化工原料,实验室以
)是一种重要的化工原料,实验室以 为原料制备三氯化六氨合钴。
为原料制备三氯化六氨合钴。
Ⅰ. 的制备
的制备
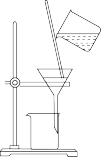
已知 易潮解,可用Co与
易潮解,可用Co与 反应制得,装置如下:
反应制得,装置如下:
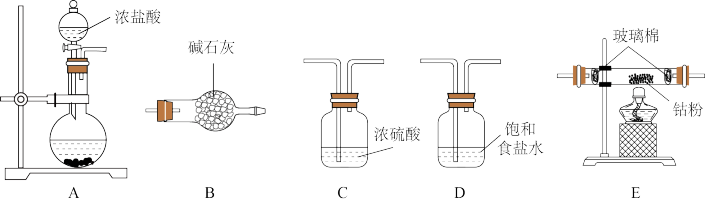
(1)装置连接的顺序为A→_______ 。
(2)A中圆底烧瓶盛放的固体药品为_______ (填化学式,一种即可)。
(3)B的作用为_______ 。
(4)_______ 时点燃E处酒精灯。
Ⅱ.实验室制备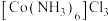 的流程如下:
的流程如下:

(5)滴加 时若速度过快,产物中含有
时若速度过快,产物中含有 杂质,原因为:
杂质,原因为:_______ 。
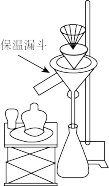
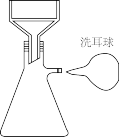
(6)趁热过滤需要用到的装置为_______ (填字母)。
趁热过滤后,在滤液中加入浓盐酸的目的是_______ 。
(7)在合成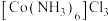 时,往往由于条件控制不当而产生
时,往往由于条件控制不当而产生 ,1mol
,1mol 中
中 键的数目为
键的数目为_______ 。
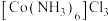 )是一种重要的化工原料,实验室以
)是一种重要的化工原料,实验室以 为原料制备三氯化六氨合钴。
为原料制备三氯化六氨合钴。Ⅰ.
 的制备
的制备已知
 易潮解,可用Co与
易潮解,可用Co与 反应制得,装置如下:
反应制得,装置如下:
(1)装置连接的顺序为A→
(2)A中圆底烧瓶盛放的固体药品为
(3)B的作用为
(4)
Ⅱ.实验室制备
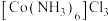 的流程如下:
的流程如下:
(5)滴加
 时若速度过快,产物中含有
时若速度过快,产物中含有 杂质,原因为:
杂质,原因为:(6)趁热过滤需要用到的装置为
| A | B | C |
 |  |  |
(7)在合成
 时,往往由于条件控制不当而产生
时,往往由于条件控制不当而产生 ,1mol
,1mol 中
中 键的数目为
键的数目为
您最近一年使用:0次
名校
解题方法
2 . 已知a、b、c、d、e、f是中学化学中常见的七种元素,其结构或者性质信息如下表所示:
(1)写出元素d基态原子的核外电子排布是_______ 。
(2)写出元素e基态原子的价电子轨道排布式_______ 。
(3)元素a的原子核外共有_______ 种不同运动状态的电子,有_______ 种不同能量的电子。
(4)c、f的气态氢化物的稳定性顺序为_______ (填化学式),请比较a、b、c的电负性大小顺序为_______ (填元素符号)。
(5)用电子式表示ac2的形成过程_______ ,在分子中 键与π键的比值关系
键与π键的比值关系_______ 。
(6)元素f位于周期表中_______ 区。
(7)氢元素与b元素形成的10电子分子的价层电子对数____ ,分子的空间构型为_____ 。
(8)元素e第二电离能为1958kJ/mol,元素d的第二电离能为1753kJ/mol,元素e的第二电离能大于元素d的第二电离能的原因是_______ 。
| 元素 | 结构或者性质信息 |
| a | 原子的L层上s能级电子数等于p能级电子数 |
| b | 非金属元素,其单质为气态,有多种氧化物且都是大气污染物 |
| c | 原子的最外层电子数是内层电子数的3倍 |
| d | 第四周期VIII族中原子序数最大的元素 |
| e | 元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
| f | 单质常温、常压下是易挥发的液体,基态原子的N层上有1个未成对的p电子 |
(2)写出元素e基态原子的价电子轨道排布式
(3)元素a的原子核外共有
(4)c、f的气态氢化物的稳定性顺序为
(5)用电子式表示ac2的形成过程
 键与π键的比值关系
键与π键的比值关系(6)元素f位于周期表中
(7)氢元素与b元素形成的10电子分子的价层电子对数
(8)元素e第二电离能为1958kJ/mol,元素d的第二电离能为1753kJ/mol,元素e的第二电离能大于元素d的第二电离能的原因是
您最近一年使用:0次
解题方法
3 . 回答下列问题
(1)1 mol CO2中含有的σ键数目为___________ ,π键数目为___________ 。
(2)CH4、NH3、H2O、HF分子中共价键的极性由强到弱的顺序是___________ 。
(3)铜原子的外围电子排布图:___________ 。写出钴的简化电子排布式___________ 。基态Fe2+与Fe3+离子中未成对的电子数之比为___________ 。
(4)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为___________、___________(填标号)。
(5)bte的分子式为C6H8N6,其结构简式如图所示。

①bte分子中碳原子轨道杂化类型为___________ 。
②1 mol bte分子中含σ键的数目为___________ mol。
(1)1 mol CO2中含有的σ键数目为
(2)CH4、NH3、H2O、HF分子中共价键的极性由强到弱的顺序是
(3)铜原子的外围电子排布图:
(4)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为___________、___________(填标号)。
A. | B.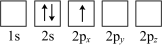 |
C.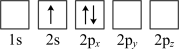 | D.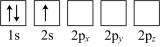 |

①bte分子中碳原子轨道杂化类型为
②1 mol bte分子中含σ键的数目为
您最近一年使用:0次
4 . 金刚石、石墨、C60、碳纳米管都是碳元素的单质形式,它们互为同素异形体,如图依次是石墨、金刚石和C60的结构图,回答问题

(1)石墨属于_______ 晶体,石墨晶体中C的杂化方式为_______ ,层与层之间以_______ 结合,1mol石墨含有_______ molσC-C键。
(2)金刚石晶体中C的杂化方式为_______ ,金刚石分子中的最小环为_______ 元环,一个环被_______ 个C原子共用,一个金刚石晶胞中有_______ 个σC-C键。
(3)第三张图是C60的分子结构模型,C60属于_______ 晶体,每个C60分子与_______ 个C60分子紧邻。
(4)C60能与金属钾化合生成具有超导性的K3C60,在K3C60中阴阳离子个数比为1∶3,则K3C60属于_______ 晶体。
(5)CO可以和很多过渡金属形成配合物。金属镍粉在CO气流中轻微地加热,可生成液态的Ni(CO)4,用配位键表示Ni(CO)4的结构为_______ 。
(6)科学发现,C和Ni、Mg元素的原子形成的晶体也具有超导性,其晶胞的结构特点如图,则该晶胞中每个Mg原子周围与它最近且距离相等的碳原子、镍原子各有_______ 个,_______ 个。


(1)石墨属于
(2)金刚石晶体中C的杂化方式为
(3)第三张图是C60的分子结构模型,C60属于
(4)C60能与金属钾化合生成具有超导性的K3C60,在K3C60中阴阳离子个数比为1∶3,则K3C60属于
(5)CO可以和很多过渡金属形成配合物。金属镍粉在CO气流中轻微地加热,可生成液态的Ni(CO)4,用配位键表示Ni(CO)4的结构为
(6)科学发现,C和Ni、Mg元素的原子形成的晶体也具有超导性,其晶胞的结构特点如图,则该晶胞中每个Mg原子周围与它最近且距离相等的碳原子、镍原子各有

您最近一年使用:0次
解题方法
5 . 丁二酮肟( )是检验
)是检验 的灵敏试剂,在稀氨水介质中,
的灵敏试剂,在稀氨水介质中, 与丁二酮肟反应可生成鲜红色沉淀丁二酮肟镍,其分子结构如图所示。
与丁二酮肟反应可生成鲜红色沉淀丁二酮肟镍,其分子结构如图所示。

回答下列问题:
(1)Ni在元素周期表中的位置为_______ ;基态Ni中最外层电子所占据的原子轨道有_______ 个伸展方向。
(2)Ni与Ca位于同一周期且最外层电子数相同,单质Ni的熔点明显高于Ca,其原因是____ 。
(3)1mol丁二酮肟分子含有σ键数目为_______ ( 是阿伏加德罗常数的值)。
是阿伏加德罗常数的值)。
(4)丁二酮肟镍分子中C原子的杂化轨道类型有_______ ;元素N和O在周期表中相邻,元第一电离能 的原因是
的原因是_______ 。
(5)丁二酮肟镍分子内不存在的作用力有_______ (填序号)。
A.金属键 B.氢键 C.π键 D.配位键 E.范德华力
 )是检验
)是检验 的灵敏试剂,在稀氨水介质中,
的灵敏试剂,在稀氨水介质中, 与丁二酮肟反应可生成鲜红色沉淀丁二酮肟镍,其分子结构如图所示。
与丁二酮肟反应可生成鲜红色沉淀丁二酮肟镍,其分子结构如图所示。
回答下列问题:
(1)Ni在元素周期表中的位置为
(2)Ni与Ca位于同一周期且最外层电子数相同,单质Ni的熔点明显高于Ca,其原因是
(3)1mol丁二酮肟分子含有σ键数目为
 是阿伏加德罗常数的值)。
是阿伏加德罗常数的值)。(4)丁二酮肟镍分子中C原子的杂化轨道类型有
 的原因是
的原因是(5)丁二酮肟镍分子内不存在的作用力有
A.金属键 B.氢键 C.π键 D.配位键 E.范德华力
您最近一年使用:0次
解题方法
6 . 如图表示不同类型共价键形成时电子云重叠情况:

(1)其中形成的化学键属于镜面对称的有_______ 。
(2)下列物质中,通过方式①化学键形成的是_______ ;通过方式②化学键形成的是_______ ;只通过方式③化学键形成的是_______ ;同时含有③、④、⑤三种方式化学键的物质是_______ 。
A.Cl2 B.H2 C.N2 D.H2S
(3)某有机物分子的结构简式为 ,该分子中,有
,该分子中,有_______ 个π键,有_______ 个σ键,C原子的杂化方式为_______ 。

(1)其中形成的化学键属于镜面对称的有
(2)下列物质中,通过方式①化学键形成的是
A.Cl2 B.H2 C.N2 D.H2S
(3)某有机物分子的结构简式为
 ,该分子中,有
,该分子中,有
您最近一年使用:0次
名校
解题方法
7 . 吡啶( )是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
)是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
 +
+ 



请回答下列问题:
(1)吡啶分子呈_______ 形;MPy 分子中碳原子的杂化方式为________ ,其组成元素的第一电离能由大到小的顺序为__________ 。
(2)EPy晶体中微粒间的作用力类型有_______ (填标号)。
a.离子键 b.金属键 c.极性键 d.非极性键 e.配位键 f.氢键
(3)反应①中每生成1 mol EPy,断裂_______ 个π键,形成______ 个 σ键。
(4)分子中的大π键可用 表示,其中m表示形成大
表示,其中m表示形成大 键的原子个数,n表示参与形成大
键的原子个数,n表示参与形成大 键的电子个数,则吡啶中大
键的电子个数,则吡啶中大 键表示为
键表示为__________ 。
(5)吡啶、Cl-与Pt2+形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。

Pt2+的配位数为_______ 。顺式二氯二吡啶合铂分子能否溶于水______ (填“能” 或“否”),简述理由______ 。
 )是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
)是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。 +
+ 



请回答下列问题:
(1)吡啶分子呈
(2)EPy晶体中微粒间的作用力类型有
a.离子键 b.金属键 c.极性键 d.非极性键 e.配位键 f.氢键
(3)反应①中每生成1 mol EPy,断裂
(4)分子中的大π键可用
 表示,其中m表示形成大
表示,其中m表示形成大 键的原子个数,n表示参与形成大
键的原子个数,n表示参与形成大 键的电子个数,则吡啶中大
键的电子个数,则吡啶中大 键表示为
键表示为(5)吡啶、Cl-与Pt2+形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。

Pt2+的配位数为
您最近一年使用:0次
名校
解题方法
8 . 2021年5月15日,天问一号探测器成功着陆于火星。据了解火星上存在大量的含氮化合物,科学家推测火星生命可能主要以氮、碳、硅、铜为基体构成。请回答下列问题:
(1)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为_______ 。SiCl4可发生水解反应,机理如下:

含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为_______ (填标号)。SiCl4的熔沸点_______ (填“高于”或“低于”)CCl4,原因是_______ 。
(2)邻氨基吡啶( )的铜配合物在有机不对称合成中起催化诱导效应。设NA为阿伏加德罗常数的值,1 mol
)的铜配合物在有机不对称合成中起催化诱导效应。设NA为阿伏加德罗常数的值,1 mol  中含有σ键的数目为
中含有σ键的数目为_______ 。
(3)一种鸟嘌呤和吡咯的结构如图。

①鸟嘌呤中轨道之间的夹角∠1_______ ∠2(填“>”或“<”)
②分子中的大π键可以用符号π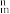 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡咯中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡咯中的大π键可表示为_______ 。
(4)火星岩石中存在大量的氮化镓,氮化镓为六方晶胞,结构如图所示。

若该晶体密度为d g·cm-3,晶胞参数a=b≠c(单位:nm),a、b夹角为120°,阿伏加德罗常数的值为NA,则晶胞参数c=_______ nm(写出代数式)。
(1)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为

含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为
(2)邻氨基吡啶(
 )的铜配合物在有机不对称合成中起催化诱导效应。设NA为阿伏加德罗常数的值,1 mol
)的铜配合物在有机不对称合成中起催化诱导效应。设NA为阿伏加德罗常数的值,1 mol  中含有σ键的数目为
中含有σ键的数目为(3)一种鸟嘌呤和吡咯的结构如图。

①鸟嘌呤中轨道之间的夹角∠1
②分子中的大π键可以用符号π
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡咯中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则该吡咯中的大π键可表示为(4)火星岩石中存在大量的氮化镓,氮化镓为六方晶胞,结构如图所示。

若该晶体密度为d g·cm-3,晶胞参数a=b≠c(单位:nm),a、b夹角为120°,阿伏加德罗常数的值为NA,则晶胞参数c=
您最近一年使用:0次
9 . A、B、C、D、E是原子序数依次增大的短周期主族元素,已知基态A、E原子中有两个未成对电子,基态B、C、D原子中均有一个未成对电子。基态A原子中只有两种电子云轮廓不同的能级,且两种能级上的电子总数相等,E的单质能形成一种类似于金刚石结构的共价晶体。
(1)B、C的元素名称分别为_______ 、_______ 。
(2)B和E可组成一种五原子共价化合物,该化合物的电子式为_______ 。
(3)请写出能比较出A和B的非金属性强弱反应的化学方程式:_______ 。
(4)将D的单质加入C的最高价氧化物对应水化物的溶液中,产生的现象是_______ ,写出发生反应的化学方程式:_______ 。
(5)1 mol E的单质晶体中含有_______ molE-E键。
(1)B、C的元素名称分别为
(2)B和E可组成一种五原子共价化合物,该化合物的电子式为
(3)请写出能比较出A和B的非金属性强弱反应的化学方程式:
(4)将D的单质加入C的最高价氧化物对应水化物的溶液中,产生的现象是
(5)1 mol E的单质晶体中含有
您最近一年使用:0次
名校
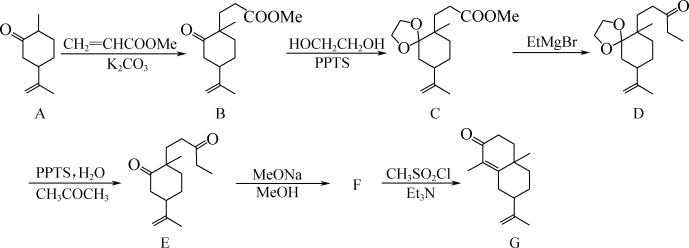
10 . 化合物G是某化工生产中的重要中间体,其合成路线如下:
Me: Et:
Et:
(1)1mol有机物B中所含π键的数目为_______ mol。
(2)D中含有_______ 个手性碳原子。
(3)E→F的反应类型为加成反应,则F的结构简式为_______ 。
(4)C的一种同分异构体同时满足下列条件,写出一种该同分异构体的结构简式:_______ 。
①能与 溶液发生显色反应。
溶液发生显色反应。
②有四种不同化学环境的氢原子。
(5)已知: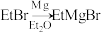 。写出以
。写出以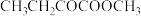 和
和 为原料制备
为原料制备 的合成路线流程图
的合成路线流程图_______ (无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。

Me:
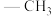 Et:
Et: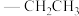
(1)1mol有机物B中所含π键的数目为
(2)D中含有
(3)E→F的反应类型为加成反应,则F的结构简式为
(4)C的一种同分异构体同时满足下列条件,写出一种该同分异构体的结构简式:
①能与
 溶液发生显色反应。
溶液发生显色反应。②有四种不同化学环境的氢原子。
(5)已知:
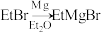 。写出以
。写出以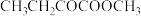 和
和 为原料制备
为原料制备 的合成路线流程图
的合成路线流程图
您最近一年使用:0次



