1 . 原子序数小于等于36的Q、W、X、Y、Z五种元素,其中Q是原子半径最小的元素,W和Y的基态原子2p能级所含成单电子数均为2,Z的基态原子核外含有13种运动状态不同的电子。回答下列问题(涉及元素时用对应的元素符号表示):
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是_______ 。
(2) 与
与 所含
所含 键的比值为
键的比值为_______ 。
(3)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为_______ 。

(4)实验室合成一种由W和X两种元素形成的化合物,该化合物具有空间网状结构,其中每个W原子与4个X原子形成共价键,每个X原子与3个W原子形成共价键。
①该化合物的化学式为:_______ 。
②预测该化合物熔点应_______ 金刚石(填“高于”或“低于”)。
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是
(2)
 与
与 所含
所含 键的比值为
键的比值为(3)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为

(4)实验室合成一种由W和X两种元素形成的化合物,该化合物具有空间网状结构,其中每个W原子与4个X原子形成共价键,每个X原子与3个W原子形成共价键。
①该化合物的化学式为:
②预测该化合物熔点应
您最近一年使用:0次
2023-01-31更新
|
263次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2023-2024学年高二上学期1月期末化学试题
名校
解题方法
2 . 元素及其化合物的性质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的。肼可用作火箭燃料,燃烧时发生的反应是 。若该反应中有4molN—H键断裂,则形成的π键有
。若该反应中有4molN—H键断裂,则形成的π键有_______ mol。
(2)氯化溴(BrCl)的化学性质类似于卤素单质,写出BrCl与水反应的化学方程式_______ 。
(3)请根据下表提供的第一电离能数据判断,还原性最强的卤素原子是_______ (写出名称)。
(4)已知下列5种羧酸,①CF3COOH②CH3COOH③CH2FCOOH④CH2ClCOOH其酸性由强到弱的顺序为_______ (填序号)。
(5)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是_______ (填“极性”或“非极性”)分子。
(6)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如图)。
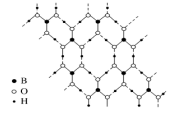
则1molH3BO3形成的晶体中有_______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸B(OH)3·H2O,它电离生成少量[B(OH)4]-和H+,其中B原子的杂化方式是_______ 。
(1)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的。肼可用作火箭燃料,燃烧时发生的反应是
 。若该反应中有4molN—H键断裂,则形成的π键有
。若该反应中有4molN—H键断裂,则形成的π键有(2)氯化溴(BrCl)的化学性质类似于卤素单质,写出BrCl与水反应的化学方程式
(3)请根据下表提供的第一电离能数据判断,还原性最强的卤素原子是
| 元素 | 氟 | 氯 | 溴 | 碘 |
| 第一电离能/(kJ·mol-1) | 1681 | 1251 | 1140 | 1008 |
(4)已知下列5种羧酸,①CF3COOH②CH3COOH③CH2FCOOH④CH2ClCOOH其酸性由强到弱的顺序为
(5)CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是
(6)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如图)。

则1molH3BO3形成的晶体中有
您最近一年使用:0次
名校
3 . 现有五种元素,其中Y、Z、W为同周期主族元素,Q为第四周期元素,这五种元素的原子序数依次增大。请根据下列相关信息,回答问题。
(1)Q位于第_______ 族,它位于周期表的_______ 区。
(2)离子 的空间构型为:
的空间构型为:_______ ;化合物2W的价层电子对互斥模型为_______ 。
(3)比较 和
和 的键角
的键角 的大小:
的大小:
_______ (填“>”或“<”) ,请用价层电子对互斥理论解释:
,请用价层电子对互斥理论解释:_______ 。
(4)化合物 中,Y元素原子的杂化形式有
中,Y元素原子的杂化形式有_______ ,该化合物中σ键和π键的个数之比为_______ 。
| X元素的核外电子数和电子层数相等,也是宇宙中含量最丰富的元素 |
| Y元素基态原子的最外层中p能级的电子数等于前一能层中电子总数 |
| Z元素基态原子的未成对电子数目是同周期中最多的 |
| W元素基态原子最外能层的p能级中有一个轨道填充2个电子 |
| Q在周期表的第七列 |
(2)离子
 的空间构型为:
的空间构型为:(3)比较
 和
和 的键角
的键角 的大小:
的大小:
 ,请用价层电子对互斥理论解释:
,请用价层电子对互斥理论解释:(4)化合物
 中,Y元素原子的杂化形式有
中,Y元素原子的杂化形式有
您最近一年使用:0次
4 . 钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。生产钕铁硼磁铁的主要原材料有稀土金属钕、高纯铁、铝、硼等。回答下列问题:
(1)钕(Nd)为60号元素,在周期表中位于第___________ 周期。基态硼原子中占据最高能级的电子,电子云轮廓图形状为___________ 。Fe2+的价电子排布图___________
(2)铜能与类卤素(CN)2反应生成Cu(CN)2,1 mol (CN)2分子中含有π键的数目为___________ 。
(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从大到小的顺序为___________ 。
②[Cu(NH3)4]SO4中,不存在的化学键的类型有___________ (填选项)。
A.离子键 B.配位键 C.非极性键 D.极性键
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___________ 。
(1)钕(Nd)为60号元素,在周期表中位于第
(2)铜能与类卤素(CN)2反应生成Cu(CN)2,1 mol (CN)2分子中含有π键的数目为
(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从大到小的顺序为
②[Cu(NH3)4]SO4中,不存在的化学键的类型有
A.离子键 B.配位键 C.非极性键 D.极性键
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
您最近一年使用:0次
解题方法
5 . 近年来,我国工程建设自主创新能力实现大跨越,尤其在新材料研究方面有重大突破,回答下列问题:
(1)钛是一种新兴的结构材料,比钢轻、比铝硬。基态钛原子的价电子排布式为_____ , 与钛同周期的元素中,基态原子的未成对电子数与钛相间的有_____ 种;
(2)铁能与三氮唑(结构见图甲)形成多种配合物。
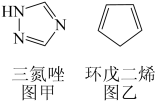
①l mol三氮唑中所含σ键的数目为_____ mol; 碳原子杂化方式是____ ;
②三氮唑的沸点为260°C,与之结构相似且相对分子质量接近的环戊二烯(结构见图乙)的沸点为42.5℃,前者沸点较高的原因是_____ 。
(3)碳化钨是耐高温耐磨材料。图丙为碳化钨晶体的部分结构,碳原子嵌入金属的晶格间隙,并不破坏原有金属的晶格,形成填隙化合物。
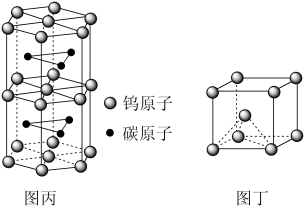
①在该结构中,每个钨原子周围距离其最近的碳原子有_____ 个:
②假设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为M g•mol-1,密度为d g•cm-3,则阿伏加德罗常数的值NA用上述数据表示为_____ 。
③金属镁的晶体结构与碳化钨相似,金属镁的晶胞可用图丁表示,已知镁原子的半径为r pm,晶胞高为h pm,求晶胞中镁原子的空间利用率_______ (用化简后含字时π、r和h的代数式表示)
(1)钛是一种新兴的结构材料,比钢轻、比铝硬。基态钛原子的价电子排布式为
(2)铁能与三氮唑(结构见图甲)形成多种配合物。

①l mol三氮唑中所含σ键的数目为
②三氮唑的沸点为260°C,与之结构相似且相对分子质量接近的环戊二烯(结构见图乙)的沸点为42.5℃,前者沸点较高的原因是
(3)碳化钨是耐高温耐磨材料。图丙为碳化钨晶体的部分结构,碳原子嵌入金属的晶格间隙,并不破坏原有金属的晶格,形成填隙化合物。

①在该结构中,每个钨原子周围距离其最近的碳原子有
②假设该部分晶体的体积为Vcm3,碳化钨的摩尔质量为M g•mol-1,密度为d g•cm-3,则阿伏加德罗常数的值NA用上述数据表示为
③金属镁的晶体结构与碳化钨相似,金属镁的晶胞可用图丁表示,已知镁原子的半径为r pm,晶胞高为h pm,求晶胞中镁原子的空间利用率
您最近一年使用:0次
2021-03-14更新
|
433次组卷
|
2卷引用:吉林省长春市普通高中2021届高三质量监测(二)(二模)理综化学试题
名校
6 . 我国部分城市灰霾天比较多,引起灰霾的 微细粒子包含
微细粒子包含 、
、 、有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量可知,目前造成我国灰霾天气的主要原因是交通污染。
、有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量可知,目前造成我国灰霾天气的主要原因是交通污染。
(1)基态Zn2+的核外电子排布式为___________ 。
(2) 的空间结构是
的空间结构是___________ 。
(3)灰霾中含有大量有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有 、
、 、
、 、HCOOH、
、HCOOH、 等二次污染物。
等二次污染物。
①下列说法正确的是___________ (填序号)。
A. 分子在四氯化碳里的溶解度高于在水中的溶解度
分子在四氯化碳里的溶解度高于在水中的溶解度
B. 分子中碳原子均采取
分子中碳原子均采取 杂化
杂化
C.相同压强下,HCOOH的沸点比 的低
的低
② 中含
中含 键的数目为
键的数目为___________ (设 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(4)水分子的VSEPR模型是___________ ,空间结构为___________ 。
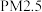 微细粒子包含
微细粒子包含 、
、 、有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量可知,目前造成我国灰霾天气的主要原因是交通污染。
、有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量可知,目前造成我国灰霾天气的主要原因是交通污染。(1)基态Zn2+的核外电子排布式为
(2)
 的空间结构是
的空间结构是(3)灰霾中含有大量有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有
 、
、 、
、 、HCOOH、
、HCOOH、 等二次污染物。
等二次污染物。①下列说法正确的是
A.
 分子在四氯化碳里的溶解度高于在水中的溶解度
分子在四氯化碳里的溶解度高于在水中的溶解度B.
 分子中碳原子均采取
分子中碳原子均采取 杂化
杂化C.相同压强下,HCOOH的沸点比
 的低
的低②
 中含
中含 键的数目为
键的数目为 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。(4)水分子的VSEPR模型是
您最近一年使用:0次
2021-02-19更新
|
481次组卷
|
3卷引用:吉林省长春外国语学校2021-2022学年高二上学期期末考试化学试题
7 . Li、Fe、As、Zn等均为重要的合金材料,回答下列问题:
(1)Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因是______ 。
(2)KSCN和K4[Fe(CN)6]常用于检验Fe3+,SCN-的立体构型为______ ,K4[Fe(CN)6]中所含元素第一电离能由大到小的顺序为______ 。Fe与Co既在同一周期,又在同一族,Co3+通常易形成六配位的配合物,已知CoCl3·6H2O有多种结构,若取1molCoCl3·6H2O溶解于水后滴加足量的硝酸银溶液,能够形成2mol沉淀,则CoCl3·6H2O中配离子为______ 。
(3)H3AsO3的酸性弱于H3AsO4的原因为______ 。含砷有机物“对氨基苯胂酸”的结构简式如图,As原子轨道杂化类型为______ ,1mol对氨基苯胂酸含σ键数目为______ 。

(4)锌和镉位于同副族,而锌与铜相邻。现有4种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是______ (填字母)。
A.④②①③ B.④②③① C.①②④③ D.①④③②
若Zn基态原子将次外层1个d电子激发进入最外层的np能级,则该激发态原子的价电子排布式为______ 。
(1)Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因是
(2)KSCN和K4[Fe(CN)6]常用于检验Fe3+,SCN-的立体构型为
(3)H3AsO3的酸性弱于H3AsO4的原因为

(4)锌和镉位于同副族,而锌与铜相邻。现有4种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是
A.④②①③ B.④②③① C.①②④③ D.①④③②
若Zn基态原子将次外层1个d电子激发进入最外层的np能级,则该激发态原子的价电子排布式为
您最近一年使用:0次
名校
解题方法
8 . 原子序数小于36的X、Y、Z、R、W五种元素,其中X是周期表中原子半径最小的元素,Y是形成化合物种类最多的元素,Z原子基态时2p原子轨道上有3个未成对的电子,R单质占空气体积的 ;W的原子序数为29。回答下列问题:
;W的原子序数为29。回答下列问题:
(1)Y2X4分子中Y原子轨道的杂化类型为________ ,1mol Z2X4含有σ键的数目为 ________ 。
(2)化合物ZX3与化合物X2R的VSEPR构型相同,但立体构型不同,ZX3的立体构型为________ ,两种化合物分子中化学键的键角较小的是________ (用分子式表示,下同)。
(3)与R同主族的三种非金属元素与X可形成结构相似的三种物质,试推测三者的稳定性由大到小的顺序________ ,理由是 ________ ;三者的沸点由高到低的顺序是 ________ ,解释原因________ 。
(4)元素Y的一种氧化物与元素Z的单质互为等电子体,元素Y的这种氧化物的分子式是________ 。
(5)W元素有________ 个运动状态不同的电子,其基态原子的价电子排布式为________ 。
 ;W的原子序数为29。回答下列问题:
;W的原子序数为29。回答下列问题:(1)Y2X4分子中Y原子轨道的杂化类型为
(2)化合物ZX3与化合物X2R的VSEPR构型相同,但立体构型不同,ZX3的立体构型为
(3)与R同主族的三种非金属元素与X可形成结构相似的三种物质,试推测三者的稳定性由大到小的顺序
(4)元素Y的一种氧化物与元素Z的单质互为等电子体,元素Y的这种氧化物的分子式是
(5)W元素有
您最近一年使用:0次
2019-05-06更新
|
102次组卷
|
3卷引用:吉林省辽源市田家炳高级中学2018-2019学年高二下学期期中考试化学试题
吉林省辽源市田家炳高级中学2018-2019学年高二下学期期中考试化学试题四川省宜宾市第四中学2018-2019学年高二下学期期中考试化学试题(已下线)2019年6月16日 《每日一题》选修3-每周一测
9 . (1)下列反应曾用于检测司机是否酒后驾驶:2 +3CH3CH2OH+16H++13H2O
+3CH3CH2OH+16H++13H2O 4[Cr(H2O)6]3++3CH3COOH
4[Cr(H2O)6]3++3CH3COOH
①配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是___ (填元素符号)。
②CH3COOH中C原子轨道杂化类型为___ ;1 mol CH3COOH分子含有σ键的数目为___ 。
(2)CS2分子中,C原子的杂化轨道类型是____ ,写出两个与CS2具有相同空间构型和键合形式的离子____ 。
(3)石墨烯是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯。
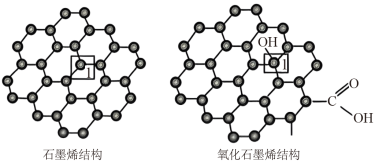
氧化石墨烯中,1号C的杂化方式是____ ,该C与相邻C形成的C-C键角____ (填“>”、“<”或“=”)石墨烯中与1号C相邻C形成的C-C键角。
 +3CH3CH2OH+16H++13H2O
+3CH3CH2OH+16H++13H2O 4[Cr(H2O)6]3++3CH3COOH
4[Cr(H2O)6]3++3CH3COOH①配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是
②CH3COOH中C原子轨道杂化类型为
(2)CS2分子中,C原子的杂化轨道类型是
(3)石墨烯是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯。

氧化石墨烯中,1号C的杂化方式是
您最近一年使用:0次
2019-04-21更新
|
98次组卷
|
2卷引用:吉林省乾安县第七中学2018-2019学年高二下学期第一次质量检测化学试题
16-17高三下·安徽合肥·阶段练习
名校
解题方法
10 . 2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
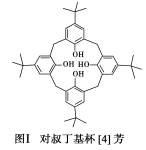
(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB族元素对应离子的萃取,如La3+、Sc2+。写出基态二价钪离子(Sc2+)的核外电子排布式:________ ,其中电子占据的轨道数为________ 个。
(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为________ ,羟基间的相互作用力为________ 。
(3)不同大小的苯芳烃能识别某些离子,如:N 、SCN-等。根据等电子体原理判断N
、SCN-等。根据等电子体原理判断N 的空间构型为
的空间构型为________ ;一定条件下,SCN-与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式______________________________ 。
(4)已知C60分子结构和C60晶胞示意图(如图Ⅱ、图Ⅲ所示):

则一个C60分子中含有σ键的个数为________ ,与每个C60分子距离最近且相等的C60分子有________ 个,C60晶体的密度为________ 。(计算结果保留两位小数)

(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB族元素对应离子的萃取,如La3+、Sc2+。写出基态二价钪离子(Sc2+)的核外电子排布式:
(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为
(3)不同大小的苯芳烃能识别某些离子,如:N
 、SCN-等。根据等电子体原理判断N
、SCN-等。根据等电子体原理判断N 的空间构型为
的空间构型为(4)已知C60分子结构和C60晶胞示意图(如图Ⅱ、图Ⅲ所示):

则一个C60分子中含有σ键的个数为
您最近一年使用:0次



