名校
解题方法
1 . 原子序数小于等于36的Q、W、X、Y、Z五种元素,原子序数逐渐增大,其中Q是原子半径最小的元素,W和Y的基态原子2p能级所含成单电子数均为2,Z的基态原子核外含有13种运动状态不同的电子,回答下列问题(涉及元素时用对应的元素符号表示):
(1)X、Y、Z三种元素的电负性由大到小的顺序是___________ 。
(2)1mol QWX与1mol 所含
所含 键的比值为
键的比值为___________ 。
(3)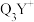 中心原子采用
中心原子采用___________ 杂化,其键角比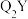 中键角
中键角___________ (填“大”或“小”),原因是:___________ 。
(4)根据VSEPR理论预测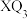 的空间构型为
的空间构型为___________ 。
(5)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为___________ 。
①该化合物的化学式为:___________ 。
②预测该化合物熔点应___________ 金刚石(填“高于”或“低于”),原因是:___________ 。
(1)X、Y、Z三种元素的电负性由大到小的顺序是
(2)1mol QWX与1mol
 所含
所含 键的比值为
键的比值为(3)
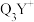 中心原子采用
中心原子采用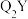 中键角
中键角(4)根据VSEPR理论预测
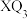 的空间构型为
的空间构型为(5)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为
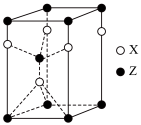
①该化合物的化学式为:
②预测该化合物熔点应
您最近半年使用:0次
名校
解题方法
2 . 二氧化碳作为温室气体,其减排和再利用是世界气候问题的重大课题,而利用二氧化碳催化加氢制甲醇,就是减少温室气体二氧化碳的探索之一、回答下列问题:
(1) 分子中存在
分子中存在___________ 个
 键和
键和___________ 个
 键。
键。
(2)二氧化碳加氢制甲醇的总反应可表示为:
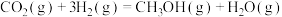 该反应一般认为通过如下步骤来实现:
该反应一般认为通过如下步骤来实现:
①
②
总反应的
___________  。
。
(3)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为
 固溶体。四方
固溶体。四方
 晶胞如图所示。
晶胞如图所示。

 离子在晶胞中的配位数是
离子在晶胞中的配位数是___________ ;在 中掺杂少量
中掺杂少量 后形成的催化剂,化学式可表示为
后形成的催化剂,化学式可表示为 ,则y=
,则y=___________ (用x表达)。
(4)合成总反应在起始物
 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
 ,在
,在
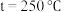 下的
下的
 、在
、在
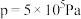 下的
下的
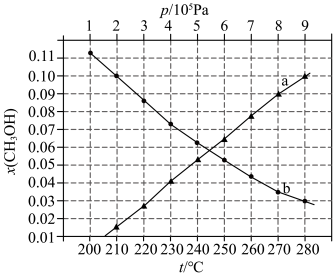
 如图所示。
如图所示。
 ①用各物质的平衡分压表示总反应的平衡常数,表达式
①用各物质的平衡分压表示总反应的平衡常数,表达式
___________ ;
②图中对应等压过程的曲线是___________ ,判断的理由是___________ ;
③当 时,
时, 的平衡转化率
的平衡转化率
___________ 。
(1)
 分子中存在
分子中存在 键和
键和 键。
键。(2)二氧化碳加氢制甲醇的总反应可表示为:
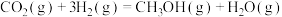 该反应一般认为通过如下步骤来实现:
该反应一般认为通过如下步骤来实现:①

②

总反应的

 。
。(3)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为
 固溶体。四方
固溶体。四方 晶胞如图所示。
晶胞如图所示。
 离子在晶胞中的配位数是
离子在晶胞中的配位数是 中掺杂少量
中掺杂少量 后形成的催化剂,化学式可表示为
后形成的催化剂,化学式可表示为 ,则y=
,则y=(4)合成总反应在起始物
 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在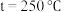 下的
下的 、在
、在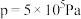 下的
下的 如图所示。
如图所示。 ①用各物质的平衡分压表示总反应的平衡常数,表达式
①用各物质的平衡分压表示总反应的平衡常数,表达式
②图中对应等压过程的曲线是
③当
 时,
时, 的平衡转化率
的平衡转化率
您最近半年使用:0次
名校
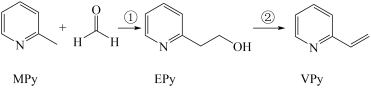
3 . I、吡啶(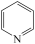 )是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
)是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
请回答下列问题:
(1)MPy分子中碳原子的杂化方式为_______
(2)EPy晶体中微粒间的作用力类型有_______ (填标号)。
a.离子键b.金属键c.极性键d.非极性键e.配位键f.氢键
(3)反应①中每生成1molEPy,断裂_______ 个π键,形成_______ 个σ键。
(4)吡啶、 与
与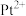 形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。
形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。
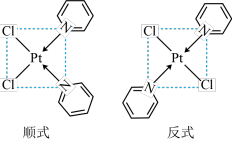
 的配位数为
的配位数为_______ 。顺式二氯二吡啶合铂分子能否溶于水_______ (填“能”或“否”),
Ⅱ、有下列实验:
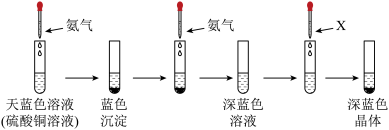
(5)该深蓝色晶体的化学式为_______ ,溶剂X可以是_______ (填名称),继续添加氨水,沉淀溶解,写出沉淀溶解的离子方程式为_______ 。
(6)该实验能说明 、
、 与
与 结合能力的强到弱的顺序是
结合能力的强到弱的顺序是_______ 。
(7)下列有关化学实验“操作→现象→解释”均正确的是_______ 。
 )是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
)是类似于苯的芳香化合物,工业上用作合成药品、消毒剂、染料等的原料。2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如图路线合成。
请回答下列问题:
(1)MPy分子中碳原子的杂化方式为
(2)EPy晶体中微粒间的作用力类型有
a.离子键b.金属键c.极性键d.非极性键e.配位键f.氢键
(3)反应①中每生成1molEPy,断裂
(4)吡啶、
 与
与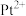 形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。
形成二氯二吡啶合铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。
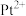 的配位数为
的配位数为Ⅱ、有下列实验:

(5)该深蓝色晶体的化学式为
(6)该实验能说明
 、
、 与
与 结合能力的强到弱的顺序是
结合能力的强到弱的顺序是(7)下列有关化学实验“操作→现象→解释”均正确的是
| 选项 | 操作 | 现象 | 解释 |
| A | 向某溶液中滴加KSCN溶液 | 产生红色沉淀 | 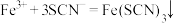 |
| B | 向由0.1molCrCl3·6H2O配成的溶液加入足量AgNO3溶液 | 产生0.2mol沉淀 | 已知 的配位数为6.则CrCl3·6H2O的化学式可表示为 的配位数为6.则CrCl3·6H2O的化学式可表示为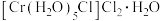 |
| C | 向K2Cr2O7溶液中先滴加3滴浓硫酸,再改加l0滴浓NaOH | 溶液先橙色加深,后变为黄色 | 溶液中存在: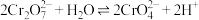 |
| D | 向AgCl悬浊液中滴加氨水 | 沉淀溶解 | AgCl不溶于水,但溶于氨水,重新电离成Ag+和Cl- |
您最近半年使用:0次
名校
解题方法
4 . 已知a、b、c、d、e、f是中学化学中常见的七种元素,其结构或者性质信息如下表所示:
(1)写出元素d基态原子的核外电子排布是_______ 。
(2)写出元素e基态原子的价电子轨道排布式_______ 。
(3)元素a的原子核外共有_______ 种不同运动状态的电子,有_______ 种不同能量的电子。
(4)c、f的气态氢化物的稳定性顺序为_______ (填化学式),请比较a、b、c的电负性大小顺序为_______ (填元素符号)。
(5)用电子式表示ac2的形成过程_______ ,在分子中 键与π键的比值关系
键与π键的比值关系_______ 。
(6)元素f位于周期表中_______ 区。
(7)氢元素与b元素形成的10电子分子的价层电子对数____ ,分子的空间构型为_____ 。
(8)元素e第二电离能为1958kJ/mol,元素d的第二电离能为1753kJ/mol,元素e的第二电离能大于元素d的第二电离能的原因是_______ 。
| 元素 | 结构或者性质信息 |
| a | 原子的L层上s能级电子数等于p能级电子数 |
| b | 非金属元素,其单质为气态,有多种氧化物且都是大气污染物 |
| c | 原子的最外层电子数是内层电子数的3倍 |
| d | 第四周期VIII族中原子序数最大的元素 |
| e | 元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
| f | 单质常温、常压下是易挥发的液体,基态原子的N层上有1个未成对的p电子 |
(2)写出元素e基态原子的价电子轨道排布式
(3)元素a的原子核外共有
(4)c、f的气态氢化物的稳定性顺序为
(5)用电子式表示ac2的形成过程
 键与π键的比值关系
键与π键的比值关系(6)元素f位于周期表中
(7)氢元素与b元素形成的10电子分子的价层电子对数
(8)元素e第二电离能为1958kJ/mol,元素d的第二电离能为1753kJ/mol,元素e的第二电离能大于元素d的第二电离能的原因是
您最近半年使用:0次
名校
5 . I.以下物质中:①HF ②Cl2 ③H2O ④N2 ⑤C2H4
(1)既有极性键又有非极性键的是_______ 。
(2)只含有σ键的是_______ 。
(3)属于极性分子的是_______ 。
(4)属于非极性分子的是_______ 。
II.COCl2分子的结构式为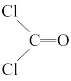
(5)COCl2分子内含有_______(填选项字母)。
III.超氧化钾的晶胞结构如图所示。

(6)则与K+等距离且最近的K+个数为_______ 。
(1)既有极性键又有非极性键的是
(2)只含有σ键的是
(3)属于极性分子的是
(4)属于非极性分子的是
II.COCl2分子的结构式为

(5)COCl2分子内含有_______(填选项字母)。
| A.4个σ键 | B.2个σ键、2个π键 |
| C.2个σ键、1个π键 | D.3个σ键、1个π键 |
III.超氧化钾的晶胞结构如图所示。

(6)则与K+等距离且最近的K+个数为
您最近半年使用:0次
名校
6 . A、B、C、D、E、F是原子序数依次增大的6种短周期元素,A元素原子的2p原子轨道上有2个未成对的电子,B元素在同周期元素中原子半径最大,与A可形成原子个数比为1:1和2:1的两种化合物,C单质是一种常见的半导体材料,F有9个原子轨道,且只有一个未成对电子,没有空轨道。
(1)C元素在元素周期表中的位置_______
(2)EF2中心原子杂化轨道类型为_______ 杂化,VSEPR模型为_______ ,空间结构为_______
(3)P4S3可用于制造火柴,其分子结构如图所示。

①P4S3分子中硫原子的杂化轨道类型为_______ 。
②每个P4S3分子中含孤电子对的数目为_______ 。
③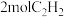 分子中含有
分子中含有_______  键
键
(1)C元素在元素周期表中的位置
(2)EF2中心原子杂化轨道类型为
(3)P4S3可用于制造火柴,其分子结构如图所示。

①P4S3分子中硫原子的杂化轨道类型为
②每个P4S3分子中含孤电子对的数目为
③
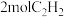 分子中含有
分子中含有 键
键
您最近半年使用:0次
7 . 铜及其合金是人类最早使用的金属材料。
(1)铜原子的价电子排布式是___________ 。
(2)如图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为___________ 。

(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+的结构式是为___________ 。
且[Cu(NH3)4]2+中存在的化学键类型有___________ (填序号)。
A、配位键 B、金属键 C、极性共价键 D、非极性共价键 E、离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___________ 。
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO,在丙烯醇分子中共有___________ σ键和___________ π键。
(1)铜原子的价电子排布式是
(2)如图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为

(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+的结构式是为
且[Cu(NH3)4]2+中存在的化学键类型有
A、配位键 B、金属键 C、极性共价键 D、非极性共价键 E、离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO,在丙烯醇分子中共有
您最近半年使用:0次
名校
解题方法
8 . 硼砂是含结晶水的四硼酸钠。以硼砂为原料,可以得到BF3、BN和硼酸等重要化合物,请根据下列信息回答有关问题:
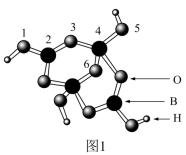
(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图1所示,则在Xm-中,2号硼原子的杂化类型为________ ;4号硼原子参与形成的化学键有________ ;m=________ (填数字)。
(2)BF3和过量NaF作用可生成NaBF4,BF 的价层电子对数为
的价层电子对数为________ ;BF 的立体构型为
的立体构型为____________ 。
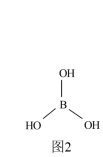
(3)硼酸[B(OH)3]结构如图2所示,分子中一个B原子与3个羟基相连,硼酸为一元弱酸,与过量NaOH反应生成[B(OH)4]-,请用化学键有关知识分析[B(OH)4]-的形成原因:___________________ 。
(4)镧系合金是稀土系储氢合金的典型代表,由荷兰菲利浦实验室首先研制出来。它的最大优点是容易活化。其晶胞结构如图所示,则它的化学式为____________ ,镍的价电子排布式____________ 。

(5)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为________ 。

②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为______ g·cm-3(列出计算式即可)。


(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图1所示,则在Xm-中,2号硼原子的杂化类型为
(2)BF3和过量NaF作用可生成NaBF4,BF
 的价层电子对数为
的价层电子对数为 的立体构型为
的立体构型为(3)硼酸[B(OH)3]结构如图2所示,分子中一个B原子与3个羟基相连,硼酸为一元弱酸,与过量NaOH反应生成[B(OH)4]-,请用化学键有关知识分析[B(OH)4]-的形成原因:
(4)镧系合金是稀土系储氢合金的典型代表,由荷兰菲利浦实验室首先研制出来。它的最大优点是容易活化。其晶胞结构如图所示,则它的化学式为

(5)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为
您最近半年使用:0次
9 . 以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵【(NH4)3Fe(C6H5O7)2】。
(1)Fe基态核外电子排布式为___________ ;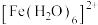 中与Fe2+配位的原子是
中与Fe2+配位的原子是________ (填元素符号)。
(2)NH3分子中氮原子的轨道杂化类型是____________ ;C、N、O元素的第一电离能由大到小的顺序为_______________ 。
(3)与NH 互为等电子体的一种分子为
互为等电子体的一种分子为_______________ (填化学式)。
(4)柠檬酸的结构简式见图。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为_________ mol。

(1)Fe基态核外电子排布式为
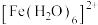 中与Fe2+配位的原子是
中与Fe2+配位的原子是(2)NH3分子中氮原子的轨道杂化类型是
(3)与NH
 互为等电子体的一种分子为
互为等电子体的一种分子为(4)柠檬酸的结构简式见图。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为

您最近半年使用:0次
2020-07-11更新
|
4533次组卷
|
10卷引用:黑龙江省哈尔滨市第六中学2021-2022学年高二下学期期中考试化学试题
黑龙江省哈尔滨市第六中学2021-2022学年高二下学期期中考试化学试题2020年江苏卷化学高考试题(已下线)专题17 物质结构与性质(选修)-2020年高考真题和模拟题化学分项汇编山东省潍坊市临朐县实验中学2021届高三9月月考化学试题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)考向37 分子结构与性质-备战2022年高考化学一轮复习考点微专题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)2020年江苏卷化学高考真题变式题16-21(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)结构与性质
名校
解题方法
10 . 早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)基态Fe原子有______ 个未成对电子,Fe3+的电子排布式为______ 。可用硫氰化钾检验Fe3+,形成的配合物的颜色为______ 。
(2)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。1mol乙醛分子中含有的键的数目为______ 。乙醛中碳原子的杂化轨道类型为______ ,乙酸的沸点明显高于乙醛,其主要原因是______ 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______ 个铜原子。
(3)Al单质为面心立方晶体,其晶胞边长a0.405nm,晶胞中铝原子的配位数为______ 。列式表示Al单质的密度______ gcm-3。(阿伏加 德罗常数用NA表示)
(1)基态Fe原子有
(2)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。1mol乙醛分子中含有的键的数目为
(3)Al单质为面心立方晶体,其晶胞边长a0.405nm,晶胞中铝原子的配位数为
您最近半年使用:0次



