名校
解题方法
1 . 二氧化碳作为温室气体,其减排和再利用是世界气候问题的重大课题,而利用二氧化碳催化加氢制甲醇,就是减少温室气体二氧化碳的探索之一、回答下列问题:
(1) 分子中存在
分子中存在___________ 个
 键和
键和___________ 个
 键。
键。
(2)二氧化碳加氢制甲醇的总反应可表示为:
 该反应一般认为通过如下步骤来实现:
该反应一般认为通过如下步骤来实现:
①
②
总反应的
___________  。
。
(3)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为
 固溶体。四方
固溶体。四方
 晶胞如图所示。
晶胞如图所示。

 离子在晶胞中的配位数是
离子在晶胞中的配位数是___________ ;在 中掺杂少量
中掺杂少量 后形成的催化剂,化学式可表示为
后形成的催化剂,化学式可表示为 ,则y=
,则y=___________ (用x表达)。
(4)合成总反应在起始物
 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
 ,在
,在
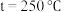 下的
下的
 、在
、在
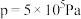 下的
下的
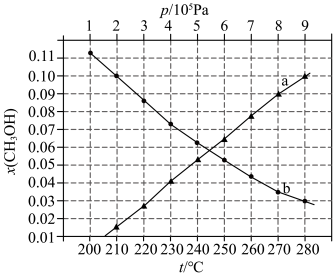
 如图所示。
如图所示。
 ①用各物质的平衡分压表示总反应的平衡常数,表达式
①用各物质的平衡分压表示总反应的平衡常数,表达式
___________ ;
②图中对应等压过程的曲线是___________ ,判断的理由是___________ ;
③当 时,
时, 的平衡转化率
的平衡转化率
___________ 。
(1)
 分子中存在
分子中存在 键和
键和 键。
键。(2)二氧化碳加氢制甲醇的总反应可表示为:
 该反应一般认为通过如下步骤来实现:
该反应一般认为通过如下步骤来实现:①

②

总反应的

 。
。(3)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为
 固溶体。四方
固溶体。四方 晶胞如图所示。
晶胞如图所示。
 离子在晶胞中的配位数是
离子在晶胞中的配位数是 中掺杂少量
中掺杂少量 后形成的催化剂,化学式可表示为
后形成的催化剂,化学式可表示为 ,则y=
,则y=(4)合成总反应在起始物
 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在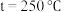 下的
下的 、在
、在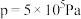 下的
下的 如图所示。
如图所示。 ①用各物质的平衡分压表示总反应的平衡常数,表达式
①用各物质的平衡分压表示总反应的平衡常数,表达式
②图中对应等压过程的曲线是
③当
 时,
时, 的平衡转化率
的平衡转化率
您最近一年使用:0次
名校
解题方法
2 . 已知a、b、c、d、e、f是中学化学中常见的七种元素,其结构或者性质信息如下表所示:
(1)写出元素d基态原子的核外电子排布是_______ 。
(2)写出元素e基态原子的价电子轨道排布式_______ 。
(3)元素a的原子核外共有_______ 种不同运动状态的电子,有_______ 种不同能量的电子。
(4)c、f的气态氢化物的稳定性顺序为_______ (填化学式),请比较a、b、c的电负性大小顺序为_______ (填元素符号)。
(5)用电子式表示ac2的形成过程_______ ,在分子中 键与π键的比值关系
键与π键的比值关系_______ 。
(6)元素f位于周期表中_______ 区。
(7)氢元素与b元素形成的10电子分子的价层电子对数____ ,分子的空间构型为_____ 。
(8)元素e第二电离能为1958kJ/mol,元素d的第二电离能为1753kJ/mol,元素e的第二电离能大于元素d的第二电离能的原因是_______ 。
| 元素 | 结构或者性质信息 |
| a | 原子的L层上s能级电子数等于p能级电子数 |
| b | 非金属元素,其单质为气态,有多种氧化物且都是大气污染物 |
| c | 原子的最外层电子数是内层电子数的3倍 |
| d | 第四周期VIII族中原子序数最大的元素 |
| e | 元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
| f | 单质常温、常压下是易挥发的液体,基态原子的N层上有1个未成对的p电子 |
(2)写出元素e基态原子的价电子轨道排布式
(3)元素a的原子核外共有
(4)c、f的气态氢化物的稳定性顺序为
(5)用电子式表示ac2的形成过程
 键与π键的比值关系
键与π键的比值关系(6)元素f位于周期表中
(7)氢元素与b元素形成的10电子分子的价层电子对数
(8)元素e第二电离能为1958kJ/mol,元素d的第二电离能为1753kJ/mol,元素e的第二电离能大于元素d的第二电离能的原因是
您最近一年使用:0次
名校
解题方法
3 . 硼砂是含结晶水的四硼酸钠。以硼砂为原料,可以得到BF3、BN和硼酸等重要化合物,请根据下列信息回答有关问题:
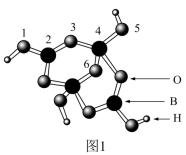
(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图1所示,则在Xm-中,2号硼原子的杂化类型为________ ;4号硼原子参与形成的化学键有________ ;m=________ (填数字)。
(2)BF3和过量NaF作用可生成NaBF4,BF 的价层电子对数为
的价层电子对数为________ ;BF 的立体构型为
的立体构型为____________ 。
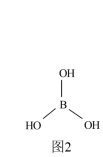
(3)硼酸[B(OH)3]结构如图2所示,分子中一个B原子与3个羟基相连,硼酸为一元弱酸,与过量NaOH反应生成[B(OH)4]-,请用化学键有关知识分析[B(OH)4]-的形成原因:___________________ 。
(4)镧系合金是稀土系储氢合金的典型代表,由荷兰菲利浦实验室首先研制出来。它的最大优点是容易活化。其晶胞结构如图所示,则它的化学式为____________ ,镍的价电子排布式____________ 。

(5)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为________ 。

②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为______ g·cm-3(列出计算式即可)。


(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图1所示,则在Xm-中,2号硼原子的杂化类型为
(2)BF3和过量NaF作用可生成NaBF4,BF
 的价层电子对数为
的价层电子对数为 的立体构型为
的立体构型为(3)硼酸[B(OH)3]结构如图2所示,分子中一个B原子与3个羟基相连,硼酸为一元弱酸,与过量NaOH反应生成[B(OH)4]-,请用化学键有关知识分析[B(OH)4]-的形成原因:
(4)镧系合金是稀土系储氢合金的典型代表,由荷兰菲利浦实验室首先研制出来。它的最大优点是容易活化。其晶胞结构如图所示,则它的化学式为

(5)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为
您最近一年使用:0次
名校
解题方法
4 . Ni元素在生产、生活中有着广泛的应用。 回答下列问题:
(1)基态Ni原子价层电子的排布式为____ 。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行_____ 。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是____ ;(SCN)2分子中,硫原子的杂化方式是____ ,σ键和π键数目之比为_____ 。
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为____ (填标号)。
a.离子键 b.金属键 c.配位键 d.氢键
(5)镍合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。 该合金储氢后,含1molLa的合金可吸附H2的数目为_____ 。
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的___ (填“八面体空隙”或“四面体空隙”)。 若晶体的密度为dg/cm3,Mg2NiH4的摩尔质量为Mg/mol,则Mg2+和Ni原子的最短距离为 ___ nm(用含d、M、NA的代数式表示)。

(1)基态Ni原子价层电子的排布式为
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为
a.离子键 b.金属键 c.配位键 d.氢键
(5)镍合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。 该合金储氢后,含1molLa的合金可吸附H2的数目为
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的

您最近一年使用:0次
2020-04-14更新
|
360次组卷
|
3卷引用:黑龙江省牡丹江市阳明区2022-2023学年高三上学期第四次阶段考试化学试题



