1 . Si、S、Se在自然界中形成多种多样的物质结构。回答下列问题:
(1)Se与O同族,电负性较大的是_____ ;基态Se原子的价电子运动状态有_____ 种。
(2)已知液态的二氧化硫可以发生类似水的自电离: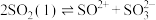 。
。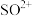 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为__ , 的空间结构为
的空间结构为_______ 。
(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物 和
和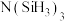 的结构如图所示,
的结构如图所示,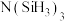 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为_______ ,二者中更易与 形成配位键的是
形成配位键的是_______ 。 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是_______ 。
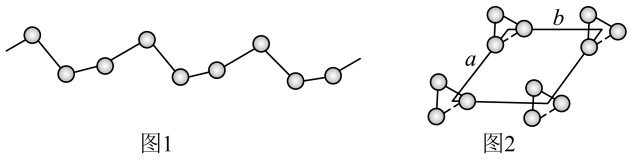
(5) -硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。
-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。 -硒六方晶胞参数为
-硒六方晶胞参数为 、
、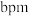 、
、 (其中
(其中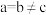 ),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为
),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为 。
。_______ 。晶胞中含有Se原子的数目为_______ ;则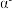 -硒晶胞的摩尔体积为
-硒晶胞的摩尔体积为______  (列出算式)。
(列出算式)。
(1)Se与O同族,电负性较大的是
(2)已知液态的二氧化硫可以发生类似水的自电离:
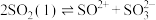 。
。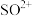 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为 的空间结构为
的空间结构为(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物
 和
和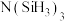 的结构如图所示,
的结构如图所示,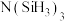 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为 形成配位键的是
形成配位键的是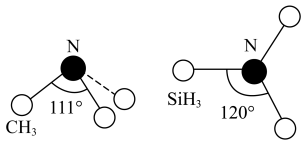
 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是(5)
 -硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。
-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。 -硒六方晶胞参数为
-硒六方晶胞参数为 、
、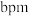 、
、 (其中
(其中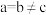 ),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为
),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为 。
。
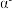 -硒晶胞的摩尔体积为
-硒晶胞的摩尔体积为 (列出算式)。
(列出算式)。
您最近一年使用:0次
2 . 洲际弹道导弹DF—31A的制造材料中包含了Fe、Cr、Ni、C等多种元素。
(1)基态铁原子的价电子排布式为___________ ,Cr的未成对电子个数___________ ,Ni位于周期表的___________ 区。
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8,其结构分别如图1、图2所示,

则Fe(CO)5中σ键与π键的个数比___________ ,图2中C的杂化方式有___________ ,形成上述两种化合物的四种元素中电负性最大的是___________ (填元素符号),写出一种与CO互为等电子体的分子___________ 。
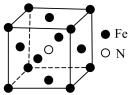
(3)铁与氮形成的化合物的立方晶胞结构如图所示,N位于有Fe构成的___________ 的体心(填“正四面体”或“八面体”或“立方体”),若晶体密度为b ,则顶点Fe与N的距离为
,则顶点Fe与N的距离为__________ pm。(用含NA、b的代数式表示,NA为阿伏加德罗常数的值)
(1)基态铁原子的价电子排布式为
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8,其结构分别如图1、图2所示,

则Fe(CO)5中σ键与π键的个数比
(3)铁与氮形成的化合物的立方晶胞结构如图所示,N位于有Fe构成的
 ,则顶点Fe与N的距离为
,则顶点Fe与N的距离为
您最近一年使用:0次
名校
解题方法
3 . 锗(Ge)、碲化镉(CdTe)等是优良的半导体材料。回答下列问题:
(1)Ge在元素周期表中的位置___________ ,Ge的逐级电离能I4≪I5的原因是___________ 。
(2)经X射线衍射实验证明在碲酸( )分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为
)分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为___________ 。
(3)锗可以形成无机化合物 ,化合物中阴离子的空间构型为
,化合物中阴离子的空间构型为___________ ,锗也可以形成类似于烷烃结构的 (n一般小于5),化合物中Ge的杂化类型为
(n一般小于5),化合物中Ge的杂化类型为___________ , 该分子中含有的
该分子中含有的 键数目为
键数目为___________ 。
(4)锗的氯化物 常温下为无色液体,其沸点高于
常温下为无色液体,其沸点高于 ,原因是
,原因是___________ , 晶体采用ABC式的密堆积方式,则距离一个
晶体采用ABC式的密堆积方式,则距离一个 最近且等距离的
最近且等距离的 有
有___________ 个。
(5)CdTe的晶胞属立方晶系,晶胞如图所示,Te原子填充在Cd原子围成的空隙中该空隙的类型为___________ 空隙(填几何构型名称),若CdTe的摩尔质量为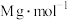 ,该晶体的密度为
,该晶体的密度为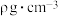 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 ,则最近的两个Te原子的距离
,则最近的两个Te原子的距离___________ nm。(用含M、 、
、 的代数式表示)
的代数式表示)

(1)Ge在元素周期表中的位置
(2)经X射线衍射实验证明在碲酸(
 )分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为
)分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为(3)锗可以形成无机化合物
 ,化合物中阴离子的空间构型为
,化合物中阴离子的空间构型为 (n一般小于5),化合物中Ge的杂化类型为
(n一般小于5),化合物中Ge的杂化类型为 该分子中含有的
该分子中含有的 键数目为
键数目为(4)锗的氯化物
 常温下为无色液体,其沸点高于
常温下为无色液体,其沸点高于 ,原因是
,原因是 晶体采用ABC式的密堆积方式,则距离一个
晶体采用ABC式的密堆积方式,则距离一个 最近且等距离的
最近且等距离的 有
有(5)CdTe的晶胞属立方晶系,晶胞如图所示,Te原子填充在Cd原子围成的空隙中该空隙的类型为
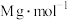 ,该晶体的密度为
,该晶体的密度为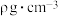 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 ,则最近的两个Te原子的距离
,则最近的两个Te原子的距离 、
、 的代数式表示)
的代数式表示)
您最近一年使用:0次
名校
4 . 二茂铁( )分子式为
)分子式为 ,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
(1) 在周期表中的
在周期表中的___________ 区,受热后 的1个
的1个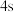 电子会跃迁至
电子会跃迁至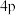 轨道,写出
轨道,写出 的该激发态电子排布式:
的该激发态电子排布式:
___________ 。
(2)铁系元素能与 形成
形成 等金属羰基化合物,已知室温下
等金属羰基化合物,已知室温下 为浅黄色液体,沸点为
为浅黄色液体,沸点为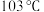 ,则
,则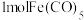 分子中含有
分子中含有___________  键,
键, 中含有的化学键类型包括
中含有的化学键类型包括___________ 。
A.离子键 B.极性共价键 C.配位键 D.金属键
(3)二茂铁的衍生物可和 等微粒产生静电作用,
等微粒产生静电作用, 和
和 的电负性由大到小的顺序为
的电负性由大到小的顺序为___________ ; 中氧原子的杂化方式为
中氧原子的杂化方式为___________ , 空间构型为
空间构型为___________ 。
(4)石墨烯的结构如图甲所示,二维结构内有大量碳六元环相连,每个碳六元环类似于苯环(但无H原子相连),石墨烯的某种氧化物的结构如图乙所示,该物质易溶于水,而石墨烯难溶于水,易溶于非极性溶剂。解释石墨烯及其氧化物的溶解性差异的原因:___________ 。

(5)石墨烷是石墨烯与 发生加成反应的产物,完全氢化的石墨烷具有
发生加成反应的产物,完全氢化的石墨烷具有___________ (填“导电性”“绝缘性”或“半导体性”)。
(6)石墨烯可作电池材料。某锂离子电池的负极材料是将 嵌入到两层石墨烯层中间,石墨烯层间距为
嵌入到两层石墨烯层中间,石墨烯层间距为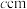 ,其晶胞结构如图所示。其中一个晶胞的质量m=
,其晶胞结构如图所示。其中一个晶胞的质量m=___________ g(用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
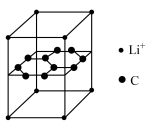
 )分子式为
)分子式为 ,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。
,是具有导电性的有机配合物,其衍生物一直是科学研究的前沿。(1)
 在周期表中的
在周期表中的 的1个
的1个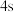 电子会跃迁至
电子会跃迁至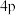 轨道,写出
轨道,写出 的该激发态电子排布式:
的该激发态电子排布式:
(2)铁系元素能与
 形成
形成 等金属羰基化合物,已知室温下
等金属羰基化合物,已知室温下 为浅黄色液体,沸点为
为浅黄色液体,沸点为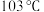 ,则
,则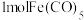 分子中含有
分子中含有 键,
键, 中含有的化学键类型包括
中含有的化学键类型包括A.离子键 B.极性共价键 C.配位键 D.金属键
(3)二茂铁的衍生物可和
 等微粒产生静电作用,
等微粒产生静电作用, 和
和 的电负性由大到小的顺序为
的电负性由大到小的顺序为 中氧原子的杂化方式为
中氧原子的杂化方式为 空间构型为
空间构型为(4)石墨烯的结构如图甲所示,二维结构内有大量碳六元环相连,每个碳六元环类似于苯环(但无H原子相连),石墨烯的某种氧化物的结构如图乙所示,该物质易溶于水,而石墨烯难溶于水,易溶于非极性溶剂。解释石墨烯及其氧化物的溶解性差异的原因:

(5)石墨烷是石墨烯与
 发生加成反应的产物,完全氢化的石墨烷具有
发生加成反应的产物,完全氢化的石墨烷具有(6)石墨烯可作电池材料。某锂离子电池的负极材料是将
 嵌入到两层石墨烯层中间,石墨烯层间距为
嵌入到两层石墨烯层中间,石墨烯层间距为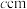 ,其晶胞结构如图所示。其中一个晶胞的质量m=
,其晶胞结构如图所示。其中一个晶胞的质量m= 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
解题方法
5 . 2020年12月17日,我国的嫦娥五号返回器携带月球样品,在内蒙古预定区域安全着陆。经科学家分析,发现月球土壤中富含有He、O、Si、 Fe、 Mg、Ca、Mn、Ti、Al、Au、Ag、 Pb、 Zn、 Cu等元素。
(1)使用3He的热核反应堆没有中子产生,故使用3He作为能源时,不会产生辐射。写出He的电子排布图_______ 。
(2)溶液中Fe3+比Fe2+更稳定的原因是_______ 。
(3)金属Ca和Mn属于同一周期,且核外最外层电子构型相同,但金属Ca的熔点沸点等都比金属Mn低,其原因是_______ 。
(4)向Cu(OH)2悬浊液中通入NH3,蓝色沉淀溶解,溶液变为深蓝色,发生了如下反应:Cu(OH)2 + 4NH3 = [Cu(NH3)4]2+ + 2OH—,NH3分子中N的杂化类型为_______ , 比较NH3和[Cu(NH3)4]2+中H—N—H 键角的大小: NH3_______ [Cu(NH3)4]2+ (填“>”或“<”),1mol [Cu(NH3)4]2+中σ键的数目为_______ NA。
(5)CaTiO3的晶胞如图所示,Ti4+的配位数是_______ ,若Ca2+位于晶胞顶点,则O2-位于_______ 位置,若晶胞参数为anm,则晶体密度为_______ g·cm-3 (列出计算式,阿伏加德罗常数用NA表示)。

(1)使用3He的热核反应堆没有中子产生,故使用3He作为能源时,不会产生辐射。写出He的电子排布图
(2)溶液中Fe3+比Fe2+更稳定的原因是
(3)金属Ca和Mn属于同一周期,且核外最外层电子构型相同,但金属Ca的熔点沸点等都比金属Mn低,其原因是
(4)向Cu(OH)2悬浊液中通入NH3,蓝色沉淀溶解,溶液变为深蓝色,发生了如下反应:Cu(OH)2 + 4NH3 = [Cu(NH3)4]2+ + 2OH—,NH3分子中N的杂化类型为
(5)CaTiO3的晶胞如图所示,Ti4+的配位数是

您最近一年使用:0次
名校
解题方法
6 . 明朝《天工开物》中有世界上最早的“火法”炼锌技术的记载。锌及其化合物在生产、生活中有着重要的用途。锌是生命体必需的微量元素,被称为“生命之花”。
(1)基态Zn原子核外电子共有____ 种空间运动状态。
(2)锌与铜在周期表中的位置相邻。现有4种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10失去1个电子需要的能量由大到小排序是____ (填字母)。
(3)锌在潮湿的空气中极易生成一层紧密的碱式碳酸锌[ZnCO3·3Zn(OH)2]薄膜,使其具有抗腐蚀性。其中CO 的空间构型为
的空间构型为____ (用文字描述)。与CO 互为等电子体的分子是
互为等电子体的分子是____ (写一种即可)。
(4)葡萄糖酸锌为有机锌补剂,对胃黏膜刺激小,在人体中吸收率高。如图是葡萄糖酸锌的结构简式。

①葡萄糖酸锌组成元素中电负性最大的元素为____ ,其中C原子的杂化方式为____ 。
②1mol葡萄糖酸分子中含有____ molσ键。葡萄糖酸的熔点小于葡萄糖酸锌的熔点原因是____ 。
(5)ZnS是一种性能优异的荧光材料,在自然界中有立方ZnS和六方ZnS两种晶型,其晶胞结构如图所示:

①立方ZnS中,Zn2+填充在S2—形成的____ 空隙中;
②六方ZnS的晶体密度为____ g·cm-3(设NA为阿伏加德罗常数的值)。
(1)基态Zn原子核外电子共有
(2)锌与铜在周期表中的位置相邻。现有4种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10失去1个电子需要的能量由大到小排序是
| A.④②①③ | B.④②③① | C.①②④③ | D.①④③② |
 的空间构型为
的空间构型为 互为等电子体的分子是
互为等电子体的分子是(4)葡萄糖酸锌为有机锌补剂,对胃黏膜刺激小,在人体中吸收率高。如图是葡萄糖酸锌的结构简式。

①葡萄糖酸锌组成元素中电负性最大的元素为
②1mol葡萄糖酸分子中含有
(5)ZnS是一种性能优异的荧光材料,在自然界中有立方ZnS和六方ZnS两种晶型,其晶胞结构如图所示:

①立方ZnS中,Zn2+填充在S2—形成的
②六方ZnS的晶体密度为
您最近一年使用:0次
2022-05-24更新
|
546次组卷
|
2卷引用:四川省宜宾市叙州区第一中学校2024届高三上学期一诊模拟考试理综化学试题
名校
7 . 中科院大连物化所成功利用具有尖晶石结构的Co3O4电催化剂电解水。
(1)Co在周期表中的位置是____ ,基态Co的电子占据的最高能层符号为____ 。
(2)钴盐引发动物中毒时,通常可以用EDTA(结构如图)解毒。其中,N的杂化方式均为____ ,N的I1(第一电离能)大于O的I1,其原因是____ ;自由基是指含单电子的基团,1mol—COOH(羧基自由基)中存在____ molσ键和____ molπ键。

(3)EDTA可以由乙二胺与甲醛、氰化钠间接得到。离子化合物氰化钠的晶体类型为____ ,甲醛分子的空间构型为____ 。
(4)Co3O4晶体中O作面心立方最密堆积(如图),Co随机填充在晶胞中O构成的8个四面体空隙和4个八面体空隙中,则Co的配位数分别为____ ,Co总的空隙填充率为____ ,如果晶胞边长为anm,Co3O4的摩尔质量为Mg/mol,NA为阿伏加德罗常数的值,则Co3O4的晶体密度为____ g/cm3(列出计算式)。

(1)Co在周期表中的位置是
(2)钴盐引发动物中毒时,通常可以用EDTA(结构如图)解毒。其中,N的杂化方式均为

(3)EDTA可以由乙二胺与甲醛、氰化钠间接得到。离子化合物氰化钠的晶体类型为
(4)Co3O4晶体中O作面心立方最密堆积(如图),Co随机填充在晶胞中O构成的8个四面体空隙和4个八面体空隙中,则Co的配位数分别为

您最近一年使用:0次
2022-03-26更新
|
383次组卷
|
3卷引用:四川省遂宁市2022届高三第二次诊断性考试(二模)理综化学试题
解题方法
8 . 哈萨克斯坦是“丝绸之路”的一个重要节点,其境内有丰富的铬、镍、钼矿。设NA表示阿伏加德罗常数,回答下列问题:
(1)基态Cr原子的价电子排布图为_______ 。
(2)Cr的一种配合物结构如图1所示。

①阴离子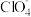 的空间构型为
的空间构型为_______ ,写出一种与之互为等电子体的离子_______ 。
②标注“1”、“2”的碳原子的杂化类型分别为_______ 、_______ 。
③基态氮原子的第一电离能大于基态氧原子,其原因是_______ 。
(3)1 mol[Ni(NH3)4]2+中含有的σ键数目为_______ 。
(4)已知:钼的晶胞如图2所示。

①下列晶体的原子堆积方式与钼晶体的相同的是_______ (填字母)。
A.Cu B.K C.金刚石D.氯化钠
②已知钼晶体的密度是ρg·cm-3,Mo的摩尔质量是Mg·mol-1,晶体中距离最近的Mo原子核之间的距离为_______ pm。
(1)基态Cr原子的价电子排布图为
(2)Cr的一种配合物结构如图1所示。

①阴离子
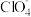 的空间构型为
的空间构型为②标注“1”、“2”的碳原子的杂化类型分别为
③基态氮原子的第一电离能大于基态氧原子,其原因是
(3)1 mol[Ni(NH3)4]2+中含有的σ键数目为
(4)已知:钼的晶胞如图2所示。

①下列晶体的原子堆积方式与钼晶体的相同的是
A.Cu B.K C.金刚石D.氯化钠
②已知钼晶体的密度是ρg·cm-3,Mo的摩尔质量是Mg·mol-1,晶体中距离最近的Mo原子核之间的距离为
您最近一年使用:0次
解题方法
9 . 贝壳、珍珠、方解石等主要成分均含有CaCO3,回答下列问题:
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧碳酸钙时的焰色为_______ (填标号)。
A 黄色 B 红色 C 紫色 D 绿色
(2)CaCO3中三种元素第一电离能由小到大的顺序是__________ 。CaCO3中的化学键除了σ键外,还存在_________________ 。
(3)关于CO2和CO32-的下列说法正确的是__________ 。
a 两种微粒价层电子对数相同 b 两种微粒的中心原子均无孤电子对
c 键角:CO2>CO32- d 两种微粒的中心原子杂化方式相同
(4)难溶碳酸盐易分解,CaCO3、BaCO3热分解温度更高的是_____ ,原因是______ 。
(5)方解石的菱面体结构如图1,沿三次轴的俯视图为正六边形。方解石的六方晶胞结构如图2,晶胞底面为平行四边形,其较小夹角为60°,边长为a nm,晶胞高为c nm。

A点在俯视图中为a,则B点在俯视图中的位置为_________ (填字母)。方解石的六方晶胞中,Ca2+和CO32-个数比为___________ ;若阿伏加 德罗常数为NA,则该方解石的密度为________ g/cm3(列出计算式)。
(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧碳酸钙时的焰色为
A 黄色 B 红色 C 紫色 D 绿色
(2)CaCO3中三种元素第一电离能由小到大的顺序是
(3)关于CO2和CO32-的下列说法正确的是
a 两种微粒价层电子对数相同 b 两种微粒的中心原子均无孤电子对
c 键角:CO2>CO32- d 两种微粒的中心原子杂化方式相同
(4)难溶碳酸盐易分解,CaCO3、BaCO3热分解温度更高的是
(5)方解石的菱面体结构如图1,沿三次轴的俯视图为正六边形。方解石的六方晶胞结构如图2,晶胞底面为平行四边形,其较小夹角为60°,边长为a nm,晶胞高为c nm。

A点在俯视图中为a,则B点在俯视图中的位置为
您最近一年使用:0次
名校
解题方法
10 . Ni元素在生产、生活中有着广泛的应用。 回答下列问题:
(1)基态Ni原子价层电子的排布式为____ 。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行_____ 。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是____ ;(SCN)2分子中,硫原子的杂化方式是____ ,σ键和π键数目之比为_____ 。
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为____ (填标号)。
a.离子键 b.金属键 c.配位键 d.氢键
(5)镍合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。 该合金储氢后,含1molLa的合金可吸附H2的数目为_____ 。
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的___ (填“八面体空隙”或“四面体空隙”)。 若晶体的密度为dg/cm3,Mg2NiH4的摩尔质量为Mg/mol,则Mg2+和Ni原子的最短距离为 ___ nm(用含d、M、NA的代数式表示)。

(1)基态Ni原子价层电子的排布式为
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为
a.离子键 b.金属键 c.配位键 d.氢键
(5)镍合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。 该合金储氢后,含1molLa的合金可吸附H2的数目为
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的

您最近一年使用:0次
2020-04-14更新
|
360次组卷
|
3卷引用:四川省德阳市2020届高三“二诊”考试(全国III)理综化学试题



