二氧化碳作为温室气体,其减排和再利用是世界气候问题的重大课题,而利用二氧化碳催化加氢制甲醇,就是减少温室气体二氧化碳的探索之一、回答下列问题:
(1) 分子中存在
分子中存在___________ 个
 键和
键和___________ 个
 键。
键。
(2)二氧化碳加氢制甲醇的总反应可表示为:
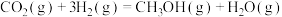 该反应一般认为通过如下步骤来实现:
该反应一般认为通过如下步骤来实现:
①
②
总反应的
___________  。
。
(3)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为
 固溶体。四方
固溶体。四方
 晶胞如图所示。
晶胞如图所示。

 离子在晶胞中的配位数是
离子在晶胞中的配位数是___________ ;在 中掺杂少量
中掺杂少量 后形成的催化剂,化学式可表示为
后形成的催化剂,化学式可表示为 ,则y=
,则y=___________ (用x表达)。
(4)合成总反应在起始物
 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
 ,在
,在
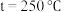 下的
下的
 、在
、在
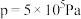 下的
下的
 如图所示。
如图所示。
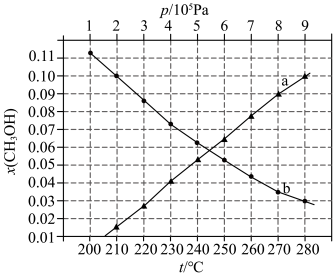 ①用各物质的平衡分压表示总反应的平衡常数,表达式
①用各物质的平衡分压表示总反应的平衡常数,表达式
___________ ;
②图中对应等压过程的曲线是___________ ,判断的理由是___________ ;
③当 时,
时, 的平衡转化率
的平衡转化率
___________ 。
(1)
 分子中存在
分子中存在 键和
键和 键。
键。(2)二氧化碳加氢制甲醇的总反应可表示为:
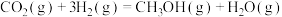 该反应一般认为通过如下步骤来实现:
该反应一般认为通过如下步骤来实现:①

②

总反应的

 。
。(3)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为
 固溶体。四方
固溶体。四方 晶胞如图所示。
晶胞如图所示。
 离子在晶胞中的配位数是
离子在晶胞中的配位数是 中掺杂少量
中掺杂少量 后形成的催化剂,化学式可表示为
后形成的催化剂,化学式可表示为 ,则y=
,则y=(4)合成总反应在起始物
 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在
,在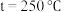 下的
下的 、在
、在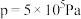 下的
下的 如图所示。
如图所示。 ①用各物质的平衡分压表示总反应的平衡常数,表达式
①用各物质的平衡分压表示总反应的平衡常数,表达式
②图中对应等压过程的曲线是
③当
 时,
时, 的平衡转化率
的平衡转化率
更新时间:2023-09-24 20:06:54
|
相似题推荐
【推荐1】SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和液态H2O。
已知:CH4(g) +2SO2(g)=CO2(g) +2S(s) +2H2O(l) ΔH= -295.9 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH= -297.2 kJ·mol-1
则CH4的燃烧热ΔH=_______ 。
(2)在恒容密闭容器中,用H2还原SO2生成S的反应分两步完成(如图1所示) ,该过程中部分物质的物质的量浓度随时间的变化关系如图2所示:

①由分析可知X为_______ (填化学式)。
②0~t1时间段的温度为_______ 。
(3)燃煤烟气中可通过反应SO2(g)+2CO(g) 2CO2(g)+S(l)实现硫的回收。将1molSO2和2molCO通入1L恒容密闭容器中,在恒温T℃,起始压强为2.5×106Pa条件下反应,5min时,反应达到平衡,气体密度减小16g·L-1。
2CO2(g)+S(l)实现硫的回收。将1molSO2和2molCO通入1L恒容密闭容器中,在恒温T℃,起始压强为2.5×106Pa条件下反应,5min时,反应达到平衡,气体密度减小16g·L-1。
①0~5min内,CO的反应速率是_______ ;若升高温度,气体的密度增加(S仍为液体),则该反应的ΔH_______ (填“>”或“<”)0。
②T℃时,平衡常数Kp=_______ Pa-1。
(4)单质硫也可以生成多硫化物从而实现能量间的转化。
①钠硫电池是一种新型高能电池,总反应为2Na+2S Na2S2,该电池工作时正极的电极反应式为
Na2S2,该电池工作时正极的电极反应式为_______ ;给该电池充电时,钠电极应与外电源的_______ (填“正”或“负”)极相连接。
②在碱性溶液中,S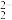 被BrO
被BrO 氧化成SO
氧化成SO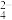 ,BrO
,BrO 被还原成Br-。该反应的离子方程式是
被还原成Br-。该反应的离子方程式是_______ 。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和液态H2O。
已知:CH4(g) +2SO2(g)=CO2(g) +2S(s) +2H2O(l) ΔH= -295.9 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH= -297.2 kJ·mol-1
则CH4的燃烧热ΔH=
(2)在恒容密闭容器中,用H2还原SO2生成S的反应分两步完成(如图1所示) ,该过程中部分物质的物质的量浓度随时间的变化关系如图2所示:

①由分析可知X为
②0~t1时间段的温度为
(3)燃煤烟气中可通过反应SO2(g)+2CO(g)
 2CO2(g)+S(l)实现硫的回收。将1molSO2和2molCO通入1L恒容密闭容器中,在恒温T℃,起始压强为2.5×106Pa条件下反应,5min时,反应达到平衡,气体密度减小16g·L-1。
2CO2(g)+S(l)实现硫的回收。将1molSO2和2molCO通入1L恒容密闭容器中,在恒温T℃,起始压强为2.5×106Pa条件下反应,5min时,反应达到平衡,气体密度减小16g·L-1。①0~5min内,CO的反应速率是
②T℃时,平衡常数Kp=
(4)单质硫也可以生成多硫化物从而实现能量间的转化。
①钠硫电池是一种新型高能电池,总反应为2Na+2S
 Na2S2,该电池工作时正极的电极反应式为
Na2S2,该电池工作时正极的电极反应式为②在碱性溶液中,S
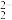 被BrO
被BrO 氧化成SO
氧化成SO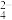 ,BrO
,BrO 被还原成Br-。该反应的离子方程式是
被还原成Br-。该反应的离子方程式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】I、在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量 N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
(1)写出该反应的热化学方程式_______________________________________ .
(2)已知H2O(l)═H2O(g);△H=+44kJ·mol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是________ kJ.
(3)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣a kJ·mol﹣1
途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol﹣1
2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=﹣c kJ·mol﹣1
2H2(g)+O2(g)═2H2O(l)△H=﹣d kJ·mol﹣1(abcd均为正值)
请回答下列问题:
①判断等量的丙烷通过两种途径放出的热量,途径I放出的热量_______ (填“大于”、“等于”或“小于”)途径II放出的热量.
②在C3H8(g)═C3H6(g)+H2(g) 的反应中,反应物具有的总能量________ (填“大于”、“等于”或“小于”)生成物具有的总能量.
③b 与a、c、d的数学关系式是_____________ .
II、利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.50 mol·L−1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L−1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?__________________________ 。
(2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm−3,又知中和反应后生成溶液的比热容c=4.18 J·g−1·℃−1。为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热ΔH=________ kJ·mol−1_(结果保留一位小数)。
(3)不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_________________ 。
 N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.(1)写出该反应的热化学方程式
(2)已知H2O(l)═H2O(g);△H=+44kJ·mol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是
(3)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣a kJ·mol﹣1
途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol﹣1
2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=﹣c kJ·mol﹣1
2H2(g)+O2(g)═2H2O(l)△H=﹣d kJ·mol﹣1(abcd均为正值)
请回答下列问题:
①判断等量的丙烷通过两种途径放出的热量,途径I放出的热量
②在C3H8(g)═C3H6(g)+H2(g) 的反应中,反应物具有的总能量
③b 与a、c、d的数学关系式是
II、利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.50 mol·L−1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L−1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?
(2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm−3,又知中和反应后生成溶液的比热容c=4.18 J·g−1·℃−1。为了计算中和热,某学生实验记录数据如下:
| 实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | ||
| 1 | 20.0 | 20.0 | 23.0 |
| 2 | 20.1 | 20.1 | 23.2 |
| 3 | 20.2 | 20.2 | 23.4 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=
(3)不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是
您最近一年使用:0次
【推荐3】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g) CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
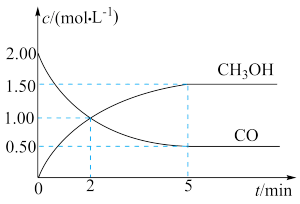
①从反应开始到5min,用一氧化碳表示的平均反应速率v(CO)=____________ 。
②下列说法正确的是____________ (填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)=v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
计算反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g)的△H=
CaCO3(s)+2H2(g)的△H=__________ kJ/mol;
若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,该平衡常数K=__________ (用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________ 。(填字母)
A.降低体系的温度 B.压缩容器的体积
C.增加CaO的量 D.选用适当的催化剂
 CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到5min,用一氧化碳表示的平均反应速率v(CO)=
②下列说法正确的是
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)=v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
计算反应C(s)+2H2O(g)+CaO(s)
 CaCO3(s)+2H2(g)的△H=
CaCO3(s)+2H2(g)的△H=若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,该平衡常数K=
②对于可逆反应C(s)+2H2O(g)+CaO(s)
 CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是A.降低体系的温度 B.压缩容器的体积
C.增加CaO的量 D.选用适当的催化剂
您最近一年使用:0次
【推荐1】I.下列为二氧化硫和氮的氧化物转化的部分环节:
已知:2SO2(g)+O2(g)⇌2SO3(g) ∆H=-196.6 kJ/mol
2NO(g)+O2(g)⇌2NO2(g) ∆H=-113.0 kJ/mol
则SO2气体与NO2气体反应生成SO3气体和NO气体的热化学方程式为_________ 。
II.研究已知合成氨反应:N2(g)+3H2(g) 2NH3(g) ∆H=-92.2 kJ/mol。
2NH3(g) ∆H=-92.2 kJ/mol。
(1)该反应的化学平衡常数K与温度T的关系如下表所示:
其中,K1___ K2(填“>”、“=”或“<”).
(2)合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是______ (填字母).
A.采用较高温度(400℃~500℃) B.采用较高压强(20MPa~50MPa)
C.用铁触媒加快化学反应速率 D.将生成的氨液化并及时从体系中分离出来
III.工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l) ∆H<0。
(1)将2 mol NH3和1 mol CO2投到一温度恒定、体积恒定的容器中进行反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是____ 。(填字母)
a.2v正(NH3)=v逆(CO2)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO2、NH3的体积分数均不再变化
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) =x,如图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是
=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是_______ 。图中的B点处,NH3的平衡转化率为____ 。

已知:2SO2(g)+O2(g)⇌2SO3(g) ∆H=-196.6 kJ/mol
2NO(g)+O2(g)⇌2NO2(g) ∆H=-113.0 kJ/mol
则SO2气体与NO2气体反应生成SO3气体和NO气体的热化学方程式为
II.研究已知合成氨反应:N2(g)+3H2(g)
 2NH3(g) ∆H=-92.2 kJ/mol。
2NH3(g) ∆H=-92.2 kJ/mol。(1)该反应的化学平衡常数K与温度T的关系如下表所示:
| T/K | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
其中,K1
(2)合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是
A.采用较高温度(400℃~500℃) B.采用较高压强(20MPa~50MPa)
C.用铁触媒加快化学反应速率 D.将生成的氨液化并及时从体系中分离出来
III.工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l) ∆H<0。
(1)将2 mol NH3和1 mol CO2投到一温度恒定、体积恒定的容器中进行反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是
a.2v正(NH3)=v逆(CO2)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO2、NH3的体积分数均不再变化
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
 =x,如图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是
=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO+H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+ H2O(g)═CO(g)+3H2(g) ΔH。
已知:①CH4、H2、CO的燃烧热分别为a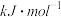 、b
、b 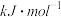 、c
、c 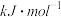 (a、b、c均大于0);
(a、b、c均大于0);
②水的汽化热为+d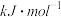 (d >0)。则ΔH=
(d >0)。则ΔH=__________ 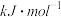 (用含a、b、c、d的代数式表示)。
(用含a、b、c、d的代数式表示)。
(2)用合成气制甲醇的反应为2H2(g)+CO(g) CH3OH(g) ΔH,在10 L的恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示。
CH3OH(g) ΔH,在10 L的恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示。

①ΔH________ (填“>”“<”或“=”)0。
②写出两条可同时提高反应速率和CO的转化率的措施:_______ 、_____ 。
③下列说法正确的是___________ (填序号)。
A.温度越高,该反应的平衡常数越大
B.达平衡后再充入稀有气体,CO的转化率提高
C.体系内气体压强不再变化时,反应达到平衡状态
D.图中压强p1<p2
④200 ℃时,n(H2)随时间的变化如表所示,3 min时反应刚好达到平衡状态,请利用表中的数据计算0~3 min内v(CH3OH)=_______ 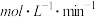 。
。
⑤200℃时该反应的平衡常数K=____________ 。向上述200 ℃的平衡体系中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则平衡_______ (填“正向移动”“逆向移动”或“不移动”)。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷时,测得电路中转移1.96 mol电子,则甲烷的利用率为________ 。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO+H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+ H2O(g)═CO(g)+3H2(g) ΔH。
已知:①CH4、H2、CO的燃烧热分别为a
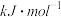 、b
、b 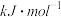 、c
、c 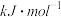 (a、b、c均大于0);
(a、b、c均大于0);②水的汽化热为+d
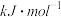 (d >0)。则ΔH=
(d >0)。则ΔH=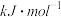 (用含a、b、c、d的代数式表示)。
(用含a、b、c、d的代数式表示)。(2)用合成气制甲醇的反应为2H2(g)+CO(g)
 CH3OH(g) ΔH,在10 L的恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示。
CH3OH(g) ΔH,在10 L的恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示。
①ΔH
②写出两条可同时提高反应速率和CO的转化率的措施:
③下列说法正确的是
A.温度越高,该反应的平衡常数越大
B.达平衡后再充入稀有气体,CO的转化率提高
C.体系内气体压强不再变化时,反应达到平衡状态
D.图中压强p1<p2
④200 ℃时,n(H2)随时间的变化如表所示,3 min时反应刚好达到平衡状态,请利用表中的数据计算0~3 min内v(CH3OH)=
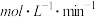 。
。| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷时,测得电路中转移1.96 mol电子,则甲烷的利用率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】 是主要的温室气体,以
是主要的温室气体,以 和
和 为原料制造更高价值的化学产品是用来缓解温室效应的研究方向。请回答下列问题:
为原料制造更高价值的化学产品是用来缓解温室效应的研究方向。请回答下列问题:
(1)工业上常用 和
和 为原料合成甲醇(
为原料合成甲醇( ),过程中发生如下两个反应:
),过程中发生如下两个反应:
反应Ⅰ:

反应Ⅱ:

①已知:键能指断开1 mol 气态键所吸收的能量或形成1 mol 气态键所释放的能量。
几种化学键的键能如下表所示:
则x=_______  (写出计算表达式);
(写出计算表达式);
②若反应Ⅱ逆反应活化能 (逆)为
(逆)为 ,则该反应的
,则该反应的 (正)活化能为
(正)活化能为_______  。
。
(2)向2 L容器中充入1 mol 和2 mol
和2 mol ,若只发生反应Ⅰ,测得反应在不同压强、不同温度下,平衡混合物中
,若只发生反应Ⅰ,测得反应在不同压强、不同温度下,平衡混合物中 体积分数如图Ⅰ所示,测得反应时逆反应速率与容器中
体积分数如图Ⅰ所示,测得反应时逆反应速率与容器中 关系如图Ⅱ所示:
关系如图Ⅱ所示:
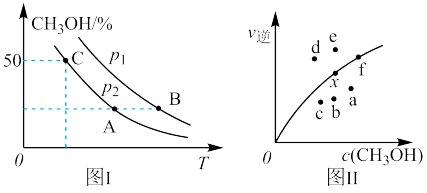
①图Ⅰ中A、B、C三点对应的平衡常数 、
、 、
、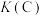 由大到小的顺序排列为
由大到小的顺序排列为_______ ,图Ⅰ中C点 的转化率为
的转化率为_______ 。
②图Ⅱ中当x点平衡体系升高至某一温度时,反应可重新达平衡状态,新平衡点可能是_______ 。
(3)若反应Ⅲ: 的正、逆反应速率分别可表示为
的正、逆反应速率分别可表示为 、
、 ,
, 、
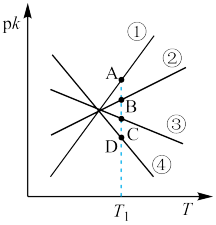
、 分别为正、逆反应速率常数,c为物质的量浓度。则下图(
分别为正、逆反应速率常数,c为物质的量浓度。则下图( ;T表示温度)所示①、②、③、④四条斜线中,能表示以
;T表示温度)所示①、②、③、④四条斜线中,能表示以 随T变化关系的是斜线
随T变化关系的是斜线_______ ,图中A、B、C、D点的纵坐标分别为a+3、a+1、a-1、a-3,则温度 时化学平衡常数
时化学平衡常数
_______ 。
 是主要的温室气体,以
是主要的温室气体,以 和
和 为原料制造更高价值的化学产品是用来缓解温室效应的研究方向。请回答下列问题:
为原料制造更高价值的化学产品是用来缓解温室效应的研究方向。请回答下列问题:(1)工业上常用
 和
和 为原料合成甲醇(
为原料合成甲醇( ),过程中发生如下两个反应:
),过程中发生如下两个反应:反应Ⅰ:


反应Ⅱ:


①已知:键能指断开1 mol 气态键所吸收的能量或形成1 mol 气态键所释放的能量。
几种化学键的键能如下表所示:
| 化学键 |  |  |  ( ( 中) 中) |  ( ( 中) 中) |  |  |
键能 | a | b | c | d | e | x |
则x=
 (写出计算表达式);
(写出计算表达式);②若反应Ⅱ逆反应活化能
 (逆)为
(逆)为 ,则该反应的
,则该反应的 (正)活化能为
(正)活化能为 。
。(2)向2 L容器中充入1 mol
 和2 mol
和2 mol ,若只发生反应Ⅰ,测得反应在不同压强、不同温度下,平衡混合物中
,若只发生反应Ⅰ,测得反应在不同压强、不同温度下,平衡混合物中 体积分数如图Ⅰ所示,测得反应时逆反应速率与容器中
体积分数如图Ⅰ所示,测得反应时逆反应速率与容器中 关系如图Ⅱ所示:
关系如图Ⅱ所示:
①图Ⅰ中A、B、C三点对应的平衡常数
 、
、 、
、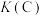 由大到小的顺序排列为
由大到小的顺序排列为 的转化率为
的转化率为②图Ⅱ中当x点平衡体系升高至某一温度时,反应可重新达平衡状态,新平衡点可能是
(3)若反应Ⅲ:
 的正、逆反应速率分别可表示为
的正、逆反应速率分别可表示为 、
、 ,
, 、
、 分别为正、逆反应速率常数,c为物质的量浓度。则下图(
分别为正、逆反应速率常数,c为物质的量浓度。则下图(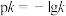 ;T表示温度)所示①、②、③、④四条斜线中,能表示以
;T表示温度)所示①、②、③、④四条斜线中,能表示以 随T变化关系的是斜线
随T变化关系的是斜线 时化学平衡常数
时化学平衡常数

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】碳元素形成的单质和化合物在化工、材料、医学等领域应用广泛,回答下列问题:
(1)区分金刚石和无定形碳最可靠的科学方法为___________ 。基态C原子核外未成对电子的数目为_____________ 。
(2)咖啡因结构为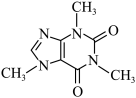 。
。
①咖啡因中C原子的杂化形式为_________________ 。
②1 mol咖啡因中所含 键数目为
键数目为_________________ 。
③咖啡因通常在水中的溶解度较小,加入适量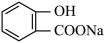 能增大其在水中溶解度的原因为
能增大其在水中溶解度的原因为_________________ 。
④CH3+(甲基正离子)的立体构型为_________________ 。
(3)CO、NO、H2S均为生命体系气体信号分子。其中H、C、O、S的电负性由大到小的顺序为____________ ;N、O、S的第一电离能由大到小的顺序为________________ 。
(4)干冰可用于人工降雨。其熔点低于金刚石的原因为___________ ;若干冰的密度为1.56 g/cm3,立方晶胞参数为0.57 nm,则每个晶胞实际占用CO2的数目为_______ 。
(1)区分金刚石和无定形碳最可靠的科学方法为
(2)咖啡因结构为
 。
。①咖啡因中C原子的杂化形式为
②1 mol咖啡因中所含
 键数目为
键数目为③咖啡因通常在水中的溶解度较小,加入适量
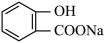 能增大其在水中溶解度的原因为
能增大其在水中溶解度的原因为④CH3+(甲基正离子)的立体构型为
(3)CO、NO、H2S均为生命体系气体信号分子。其中H、C、O、S的电负性由大到小的顺序为
(4)干冰可用于人工降雨。其熔点低于金刚石的原因为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】依据物质结构知识回答下列问题。
Ⅰ.硒是一种非金属,可以用作光敏材料、电解锰行业的催化剂。
(1)Se是元素周期表中第34号元素,其基态原子的核外电子简化电子排布式为___________ 。
(2)根据价层电子对互斥理论,可以推知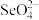 的空间构型为
的空间构型为___________ ,其中Se原子采用的轨道杂化方式为___________ 。
(3)已知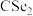 与
与 结构相似,①
结构相似,①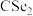 分子内的键角
分子内的键角 、②
、② 分子内的键角
分子内的键角 、③
、③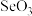 分子内的键角
分子内的键角 ,三种键角由大到小的顺序为
,三种键角由大到小的顺序为___________ (填序号)。
Ⅱ.碳是一种重要元素,可形成多种单质及化合物。
(4)已知 与
与 结构相似,推算HCN分子中
结构相似,推算HCN分子中 键与
键与 键数目之比为
键数目之比为___________ 。氨基氰( )为原料可制得类石墨相氮化碳(
)为原料可制得类石墨相氮化碳(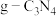 ),氨基氰(
),氨基氰( )分子中碳、氮原子均满足8电子稳定结构,则该分子的结构式为
)分子中碳、氮原子均满足8电子稳定结构,则该分子的结构式为___________ 。
(5)“C919”飞机机身使用的复合材料——碳纤维和环氧树脂。下列电子排布图能表示碳原子的最低能量状态的是___________。
Ⅰ.硒是一种非金属,可以用作光敏材料、电解锰行业的催化剂。
(1)Se是元素周期表中第34号元素,其基态原子的核外电子简化电子排布式为
(2)根据价层电子对互斥理论,可以推知
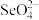 的空间构型为
的空间构型为(3)已知
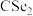 与
与 结构相似,①
结构相似,①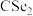 分子内的键角
分子内的键角 、②
、② 分子内的键角
分子内的键角 、③
、③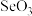 分子内的键角
分子内的键角 ,三种键角由大到小的顺序为
,三种键角由大到小的顺序为Ⅱ.碳是一种重要元素,可形成多种单质及化合物。
(4)已知
 与
与 结构相似,推算HCN分子中
结构相似,推算HCN分子中 键与
键与 键数目之比为
键数目之比为 )为原料可制得类石墨相氮化碳(
)为原料可制得类石墨相氮化碳(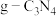 ),氨基氰(
),氨基氰( )分子中碳、氮原子均满足8电子稳定结构,则该分子的结构式为
)分子中碳、氮原子均满足8电子稳定结构,则该分子的结构式为(5)“C919”飞机机身使用的复合材料——碳纤维和环氧树脂。下列电子排布图能表示碳原子的最低能量状态的是___________。
A. | B. |
C.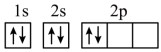 | D. |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】日前新合成的砷化镉三维材料具有超强导电性,这种材料的电气性能与石墨烯相当,可代替石墨烯使用。
(1)Cd与Zn同族且相邻,若Cd基态原子将次外层1个d电子激发进入最外层的np能级,则该激发态 原子的外围电子排布式为___ 。
(2)与砷(As)同主族的N、P两种元素的氢化物水溶液的碱性:NH3强于PH3,分析其原因是___ 。
(3)As、Ge、Se的第一电离能由大到小的顺序为___ (用元素符号表示)。
(4)含砷有机物“对氨基苯胂酸”的结构简式如图,其中C原子轨道杂化类型为___ ,1mol对氨基苯胂酸含σ键数目为___ 。

(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构如图,As为面心立方堆积,Cd占据As围成的四面体空隙,空隙占有率75%,如图“①”和“②”位是“空位”。则砷化镉化学式为___ 。

(1)Cd与Zn同族且相邻,若Cd基态原子将次外层1个d电子激发进入最外层的np能级,则该
(2)与砷(As)同主族的N、P两种元素的氢化物水溶液的碱性:NH3强于PH3,分析其原因是
(3)As、Ge、Se的第一电离能由大到小的顺序为
(4)含砷有机物“对氨基苯胂酸”的结构简式如图,其中C原子轨道杂化类型为

(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构如图,As为面心立方堆积,Cd占据As围成的四面体空隙,空隙占有率75%,如图“①”和“②”位是“空位”。则砷化镉化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是________ ,该元素基态原子核外M层电子的自旋状态_________ (填“相同”或“相反”)。
(2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为________ ,其中Fe的配位数为_____________ 。
(3)苯胺 )的晶体类型是
)的晶体类型是__________ 。苯胺与甲苯(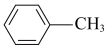 )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是___________ 。
(4)NH4H2PO4中,电负性最高的元素是______ ;P的_______ 杂化轨道与O的2p轨道形成_______ 键。
(5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
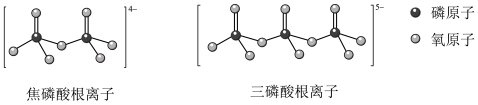
这类磷酸根离子的化学式可用通式表示为____________ (用n代表P原子数)。
(1)在周期表中,与Li的化学性质最相似的邻族元素是
(2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为
(3)苯胺
 )的晶体类型是
)的晶体类型是 )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是(4)NH4H2PO4中,电负性最高的元素是
(5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:

这类磷酸根离子的化学式可用通式表示为
您最近一年使用:0次
【推荐2】CsCl晶体结构模型
(1)在CsCl晶体中,每个Cs+周围与它等距的Cl-有_____ 个,每个Cl-周围与它等距的Cs+有_____ 个。Cs+和Cl-配位数都是_____ 。
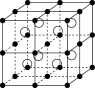
(2)每个Cs+周围与它最近且等距的Cs+有_____ 个,每个Cl-周围与它最近且等距的Cl-有_____ 个(上、下、左、右、前、后)。
(3)在CsCl晶体的一个晶胞中(如图),含Cs+:_____ 个,含Cl-_____ 个(写出计算过程)。故CsCl晶体中Cs+与Cl-的个数比为_____ 。

(1)在CsCl晶体中,每个Cs+周围与它等距的Cl-有

(2)每个Cs+周围与它最近且等距的Cs+有
(3)在CsCl晶体的一个晶胞中(如图),含Cs+:

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】(1)钠、钾、铬、钼、钨等金属晶体的晶胞属于体心立方,则该晶胞中属于1个体心立方晶胞的金属原子数目是____________ 。氯化铯晶体的晶胞如图1,则Cs+位于该晶胞的__________ ,而Cl-位于该晶胞的________ ,Cs+的配位数是____________ 。
(2)铜的氢化物的晶体结构如图2所示,写出此氢化物在氯气中燃烧的化学方程式:______ 。
(3)图3为F-与Mg2+、K+形成的某种离子晶体的晶胞,其中“○”表示的离子是________ (填离子符号)。
(4)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图4所示),已知3种离子晶体的晶格能数据如下表:
则这4种离子晶体(不包括NaCl)熔点从高到低的顺序是_____ 。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有________ 个。

(2)铜的氢化物的晶体结构如图2所示,写出此氢化物在氯气中燃烧的化学方程式:
(3)图3为F-与Mg2+、K+形成的某种离子晶体的晶胞,其中“○”表示的离子是
(4)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图4所示),已知3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3 401 |

您最近一年使用:0次



