1 . 铜及其合金是人类最早使用的金属材料。
(1)铜原子的价电子排布式是___________ 。
(2)如图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为___________ 。

(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+的结构式是为___________ 。
且[Cu(NH3)4]2+中存在的化学键类型有___________ (填序号)。
A、配位键 B、金属键 C、极性共价键 D、非极性共价键 E、离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___________ 。
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO,在丙烯醇分子中共有___________ σ键和___________ π键。
(1)铜原子的价电子排布式是
(2)如图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为

(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+的结构式是为
且[Cu(NH3)4]2+中存在的化学键类型有
A、配位键 B、金属键 C、极性共价键 D、非极性共价键 E、离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO,在丙烯醇分子中共有
您最近一年使用:0次
名校
解题方法
2 . 硼砂是含结晶水的四硼酸钠。以硼砂为原料,可以得到BF3、BN和硼酸等重要化合物,请根据下列信息回答有关问题:
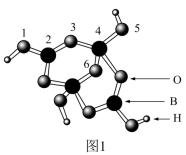
(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图1所示,则在Xm-中,2号硼原子的杂化类型为________ ;4号硼原子参与形成的化学键有________ ;m=________ (填数字)。
(2)BF3和过量NaF作用可生成NaBF4,BF 的价层电子对数为
的价层电子对数为________ ;BF 的立体构型为
的立体构型为____________ 。
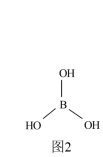
(3)硼酸[B(OH)3]结构如图2所示,分子中一个B原子与3个羟基相连,硼酸为一元弱酸,与过量NaOH反应生成[B(OH)4]-,请用化学键有关知识分析[B(OH)4]-的形成原因:___________________ 。
(4)镧系合金是稀土系储氢合金的典型代表,由荷兰菲利浦实验室首先研制出来。它的最大优点是容易活化。其晶胞结构如图所示,则它的化学式为____________ ,镍的价电子排布式____________ 。

(5)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为________ 。

②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为______ g·cm-3(列出计算式即可)。


(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图1所示,则在Xm-中,2号硼原子的杂化类型为
(2)BF3和过量NaF作用可生成NaBF4,BF
 的价层电子对数为
的价层电子对数为 的立体构型为
的立体构型为(3)硼酸[B(OH)3]结构如图2所示,分子中一个B原子与3个羟基相连,硼酸为一元弱酸,与过量NaOH反应生成[B(OH)4]-,请用化学键有关知识分析[B(OH)4]-的形成原因:
(4)镧系合金是稀土系储氢合金的典型代表,由荷兰菲利浦实验室首先研制出来。它的最大优点是容易活化。其晶胞结构如图所示,则它的化学式为

(5)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为
您最近一年使用:0次
3 . 以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵【(NH4)3Fe(C6H5O7)2】。
(1)Fe基态核外电子排布式为___________ ; 中与Fe2+配位的原子是
中与Fe2+配位的原子是________ (填元素符号)。
(2)NH3分子中氮原子的轨道杂化类型是____________ ;C、N、O元素的第一电离能由大到小的顺序为_______________ 。
(3)与NH 互为等电子体的一种分子为
互为等电子体的一种分子为_______________ (填化学式)。
(4)柠檬酸的结构简式见图。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为_________ mol。

(1)Fe基态核外电子排布式为
 中与Fe2+配位的原子是
中与Fe2+配位的原子是(2)NH3分子中氮原子的轨道杂化类型是
(3)与NH
 互为等电子体的一种分子为
互为等电子体的一种分子为(4)柠檬酸的结构简式见图。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为

您最近一年使用:0次
2020-07-11更新
|
4578次组卷
|
10卷引用:黑龙江省哈尔滨市第六中学2021-2022学年高二下学期期中考试化学试题
黑龙江省哈尔滨市第六中学2021-2022学年高二下学期期中考试化学试题2020年江苏卷化学高考试题(已下线)专题17 物质结构与性质(选修)-2020年高考真题和模拟题化学分项汇编山东省潍坊市临朐县实验中学2021届高三9月月考化学试题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)考向37 分子结构与性质-备战2022年高考化学一轮复习考点微专题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)2020年江苏卷化学高考真题变式题16-21(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)结构与性质
名校
解题方法
4 . 早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)基态Fe原子有______ 个未成对电子,Fe3+的电子排布式为______ 。可用硫氰化钾检验Fe3+,形成的配合物的颜色为______ 。
(2)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。1mol乙醛分子中含有的键的数目为______ 。乙醛中碳原子的杂化轨道类型为______ ,乙酸的沸点明显高于乙醛,其主要原因是______ 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______ 个铜原子。
(3)Al单质为面心立方晶体,其晶胞边长a0.405nm,晶胞中铝原子的配位数为______ 。列式表示Al单质的密度______ gcm-3。(阿伏加 德罗常数用NA表示)
(1)基态Fe原子有
(2)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。1mol乙醛分子中含有的键的数目为
(3)Al单质为面心立方晶体,其晶胞边长a0.405nm,晶胞中铝原子的配位数为
您最近一年使用:0次



