名校
解题方法
1 . 金刚石、石墨、二氧化碳、氯化铯、氯化钠的结构模型如图所示(石墨仅表示出其中的一层结构):

(1)石墨属于_______ 晶体,金刚石与石墨互为_______ ;
(2)金刚石晶体结构中最小的环为六元环,在六元环中最多有_______ 个原子共平面,平均每个六元环占有的碳原子数是_______ ;
(3)1mol 石墨中含C-C键的数目为:_______ (用含NA的式子表示);
(4)CO2分子晶体中,每个CO2分子周围有_______ 个与之紧邻且等距的CO2分子。
(5)CsCl晶体中每个Cl-周围紧邻且等距的Cs+数目为_______ 。
(6)NaCl晶体中Na+的配位数为_______ ,Na+周围紧邻且等距的Cl-形成的空间构型为_______ 。

(1)石墨属于
(2)金刚石晶体结构中最小的环为六元环,在六元环中最多有
(3)1mol 石墨中含C-C键的数目为:
(4)CO2分子晶体中,每个CO2分子周围有
(5)CsCl晶体中每个Cl-周围紧邻且等距的Cs+数目为
(6)NaCl晶体中Na+的配位数为
您最近一年使用:0次
名校
解题方法
2 . 东晋《华阳国志·南中志》卷四中关于白铜的记载——云南镍白铜(铜镍合金),曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)Ni基态原子的电子排布式为___________ ;它在元素周期表中的位置___________ 。
(2)单质铜及镍都是由___________ 键形成的晶体;元素铜与镍的第二电离能分别为:Icu=1958kJ•mol-1、INi=1753kJ•mol-1,Icu>INi的原因是___________ 。
(3)Ni2+与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验Ni2+。
2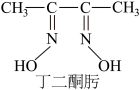 +Ni2+→
+Ni2+→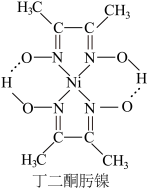 ↓+2H+
↓+2H+
①1mol丁二酮肟分子中含有σ键的数目为___________ mol。
②丁二酮肟镍分子中碳原子的杂化轨道类型为___________ 。
(4)Ni的晶胞结构如图所示,镍晶体配位数目是___________ ;若Ni的原子半径为dpm,Ni的密度计算表达式是___________ g/cm3(Ni的相对原子量用Mr表示)。
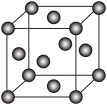 (Ni的晶胞结构)
(Ni的晶胞结构)
(1)Ni基态原子的电子排布式为
(2)单质铜及镍都是由
(3)Ni2+与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验Ni2+。
2
 +Ni2+→
+Ni2+→ ↓+2H+
↓+2H+①1mol丁二酮肟分子中含有σ键的数目为
②丁二酮肟镍分子中碳原子的杂化轨道类型为
(4)Ni的晶胞结构如图所示,镍晶体配位数目是
 (Ni的晶胞结构)
(Ni的晶胞结构)
您最近一年使用:0次
名校
解题方法
3 . 原子序数小于36的X、Y、Z、R、W五种元素,其中X是周期表中原子半径最小的元素,Y是形成化合物种类最多的元素,Z原子基态时2p原子轨道上有3个未成对的电子,R单质占空气体积的 ;W的原子序数为29。回答下列问题:
;W的原子序数为29。回答下列问题:
(1)Y2X4分子中Y原子轨道的杂化类型为________ ,1mol Z2X4含有σ键的数目为 ________ 。
(2)化合物ZX3与化合物X2R的VSEPR构型相同,但立体构型不同,ZX3的立体构型为________ ,两种化合物分子中化学键的键角较小的是________ (用分子式表示,下同)。
(3)与R同主族的三种非金属元素与X可形成结构相似的三种物质,试推测三者的稳定性由大到小的顺序________ ,理由是 ________ ;三者的沸点由高到低的顺序是 ________ ,解释原因________ 。
(4)元素Y的一种氧化物与元素Z的单质互为等电子体,元素Y的这种氧化物的分子式是________ 。
(5)W元素有________ 个运动状态不同的电子,其基态原子的价电子排布式为________ 。
 ;W的原子序数为29。回答下列问题:
;W的原子序数为29。回答下列问题:(1)Y2X4分子中Y原子轨道的杂化类型为
(2)化合物ZX3与化合物X2R的VSEPR构型相同,但立体构型不同,ZX3的立体构型为
(3)与R同主族的三种非金属元素与X可形成结构相似的三种物质,试推测三者的稳定性由大到小的顺序
(4)元素Y的一种氧化物与元素Z的单质互为等电子体,元素Y的这种氧化物的分子式是
(5)W元素有
您最近一年使用:0次
2019-05-06更新
|
102次组卷
|
3卷引用:四川省宜宾市第四中学2018-2019学年高二下学期期中考试化学试题
四川省宜宾市第四中学2018-2019学年高二下学期期中考试化学试题吉林省辽源市田家炳高级中学2018-2019学年高二下学期期中考试化学试题(已下线)2019年6月16日 《每日一题》选修3-每周一测
名校
解题方法
4 . 非金属元素可以形成多种物质,如氧化物、氢化物、配合物等。
(1)制备CrO2Cl2的反应为K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①基态Cr 原子的外围电子排布图为____________ ;等物质的量的COCl2与N2组成的混合气体中,σ键与π键的物质的量之比为____________ 。上述化学方程式中非金属元素电负性由大到小的顺序是____________ (用元素符号表示)。
②基态K+中,电子占据的最高能层符号为__________ ,该能层具有的原子轨道数为________________ ;金属钾晶体的堆积模型为____________ 。
(2)PM 2.5与光化学烟雾污染密切相关,光化学烟雾中含有NOx、O3、CH2=CHCHO、HCOOH等二次污染物。结合等电子体的性质,判断下列说法正确的是___________________ (填选项字母)。
A. N2O的结构式为N=N=O
B. O3分子的立体构型为直线型
C. CH2=CHCHO分子中碳原子的杂化轨道类型为sp2、sp3
D. 相同压强下,HCOOH的沸点比CH3OCH3高,主要原因为HCOOH分子间存在氢键
(3)金属元素常常作为重要的合金材料。Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为________________ 。
②该晶体的内部具有空隙,且每个晶胞中储存6个氢原子比较稳定。已知:a=500 pm,c=400pm;标准状况下氢气的密度约为9.00×10-5 g·cm-3;
储氢能力= 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为________ (已知sin60°=0.87,保留4位有效数字)。
(1)制备CrO2Cl2的反应为K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①基态Cr 原子的外围电子排布图为
②基态K+中,电子占据的最高能层符号为
(2)PM 2.5与光化学烟雾污染密切相关,光化学烟雾中含有NOx、O3、CH2=CHCHO、HCOOH等二次污染物。结合等电子体的性质,判断下列说法正确的是
A. N2O的结构式为N=N=O
B. O3分子的立体构型为直线型
C. CH2=CHCHO分子中碳原子的杂化轨道类型为sp2、sp3
D. 相同压强下,HCOOH的沸点比CH3OCH3高,主要原因为HCOOH分子间存在氢键
(3)金属元素常常作为重要的合金材料。Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为
②该晶体的内部具有空隙,且每个晶胞中储存6个氢原子比较稳定。已知:a=500 pm,c=400pm;标准状况下氢气的密度约为9.00×10-5 g·cm-3;
储氢能力=
 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
您最近一年使用:0次
名校
解题方法
5 . 原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E元素原子序数为29。
用元素符号或化学式回答下列问题:
(1)Y在周期表中的位置为__________________ 。
(2)已知YZ2+与XO2互为等电子体,则1mol YZ2+中含有π键数目为___________ 。
(3)X、Z与氢元素可形成化合物XH2Z,XH2Z分子中X的杂化方式为_________________ 。
(4)E原子的核外电子排布式为__________ ;E有可变价态,它的某价态的离子与Z的阴离子形成晶体的晶胞如图所示,该价态的化学式为____________ 。
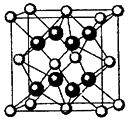
(5)氧元素和钠元素能够形成化合物F,其晶胞结构如图所示(立方体晶胞),晶体的密度为ρg··cm-3,列式计算晶胞的边长为a=______________ cm(要求列代数式)。
用元素符号或化学式回答下列问题:
(1)Y在周期表中的位置为
(2)已知YZ2+与XO2互为等电子体,则1mol YZ2+中含有π键数目为
(3)X、Z与氢元素可形成化合物XH2Z,XH2Z分子中X的杂化方式为
(4)E原子的核外电子排布式为

(5)氧元素和钠元素能够形成化合物F,其晶胞结构如图所示(立方体晶胞),晶体的密度为ρg··cm-3,列式计算晶胞的边长为a=
您最近一年使用:0次
2017-04-22更新
|
364次组卷
|
2卷引用:2016-2017学年四川省双流中学高二下学期期中考试化学试卷
11-12高二上·四川成都·期中
解题方法
6 . X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)Y元素基态原子的电子排布式为 。
(2)Y的简单离子半径 Z的简单离子半径(选填“>”、“=”、“<”)。
(3)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H-Y、H-Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(4)向WYO4的水溶液中逐滴加入氨水至过量,观察到现象为 。反应过程中涉及的离子方程式为: 、 。
| 元素 | 相 关 信 息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | Y元素的激发态原子的电子排布式为1s22s22p63s23p34s1 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(1)Y元素基态原子的电子排布式为 。
(2)Y的简单离子半径 Z的简单离子半径(选填“>”、“=”、“<”)。
(3)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H-Y、H-Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(4)向WYO4的水溶液中逐滴加入氨水至过量,观察到现象为 。反应过程中涉及的离子方程式为: 、 。
您最近一年使用:0次



