1 . 、臭氧 在
在 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。
(1)基态铁原子有___________ 种空间运动状态不同的电子; 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为___________ ; 的空间构型为
的空间构型为___________ (用文字描述); 为
为___________ 分子(填“极性”、“非极性”)。
(2)碘的四氯化碳溶液为紫红色,加入浓碘化钾水溶液,振荡后溶液紫色变浅,请用离子方程式说明原因___________ 。
(3)硫单质的常见形式为 ,其环状结构如图所示,
,其环状结构如图所示, 中含有
中含有___________ 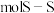 键。
键。 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的192℃,由此可以判断铝氟之间的化学键为
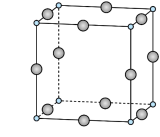
的192℃,由此可以判断铝氟之间的化学键为___________ 键。 结构属立方晶系,晶胞如图所示,
结构属立方晶系,晶胞如图所示, 的配位数为。若晶胞参数为
的配位数为。若晶胞参数为 ,晶体密度
,晶体密度
___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 在
在 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。(1)基态铁原子有
 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为 的空间构型为
的空间构型为 为
为(2)碘的四氯化碳溶液为紫红色,加入浓碘化钾水溶液,振荡后溶液紫色变浅,请用离子方程式说明原因
(3)硫单质的常见形式为
 ,其环状结构如图所示,
,其环状结构如图所示, 中含有
中含有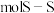 键。
键。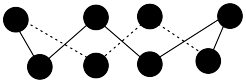
 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的192℃,由此可以判断铝氟之间的化学键为
的192℃,由此可以判断铝氟之间的化学键为 结构属立方晶系,晶胞如图所示,
结构属立方晶系,晶胞如图所示, 的配位数为。若晶胞参数为
的配位数为。若晶胞参数为 ,晶体密度
,晶体密度
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
2 . Si、S、Se在自然界中形成多种多样的物质结构。回答下列问题:
(1)Se与O同族,电负性较大的是_____ ;基态Se原子的价电子运动状态有_____ 种。
(2)已知液态的二氧化硫可以发生类似水的自电离: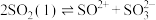 。
。 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为__ , 的空间结构为
的空间结构为_______ 。
(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物 和
和 的结构如图所示,
的结构如图所示, 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为_______ ,二者中更易与 形成配位键的是
形成配位键的是_______ 。 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是_______ 。
(5) -硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。
-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。 -硒六方晶胞参数为
-硒六方晶胞参数为 、
、 、
、 (其中
(其中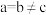 ),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为
),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为 。
。_______ 。晶胞中含有Se原子的数目为_______ ;则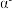 -硒晶胞的摩尔体积为
-硒晶胞的摩尔体积为______  (列出算式)。
(列出算式)。
(1)Se与O同族,电负性较大的是
(2)已知液态的二氧化硫可以发生类似水的自电离:
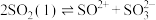 。
。 中各原子满足8电子结构,则其
中各原子满足8电子结构,则其 键和
键和 键数目之比为
键数目之比为 的空间结构为
的空间结构为(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物
 和
和 的结构如图所示,
的结构如图所示, 为平面形,二者中N的杂化方式分别为
为平面形,二者中N的杂化方式分别为 形成配位键的是
形成配位键的是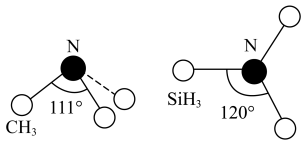
 熔点(>1700℃)明显高于
熔点(>1700℃)明显高于 (315℃),原因是
(315℃),原因是(5)
 -硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。
-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。 -硒六方晶胞参数为
-硒六方晶胞参数为 、
、 、
、 (其中
(其中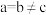 ),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为
),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为 。
。
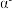 -硒晶胞的摩尔体积为
-硒晶胞的摩尔体积为 (列出算式)。
(列出算式)。
您最近一年使用:0次
名校
解题方法
3 . 锗(Ge)、碲化镉(CdTe)等是优良的半导体材料。回答下列问题:
(1)Ge在元素周期表中的位置___________ ,Ge的逐级电离能I4≪I5的原因是___________ 。
(2)经X射线衍射实验证明在碲酸( )分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为
)分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为___________ 。
(3)锗可以形成无机化合物 ,化合物中阴离子的空间构型为
,化合物中阴离子的空间构型为___________ ,锗也可以形成类似于烷烃结构的 (n一般小于5),化合物中Ge的杂化类型为
(n一般小于5),化合物中Ge的杂化类型为___________ , 该分子中含有的
该分子中含有的 键数目为
键数目为___________ 。
(4)锗的氯化物 常温下为无色液体,其沸点高于
常温下为无色液体,其沸点高于 ,原因是
,原因是___________ , 晶体采用ABC式的密堆积方式,则距离一个
晶体采用ABC式的密堆积方式,则距离一个 最近且等距离的
最近且等距离的 有
有___________ 个。
(5)CdTe的晶胞属立方晶系,晶胞如图所示,Te原子填充在Cd原子围成的空隙中该空隙的类型为___________ 空隙(填几何构型名称),若CdTe的摩尔质量为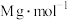 ,该晶体的密度为
,该晶体的密度为 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 ,则最近的两个Te原子的距离
,则最近的两个Te原子的距离___________ nm。(用含M、 、
、 的代数式表示)
的代数式表示)

(1)Ge在元素周期表中的位置
(2)经X射线衍射实验证明在碲酸(
 )分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为
)分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为(3)锗可以形成无机化合物
 ,化合物中阴离子的空间构型为
,化合物中阴离子的空间构型为 (n一般小于5),化合物中Ge的杂化类型为
(n一般小于5),化合物中Ge的杂化类型为 该分子中含有的
该分子中含有的 键数目为
键数目为(4)锗的氯化物
 常温下为无色液体,其沸点高于
常温下为无色液体,其沸点高于 ,原因是
,原因是 晶体采用ABC式的密堆积方式,则距离一个
晶体采用ABC式的密堆积方式,则距离一个 最近且等距离的
最近且等距离的 有
有(5)CdTe的晶胞属立方晶系,晶胞如图所示,Te原子填充在Cd原子围成的空隙中该空隙的类型为
 ,该晶体的密度为
,该晶体的密度为 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 ,则最近的两个Te原子的距离
,则最近的两个Te原子的距离 、
、 的代数式表示)
的代数式表示)
您最近一年使用:0次
解题方法
4 . 2020年12月17日,我国的嫦娥五号返回器携带月球样品,在内蒙古预定区域安全着陆。经科学家分析,发现月球土壤中富含有He、O、Si、 Fe、 Mg、Ca、Mn、Ti、Al、Au、Ag、 Pb、 Zn、 Cu等元素。
(1)使用3He的热核反应堆没有中子产生,故使用3He作为能源时,不会产生辐射。写出He的电子排布图_______ 。
(2)溶液中Fe3+比Fe2+更稳定的原因是_______ 。
(3)金属Ca和Mn属于同一周期,且核外最外层电子构型相同,但金属Ca的熔点沸点等都比金属Mn低,其原因是_______ 。
(4)向Cu(OH)2悬浊液中通入NH3,蓝色沉淀溶解,溶液变为深蓝色,发生了如下反应:Cu(OH)2 + 4NH3 = [Cu(NH3)4]2+ + 2OH—,NH3分子中N的杂化类型为_______ , 比较NH3和[Cu(NH3)4]2+中H—N—H 键角的大小: NH3_______ [Cu(NH3)4]2+ (填“>”或“<”),1mol [Cu(NH3)4]2+中σ键的数目为_______ NA。
(5)CaTiO3的晶胞如图所示,Ti4+的配位数是_______ ,若Ca2+位于晶胞顶点,则O2-位于_______ 位置,若晶胞参数为anm,则晶体密度为_______ g·cm-3 (列出计算式,阿伏加德罗常数用NA表示)。

(1)使用3He的热核反应堆没有中子产生,故使用3He作为能源时,不会产生辐射。写出He的电子排布图
(2)溶液中Fe3+比Fe2+更稳定的原因是
(3)金属Ca和Mn属于同一周期,且核外最外层电子构型相同,但金属Ca的熔点沸点等都比金属Mn低,其原因是
(4)向Cu(OH)2悬浊液中通入NH3,蓝色沉淀溶解,溶液变为深蓝色,发生了如下反应:Cu(OH)2 + 4NH3 = [Cu(NH3)4]2+ + 2OH—,NH3分子中N的杂化类型为
(5)CaTiO3的晶胞如图所示,Ti4+的配位数是

您最近一年使用:0次
名校
5 . 中科院大连物化所成功利用具有尖晶石结构的Co3O4电催化剂电解水。
(1)Co在周期表中的位置是____ ,基态Co的电子占据的最高能层符号为____ 。
(2)钴盐引发动物中毒时,通常可以用EDTA(结构如图)解毒。其中,N的杂化方式均为____ ,N的I1(第一电离能)大于O的I1,其原因是____ ;自由基是指含单电子的基团,1mol—COOH(羧基自由基)中存在____ molσ键和____ molπ键。

(3)EDTA可以由乙二胺与甲醛、氰化钠间接得到。离子化合物氰化钠的晶体类型为____ ,甲醛分子的空间构型为____ 。
(4)Co3O4晶体中O作面心立方最密堆积(如图),Co随机填充在晶胞中O构成的8个四面体空隙和4个八面体空隙中,则Co的配位数分别为____ ,Co总的空隙填充率为____ ,如果晶胞边长为anm,Co3O4的摩尔质量为Mg/mol,NA为阿伏加德罗常数的值,则Co3O4的晶体密度为____ g/cm3(列出计算式)。

(1)Co在周期表中的位置是
(2)钴盐引发动物中毒时,通常可以用EDTA(结构如图)解毒。其中,N的杂化方式均为

(3)EDTA可以由乙二胺与甲醛、氰化钠间接得到。离子化合物氰化钠的晶体类型为
(4)Co3O4晶体中O作面心立方最密堆积(如图),Co随机填充在晶胞中O构成的8个四面体空隙和4个八面体空隙中,则Co的配位数分别为

您最近一年使用:0次
2022-03-26更新
|
383次组卷
|
3卷引用:四川省遂宁市2022届高三第二次诊断性考试(二模)理综化学试题
名校
解题方法
6 . 东晋《华阳国志·南中志》卷四中关于白铜的记载——云南镍白铜(铜镍合金),曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)Ni基态原子的电子排布式为___________ ;它在元素周期表中的位置___________ 。
(2)单质铜及镍都是由___________ 键形成的晶体;元素铜与镍的第二电离能分别为:Icu=1958kJ•mol-1、INi=1753kJ•mol-1,Icu>INi的原因是___________ 。
(3)Ni2+与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验Ni2+。
2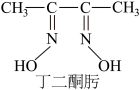 +Ni2+→
+Ni2+→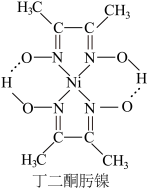 ↓+2H+
↓+2H+
①1mol丁二酮肟分子中含有σ键的数目为___________ mol。
②丁二酮肟镍分子中碳原子的杂化轨道类型为___________ 。
(4)Ni的晶胞结构如图所示,镍晶体配位数目是___________ ;若Ni的原子半径为dpm,Ni的密度计算表达式是___________ g/cm3(Ni的相对原子量用Mr表示)。
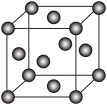 (Ni的晶胞结构)
(Ni的晶胞结构)
(1)Ni基态原子的电子排布式为
(2)单质铜及镍都是由
(3)Ni2+与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验Ni2+。
2
 +Ni2+→
+Ni2+→ ↓+2H+
↓+2H+①1mol丁二酮肟分子中含有σ键的数目为
②丁二酮肟镍分子中碳原子的杂化轨道类型为
(4)Ni的晶胞结构如图所示,镍晶体配位数目是
 (Ni的晶胞结构)
(Ni的晶胞结构)
您最近一年使用:0次
2014高三·全国·专题练习
名校
解题方法
7 . A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是_______ (用对应的元素符号表示);基态D原子的电子排布式为______ 。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取_____ 杂化;BC3-的立体构型为______ (用文字描述)。
(3)1mol AB-中含有的π键个数为______ 。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比______ 。
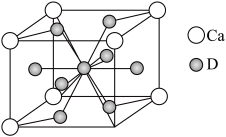
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________ (填数值);氢在合金中的密度为________ (保留2位有效数字)。
(1)A、B、C的第一电离能由小到大的顺序是
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取
(3)1mol AB-中含有的π键个数为
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比

(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=
您最近一年使用:0次
2019-12-08更新
|
181次组卷
|
12卷引用:2016届四川省新津中学高三下学期入学考试化学试卷
2016届四川省新津中学高三下学期入学考试化学试卷(已下线)2014年高考化学指导冲关 第13练物质结构与性质练习卷(已下线)2014届高考化学二轮专题冲刺第16讲 物质结构与性质练习卷(已下线)2014高考名师推荐化学--预测172018版化学(苏教版)高考总复习专题十一课时跟踪训练--微粒间作用力与物质性质【全国百强校】重庆市第一中学校2019届高三上学期期中考试理科综合化学试题【市级联考】湖北省鄂州市2019届高三上学期期中考试理科综合化学试题(已下线)第11章 单元测试(测)-《2020年高考一轮复习讲练测》江西省临川一中2020届高三上学期第一次联考化学试题广东省梅州市五华县2020届高三上学期期末质检理综化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编(已下线)第十一章 能力提升检测卷-2021年高考化学一轮复习讲练测
名校
解题方法
8 . 自然界中存在大量的金属元素,其中钠、镁、铝、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为__________ ,N、O、S元素的原子对键合电子吸引力最大的是___________ 。
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1mol CN−中含有的π键的数目为__________ 。与CN−互为等电子体的离子或分子有__________ (写出一种即可)。
(3)[Cu(NH3)4]2+中,提供孤对电子的是___________ 。Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是___________ (填“极性”或“非极性”)分子,由此推知[Cu(NH)4]2+的空间构型是___________ 。(填“平面正方形”或“正四面体”)
(4)NH3中N原子的杂化方式是___________ ,硫元素对应的含氧酸酸性是H2SO4强于H2SO3,其原因为___________ 。
(5)铜的一种氧化物晶体结构如图所示,该氧化物的化学式是___________ 。若该晶体结构为长方体,其参数如图,阿伏加 德罗常数为NA,则该氧化物的密度为___________ g/cm3。
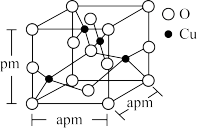
(1)CuSO4和Cu(NO3)2中阳离子核外电子排布式为
(2)在硫酸铜溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1mol CN−中含有的π键的数目为
(3)[Cu(NH3)4]2+中,提供孤对电子的是
(4)NH3中N原子的杂化方式是
(5)铜的一种氧化物晶体结构如图所示,该氧化物的化学式是

您最近一年使用:0次
2019-12-05更新
|
199次组卷
|
2卷引用:四川省宜宾市叙州区第二中学校2020届高三下学期第一次在线月考理综化学试题
名校
解题方法
9 . 原子序数小于36的X、Y、Z、R、W五种元素,其中X是周期表中原子半径最小的元素,Y是形成化合物种类最多的元素,Z原子基态时2p原子轨道上有3个未成对的电子,R单质占空气体积的 ;W的原子序数为29。回答下列问题:
;W的原子序数为29。回答下列问题:
(1)Y2X4分子中Y原子轨道的杂化类型为________ ,1mol Z2X4含有σ键的数目为 ________ 。
(2)化合物ZX3与化合物X2R的VSEPR构型相同,但立体构型不同,ZX3的立体构型为________ ,两种化合物分子中化学键的键角较小的是________ (用分子式表示,下同)。
(3)与R同主族的三种非金属元素与X可形成结构相似的三种物质,试推测三者的稳定性由大到小的顺序________ ,理由是 ________ ;三者的沸点由高到低的顺序是 ________ ,解释原因________ 。
(4)元素Y的一种氧化物与元素Z的单质互为等电子体,元素Y的这种氧化物的分子式是________ 。
(5)W元素有________ 个运动状态不同的电子,其基态原子的价电子排布式为________ 。
 ;W的原子序数为29。回答下列问题:
;W的原子序数为29。回答下列问题:(1)Y2X4分子中Y原子轨道的杂化类型为
(2)化合物ZX3与化合物X2R的VSEPR构型相同,但立体构型不同,ZX3的立体构型为
(3)与R同主族的三种非金属元素与X可形成结构相似的三种物质,试推测三者的稳定性由大到小的顺序
(4)元素Y的一种氧化物与元素Z的单质互为等电子体,元素Y的这种氧化物的分子式是
(5)W元素有
您最近一年使用:0次
2019-05-06更新
|
102次组卷
|
3卷引用:四川省宜宾市第四中学2018-2019学年高二下学期期中考试化学试题
四川省宜宾市第四中学2018-2019学年高二下学期期中考试化学试题吉林省辽源市田家炳高级中学2018-2019学年高二下学期期中考试化学试题(已下线)2019年6月16日 《每日一题》选修3-每周一测
10 . Fe3+与CN-、F-、有机分子等形成的化合物具有广泛的应用。
(1)Fe3+基态核外电子排布式为________ 。
(2)乙酰基二茂铁是常用汽油抗震剂,其结构如图甲所示。此物质中碳原子的杂化方式是__________ 。
(3)C、N、O原子的第一电离能由大到小的顺序是___________________________ 。
(4)配合物K3Fe(CN)6可用于电子传感器的制作。与配体互为等电子体的一种分子的化学式为________________ 。已知(CN)2是直线形分子,并具有对称性,则(CN)2中π键和σ键的个数比为__________________ 。
(5)F-不仅可与Fe3+形成3-,还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,其结构如图乙所示,则该晶体的化学式为__________________________ 。

(1)Fe3+基态核外电子排布式为
(2)乙酰基二茂铁是常用汽油抗震剂,其结构如图甲所示。此物质中碳原子的杂化方式是
(3)C、N、O原子的第一电离能由大到小的顺序是
(4)配合物K3Fe(CN)6可用于电子传感器的制作。与配体互为等电子体的一种分子的化学式为
(5)F-不仅可与Fe3+形成3-,还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,其结构如图乙所示,则该晶体的化学式为

您最近一年使用:0次



