名校
解题方法
1 . 利用所学知识,按要求完成以下填空:
(1)基态Cl原子的原子核外电子运动状态有________ 种,原子轨道数为________ ,有_______ 种能量不同的电子。
(2)已知第四周期有18种元素,根据构造原理,这18种元素基态原子的价层电子最后填入的能级按照能量次序,其名称依次为___________ 、___________ 、___________ ,现行的长式周期表中,元素Ag位于周期表的___________ 区。
(3)尿素分子 中,C、N的杂化方式分别为:
中,C、N的杂化方式分别为:___________ 、___________ 。分子中包含元素的电负性由大到小的顺序是___________ 。
(4)元素铜与镍的第二电离能分别为 原因是
原因是___________ 。
(5)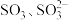 的价层电子对互斥模型为
的价层电子对互斥模型为___________ , 的空间构型不同于
的空间构型不同于 的原因是
的原因是___________ 。
(1)基态Cl原子的原子核外电子运动状态有
(2)已知第四周期有18种元素,根据构造原理,这18种元素基态原子的价层电子最后填入的能级按照能量次序,其名称依次为
(3)尿素分子
 中,C、N的杂化方式分别为:
中,C、N的杂化方式分别为:(4)元素铜与镍的第二电离能分别为
 原因是
原因是(5)
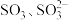 的价层电子对互斥模型为
的价层电子对互斥模型为 的空间构型不同于
的空间构型不同于 的原因是
的原因是
您最近一年使用:0次
名校
2 . 下列说法不正确的是
| A.利用红外光谱可分析分子中含有的化学键或官能团的信息 |
| B.用质谱法可测定分子的相对分子质量 |
C.可利用价层电子对互斥模型分析 和 和 空间结构 空间结构 |
| D.氧原子的基态原子最外层轨道表示式中不需要考虑洪特规则 |
您最近一年使用:0次
2024-02-01更新
|
216次组卷
|
3卷引用:浙江省绍兴市柯桥区2023-2024学年高二上学期期末教学质量调测化学试题
浙江省绍兴市柯桥区2023-2024学年高二上学期期末教学质量调测化学试题陕西省宝鸡中学2023-2024学年高二下学期阶段考试(一)化学试题 (已下线)2.2.1 分子结构的测定和多样性、价层电子对互斥模型课堂例题
3 . 下列粒子的VSEPR模型为四面体且其空间结构为三角锥形的是
A. | B. | C. | D. |
您最近一年使用:0次
名校
解题方法
4 . 同一周期主族元素W、Z、X、Y原子序数依次增大,X原子的最外层电子数是W原子的次外层电子数的3倍,由四种元素原子形成的阴离子结构如图,下列说法正确的是
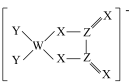
| A.Z位于元素周期表第2周期ⅥA族 | B.以W为中心原子形成的VSEPR模型为平面三角形 |
| C.该阴离子中含有配位键 | D.最高价氧化物对应水化物的酸性:Y>Z>W |
您最近一年使用:0次
2024-02-01更新
|
223次组卷
|
3卷引用:山东省德州市2023-2024学年高二上学期期末考试化学试题
解题方法
5 . 磷酸铁锂电池是以磷酸铁锂(LiFePO4)为正极材料的锂离子电池,具有循环寿命长、安全性能好、无环境污染等特点。
(1)磷酸铁锂具有橄榄石结构,空间骨架结构不易发生形变,化学性质稳定。
①基态 的价层电子排布式为
的价层电子排布式为_______ 。
②Li、P、O三种元素的电负性由大到小的顺序是_______ 。
(2)硫酸亚铁(FeSO4)可用于制备磷酸铁锂。
①根据价层电子对互斥理论可知, 的空间结构为
的空间结构为_______ 。
②比较S原子和O原子的第一电离能大小,并从原子结构的角度说明理由:_______ 。
(3)草酸亚铁(FeC2O4)也可用于制备磷酸铁锂。草酸根离子的结构简式为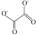 ,其中碳原子的杂化轨道类型为
,其中碳原子的杂化轨道类型为_______ 。
(4)磷酸铁(FePO4)与磷酸铁锂结构相似,其中 围绕
围绕 和
和 分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。充放电过程中,
分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。充放电过程中,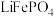 中的
中的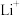 会不断脱嵌或嵌入链之间的孔道内,其结构变化如图所示。
会不断脱嵌或嵌入链之间的孔道内,其结构变化如图所示。
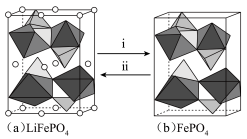
①i表示_______ (填“充电”或“放电”)过程。
②已知Li+的脱嵌率= 。某时刻,若正极材料中Li+的脱嵌率为
。某时刻,若正极材料中Li+的脱嵌率为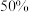 ,则其中
,则其中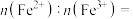
_______ 。
(1)磷酸铁锂具有橄榄石结构,空间骨架结构不易发生形变,化学性质稳定。
①基态
 的价层电子排布式为
的价层电子排布式为②Li、P、O三种元素的电负性由大到小的顺序是
(2)硫酸亚铁(FeSO4)可用于制备磷酸铁锂。
①根据价层电子对互斥理论可知,
 的空间结构为
的空间结构为②比较S原子和O原子的第一电离能大小,并从原子结构的角度说明理由:
(3)草酸亚铁(FeC2O4)也可用于制备磷酸铁锂。草酸根离子的结构简式为
 ,其中碳原子的杂化轨道类型为
,其中碳原子的杂化轨道类型为(4)磷酸铁(FePO4)与磷酸铁锂结构相似,其中
 围绕
围绕 和
和 分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。充放电过程中,
分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。充放电过程中,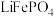 中的
中的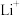 会不断脱嵌或嵌入链之间的孔道内,其结构变化如图所示。
会不断脱嵌或嵌入链之间的孔道内,其结构变化如图所示。
①i表示
②已知Li+的脱嵌率=
 。某时刻,若正极材料中Li+的脱嵌率为
。某时刻,若正极材料中Li+的脱嵌率为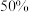 ,则其中
,则其中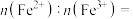
您最近一年使用:0次
名校
解题方法
6 . 下列各组物质中,都是由极性键构成的极性分子的是
| A.PCl3和NCl3 | B.BeCl2(g)和HCl | C.NH3和BH3 | D.CO2和SO2 |
您最近一年使用:0次
2024-01-20更新
|
363次组卷
|
7卷引用:广东省深圳市盐田高级中学2023-2024学年高二上学期1月期末化学试题
名校
7 . Ⅰ.硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______ ,基态S原子电子占据最高能级的电子云轮廓图为______ 形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同其他分子的是______ 。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为______ 。
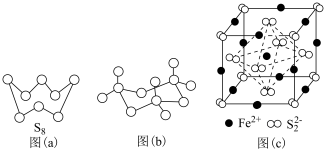
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为______ 形,其中共价键的类型有______ 种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为______
Ⅱ.
(5)气态氢化物热稳定性HF大于HCl的主要原因是______ 。
(6)CaCN2是离子化合物。各原子均满足8电子稳定结构,CaCN2的电子式是______ 。
(7)常温下,在水中的溶解度乙醇大于氯乙烷,原因是______ 。
Ⅲ.
(8)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4.常温常压下SnCl4为无色液体,SnCl4空间构型为______ 。
(9)NH3、PH3、AsH3的沸点由高到低的顺序为______ (填化学式。下同)。还原性由强到弱的顺序为______ 。键角由大到小的顺序为______ 。
| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同其他分子的是
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为
Ⅱ.
(5)气态氢化物热稳定性HF大于HCl的主要原因是
(6)CaCN2是离子化合物。各原子均满足8电子稳定结构,CaCN2的电子式是
(7)常温下,在水中的溶解度乙醇大于氯乙烷,原因是
Ⅲ.
(8)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4.常温常压下SnCl4为无色液体,SnCl4空间构型为
(9)NH3、PH3、AsH3的沸点由高到低的顺序为
您最近一年使用:0次
2024-01-15更新
|
149次组卷
|
2卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高二上学期12月月考化学试题
名校
8 . 锂一磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备: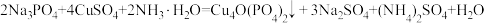 。回答下列问题:
。回答下列问题:
(1)铜位于周期表中_____ 区,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有_____ (填元素符号)。
(2)上述方程式中涉及的N、O、P、S元素第一电离能由小到大的顺序为________ ,电负性由小到大的顺序为______ 。
(3)常见含硫的微粒有SO2、SO3、 等,
等, 的空间构型为
的空间构型为________ ;SO2、SO3杂化轨道类型相同,但键角SO3大于SO2,原因是_______ 。
(4)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则[Cu(CN)4]2-中σ键与π键的数目之比为_______ 。
(5)铜的晶胞结构如图所示。
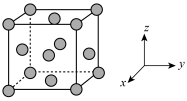
①铜晶胞在x轴方向的投影图是_____ (填标号)。
A.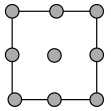 B.
B. 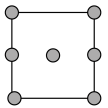
C.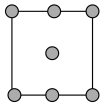 D.
D. 
②假设铜晶胞参数为anm,铜晶体的密度为bg·cm-3,则铜的相对原子质量为_____ (设NA为阿伏加德罗常数的值,用含a、b、NA的代数式表示)。
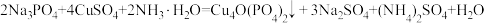 。回答下列问题:
。回答下列问题:(1)铜位于周期表中
(2)上述方程式中涉及的N、O、P、S元素第一电离能由小到大的顺序为
(3)常见含硫的微粒有SO2、SO3、
 等,
等, 的空间构型为
的空间构型为(4)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则[Cu(CN)4]2-中σ键与π键的数目之比为
(5)铜的晶胞结构如图所示。

①铜晶胞在x轴方向的投影图是
A.
 B.
B. 
C.
 D.
D. 
②假设铜晶胞参数为anm,铜晶体的密度为bg·cm-3,则铜的相对原子质量为
您最近一年使用:0次
名校
解题方法
9 . 用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是
A.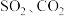 都是直线形的分子 都是直线形的分子 |
B. 键角为 键角为 , , 键角为 键角为 |
C. 都是三角锥形的分子 都是三角锥形的分子 |
D.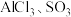 都是平面三角形的粒子 都是平面三角形的粒子 |
您最近一年使用:0次
名校
解题方法
10 . 下列有关 、
、 、
、 的说法正确的是
的说法正确的是
 、
、 、
、 的说法正确的是
的说法正确的是A. 的空间构型为三角锥形 的空间构型为三角锥形 |
B. 键角大于 键角大于 |
C. 极易溶于水的原因是 极易溶于水的原因是 分子间存在氢键 分子间存在氢键 |
D. 与 与 形成的 形成的 中,由 中,由 提供孤电子对形成配位键 提供孤电子对形成配位键 |
您最近一年使用:0次



