名校
解题方法
1 . 下列化学用语或表述错误的是
A.乙烯的球棍模型: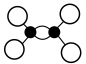 |
B.基态Al原子最高能级的电子云轮廓图: |
C.在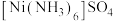 中,阴离子的VSEPR模型名称:正四面体形 中,阴离子的VSEPR模型名称:正四面体形 |
| D.次氯酸钠中含有的化学键类型:极性键、离子键 |
您最近一年使用:0次
2024-04-02更新
|
973次组卷
|
6卷引用:黑龙江省哈尔滨市三校联考2024届高三二模化学试题
黑龙江省哈尔滨市三校联考2024届高三二模化学试题东北三省2024届高三下学期三校二模联考化学试题东北三省2024届高三下学期三校二模联考化学试题(已下线)押题卷01(14+4题型)-2024高考化学考点必杀300题(新高考通用)湖南省长沙市周南中学2024届高三下学期第三次模拟考试化学试题 (已下线)题型2 有关化学用语的正误判断(25题)-2024年高考化学常考点必杀300题(新高考通用)
名校
解题方法
2 . 铁被称为“第一金属”,硫被称为“生命元素”,它们形成的物质种类非常丰富,在生产、生活中用途广泛。
(1)基态S原子有___ 种能量不同的电子,其价电子排布图为___ 。
(2)硫能形成S2O 、SO
、SO 等多种含氧酸根,试推测S2O
等多种含氧酸根,试推测S2O 的空间构型为
的空间构型为___ ,SO 的中心原子杂化方式为
的中心原子杂化方式为___ 。
(3)SCN-与Fe3+能发生显色反应,该反应常用作检验Fe3+的存在。
①铁元素位于元素周期表的___ 区。
②SCN-的三种元素的电负性由大到小的顺序为___ (用元素符号表示)。写出与SCN-互为等电子体的分子的分子式___ (任写一种)。
③Fe(SCN)3中不存在的化学键有___ (填标号)。
A.离子键B.极性键C.非极性键D.配位键E.σ键F.π键
(4)部分卤化铁的熔点如下表所示:
解释表中物质之间熔点差异的原因___ 。
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B两种方块组成。
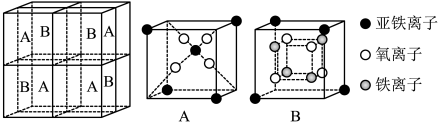
①该氧化物中Fe2+、Fe3+、O2-个数的最简整数比为___ 。
②已知该晶体的密度为dg·cm-3,阿伏加 德罗常数的值为NA,则晶胞参数a为___ nm(用含d和NA的代数式表示)。
(1)基态S原子有
(2)硫能形成S2O
 、SO
、SO 等多种含氧酸根,试推测S2O
等多种含氧酸根,试推测S2O 的空间构型为
的空间构型为 的中心原子杂化方式为
的中心原子杂化方式为(3)SCN-与Fe3+能发生显色反应,该反应常用作检验Fe3+的存在。
①铁元素位于元素周期表的
②SCN-的三种元素的电负性由大到小的顺序为
③Fe(SCN)3中不存在的化学键有
A.离子键B.极性键C.非极性键D.配位键E.σ键F.π键
(4)部分卤化铁的熔点如下表所示:
| 卤化铁 | FeF3 | FeCl3 |
| 熔点/℃ | 1100 | 306 |
解释表中物质之间熔点差异的原因
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B两种方块组成。

①该氧化物中Fe2+、Fe3+、O2-个数的最简整数比为
②已知该晶体的密度为dg·cm-3,阿伏加 德罗常数的值为NA,则晶胞参数a为
您最近一年使用:0次
名校
解题方法
3 . I.向蓝色{[Cu(H2O)4]2+}硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色{[Cu(NH3)4]2+}。
(1)H2O和NH3分子中心原子的杂化类型分别为_______ 、______ 。分子中的键角:H2O_______ NH3填(“大于”或“小于’)。原因是______ 。
(2)通过上述实验现象可知,与Cu2+的配位能力:H2O___ NH3(填“大于”或“小于”)。
II.铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4 ( UO2(CO3)3〕等。回答下列问题:
(1)UF4用Mg或Ca还原可得金属铀。基态氟原子的价电子排布图为______ ;
(2)①已知:(NH4)4[UO2(CO3)3]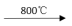 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑,(NH4)4[UO2(CO3)3]存在的微粒间作用力是
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑,(NH4)4[UO2(CO3)3]存在的微粒间作用力是_____ 。
a.离子键 b.共价键 c.配位键 d.金属键
② CO32-的空间构型______ ,写出它的等电子体的化学式(分子、离子各写一种____ 、____ 。
(3)UO2的晶胞结构如下图所示:
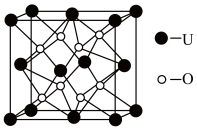
①晶胞中U原子位于面心和顶点,氧原子填充在U原子堆积形成的空隙中,在该空隙中氧原子堆积形成的立体的空间构型为_______ (填“立方体”、“四面体、“八面体”);
②若两个氧原子间的最短距离为a nm,则UD2晶体的密度为______ g·cm-3。(列出含a计算式即可。用NA表示阿伏加 德罗常数的值。)
(1)H2O和NH3分子中心原子的杂化类型分别为
(2)通过上述实验现象可知,与Cu2+的配位能力:H2O
II.铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4 ( UO2(CO3)3〕等。回答下列问题:
(1)UF4用Mg或Ca还原可得金属铀。基态氟原子的价电子排布图为
(2)①已知:(NH4)4[UO2(CO3)3]
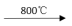 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑,(NH4)4[UO2(CO3)3]存在的微粒间作用力是
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑,(NH4)4[UO2(CO3)3]存在的微粒间作用力是a.离子键 b.共价键 c.配位键 d.金属键
② CO32-的空间构型
(3)UO2的晶胞结构如下图所示:

①晶胞中U原子位于面心和顶点,氧原子填充在U原子堆积形成的空隙中,在该空隙中氧原子堆积形成的立体的空间构型为
②若两个氧原子间的最短距离为a nm,则UD2晶体的密度为
您最近一年使用:0次
名校
解题方法
4 . Fe、HCN与K2CO3在一定条件下发生如下反应:
Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为___________________ 。
(2)配合物K4Fe(CN)6的中心离子是____________ ,该离子价电子的基态电子排布图为____________ 。
(3)lmol HCN分子中含有σ键的数目为____________ ,HCN分子中碳原子轨道杂化类型是____________ ,与CN-互为等电子体的阴离子是____________ 。
(4)K2CO3中阴离子的空间构型为____________ ,其中碳原子的价层电子对数为____________ 。
(5)冰的晶体结构模型如图,它的晶胞与金刚石相似,水分子之间以氢键相连接,在一个晶胞有__________ 个氢键,若氢键键长为d nm,则晶体密度(g/cm3)计算式为____________ (用NA表示阿伏加德罗常数的值)。
Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为
(2)配合物K4Fe(CN)6的中心离子是
(3)lmol HCN分子中含有σ键的数目为
(4)K2CO3中阴离子的空间构型为
(5)冰的晶体结构模型如图,它的晶胞与金刚石相似,水分子之间以氢键相连接,在一个晶胞有

您最近一年使用:0次
2017-05-07更新
|
498次组卷
|
4卷引用:黑龙江省哈尔滨师范大学附属中学2017届高三第三次模拟考试化学试题
2010·黑龙江哈尔滨·二模
解题方法
5 . 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)已知BA5为离子化合物,写出其电子式______
(2)B基态原子中能量最高的电子,其电子云在空间有______ 个方向,原子轨道呈______ 形
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
该同学所画的电子排布图违背了______
(4)G位于______ 族______ 区,价电子排布式为______
(5)DE3 中心原子的杂化方式为______ ,用价层电子对互斥理论推测其空间构型为______
(6)检验F元素的方法是______ ,请用原子结构的知识解释产生此现象的原因是______
(7)F元素的晶胞如下图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,F原子的摩尔质量为M,则F原子的半径为______ cm
| A元素的核外电子数和电子层数相等,也是原子半径最小的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是:I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
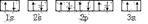
该同学所画的电子排布图违背了
(4)G位于
(5)DE3 中心原子的杂化方式为
(6)检验F元素的方法是
(7)F元素的晶胞如下图所示,若设该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,F原子的摩尔质量为M,则F原子的半径为

您最近一年使用:0次



