解题方法
1 . 回答下列问题。
(1)利用VSEPR模型推断分子或离子的立体构型。
CS2___________ ;AlBr3(共价分子)___________ 。
(2)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:
平面形分子___________ ,三角锥形分子___________ ,四面体形分子___________ 。
(1)利用VSEPR模型推断分子或离子的立体构型。
CS2
(2)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:

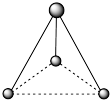
平面形分子
您最近一年使用:0次
解题方法
2 . 根据已学知识,请你回答下列问题:
(1)含有8个质子,10个中子的原子的化学符号___________ 。
(2)最外层电子排布为4s24p1的原子的核电荷数为___________ 。
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是___________ 。
(4)根据VSEPR模型,H3O+的分子立体结构为:___________ 。
(5)周期表中最活泼的非金属元素原子的轨道表示式为___________ 。
(1)含有8个质子,10个中子的原子的化学符号
(2)最外层电子排布为4s24p1的原子的核电荷数为
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是
(4)根据VSEPR模型,H3O+的分子立体结构为:
(5)周期表中最活泼的非金属元素原子的轨道表示式为
您最近一年使用:0次
3 . 完成表中内容。
| σ数 | 孤电子对数 | 杂化方式 | VSEPR模型 | 分子空间构型 | |
| CO2 | |||||
| H2O |
您最近一年使用:0次
2024-02-24更新
|
269次组卷
|
3卷引用:新疆博湖县奇石中学2022-2023学年高二下学期期末考试化学试题
解题方法
4 . 甲醛分子(CH2O)中心原子的价层电子对数为_______ ,该分子呈_______ ;中心原子的杂化类型_______ ,共有_______ σ键,_______ 个π键。
您最近一年使用:0次
21-22高二·全国·课时练习
名校
解题方法
5 . 20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子的空间结构。其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子价层未参与成键的电子对(称为孤电子对), 称为价层电子对数。分子中的价层电子对总是互相排斥,均匀地分布在中心原子周围的空间。
称为价层电子对数。分子中的价层电子对总是互相排斥,均匀地分布在中心原子周围的空间。
Ⅱ、分子的空间结构是指分子中的原子在空间的排布,不包括中心原子未成键的孤电子对。
Ⅲ、分子中价层电子对之间的斥力的主要顺序为:
i、孤电子对之间的斥力>孤电子对与共用电子对之间的斥力>共用电子对之间的斥力;
ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;
iii、X原子得电子能力越弱,A—X形成的共用电子对之间的斥力越强;
iv、其他。
请仔细阅读上述材料,回答下列问题:
(1)由 的
的 模型填写下表:
模型填写下表:
(2)请用 模型解释
模型解释 为直线形分子的原因:
为直线形分子的原因:___________ 。
(3) 分子的空间结构为
分子的空间结构为___________ ,请你预测水分子中 的大小范围并解释原因:
的大小范围并解释原因:___________ 。
(4) 和
和 都属于
都属于 型分子,S、O之间以双键结合,S与
型分子,S、O之间以双键结合,S与 、S与F之间以单键结合。请你预测
、S与F之间以单键结合。请你预测 和
和 分子的空间结构:
分子的空间结构:___________ 。 分子中
分子中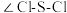
___________ (填“<”“>”或“=”) 分子中
分子中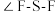 。
。
Ⅰ、用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子价层未参与成键的电子对(称为孤电子对),
 称为价层电子对数。分子中的价层电子对总是互相排斥,均匀地分布在中心原子周围的空间。
称为价层电子对数。分子中的价层电子对总是互相排斥,均匀地分布在中心原子周围的空间。Ⅱ、分子的空间结构是指分子中的原子在空间的排布,不包括中心原子未成键的孤电子对。
Ⅲ、分子中价层电子对之间的斥力的主要顺序为:
i、孤电子对之间的斥力>孤电子对与共用电子对之间的斥力>共用电子对之间的斥力;
ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;
iii、X原子得电子能力越弱,A—X形成的共用电子对之间的斥力越强;
iv、其他。
请仔细阅读上述材料,回答下列问题:
(1)由
 的
的 模型填写下表:
模型填写下表: | 2 | ① |
| VSEPR模型 | ② | 四面体形 |
| 价层电子对之间的键角 | ③ |  |
 模型解释
模型解释 为直线形分子的原因:
为直线形分子的原因:(3)
 分子的空间结构为
分子的空间结构为 的大小范围并解释原因:
的大小范围并解释原因:(4)
 和
和 都属于
都属于 型分子,S、O之间以双键结合,S与
型分子,S、O之间以双键结合,S与 、S与F之间以单键结合。请你预测
、S与F之间以单键结合。请你预测 和
和 分子的空间结构:
分子的空间结构: 分子中
分子中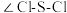
 分子中
分子中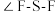 。
。
您最近一年使用:0次
2022-08-28更新
|
530次组卷
|
5卷引用: 新疆生产建设兵团第二师八一中学2022-2023学年高二下学期期中考试化学试题
新疆生产建设兵团第二师八一中学2022-2023学年高二下学期期中考试化学试题(已下线)2.2.1 分子结构的测定 多样的分子空间结构 价层电子对互斥模型-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)2.2.1 分子的空间结构 价层电子对互斥模型(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)(已下线)2.2.1 分子结构的测定和多样性 价层电子对互斥模型-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)第二节 分子的空间结构 第1课时 分子结构的测定 多样的分子空间结构 价层电子对互斥模型
名校
6 . 按要求回答下列问题:
(1)O3分子的VSEPR模型名称为_____ ,分子的立体结构为____ 。
(2)BF3分子的立体结构为_____ ,PCl3分子的立体结构为____ 。
(3)写出基态碳原子的电子排布式:_____ 。
(4)写出基态硫离子的价电子排布式:_____ 。
(5)写出基态铬原子的简化电子排布式:____ 。
(6)写出基态Fe3+的价电子排布图:_____ 。
(1)O3分子的VSEPR模型名称为
(2)BF3分子的立体结构为
(3)写出基态碳原子的电子排布式:
(4)写出基态硫离子的价电子排布式:
(5)写出基态铬原子的简化电子排布式:
(6)写出基态Fe3+的价电子排布图:
您最近一年使用:0次
名校
解题方法
7 . 一项科学研究成果表明,铜锰氧化物(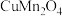 )能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的 和
和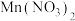 溶液中加入
溶液中加入 溶液,所得沉淀经高温灼烧,可制得
溶液,所得沉淀经高温灼烧,可制得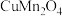 .
.
① 基态的电子排布式可表示为
基态的电子排布式可表示为__________ 。
② 的空间构型是
的空间构型是__________ (用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为 ,HCHO被氧化为
,HCHO被氧化为 和
和 ,
,
① 分子中O原子轨道的杂化类型为
分子中O原子轨道的杂化类型为__________ 。
②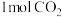 中含有的
中含有的 键数目为
键数目为__________ 。
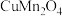 )能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。(1)向一定物质的量浓度的
 和
和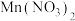 溶液中加入
溶液中加入 溶液,所得沉淀经高温灼烧,可制得
溶液,所得沉淀经高温灼烧,可制得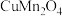 .
.①
 基态的电子排布式可表示为
基态的电子排布式可表示为②
 的空间构型是
的空间构型是(2)在铜锰氧化物的催化下,CO被氧化为
 ,HCHO被氧化为
,HCHO被氧化为 和
和 ,
,①
 分子中O原子轨道的杂化类型为
分子中O原子轨道的杂化类型为②
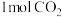 中含有的
中含有的 键数目为
键数目为
您最近一年使用:0次
2020-11-17更新
|
772次组卷
|
3卷引用:新疆生产建设兵团第四师第一中学2019-2020学年高二下学期期中考试化学试题
新疆生产建设兵团第四师第一中学2019-2020学年高二下学期期中考试化学试题(已下线)易错26 共价键的类型-备战2021年高考化学一轮复习易错题(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构
8 . 根据要求完成下列问题:
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:该元素核外价电子排布图___ ,电子排布式_____ 。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:____ 、____ 、____ 。
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子。____
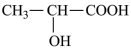
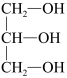
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)____ 。
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4____ H2SO3;HClO3____ HClO4;H3PO4___ H3PO3。
(6)根据价层电子对互斥理论判断下列问题:
NH3中心原子的杂化方式为___ 杂化,VSEPR构型为__ ,分子的立体构型为____ 。
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于____ 。
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:该元素核外价电子排布图
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子。

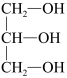
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4
(6)根据价层电子对互斥理论判断下列问题:
NH3中心原子的杂化方式为
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于
您最近一年使用:0次
9 . 根据价层电子对互斥理论填空:
(1)OF2分子中,中心原子上的σ键电子对数为___ ,孤电子对数为___ ,价层电子对数为___ ,中心原子的杂化方式为___ 杂化,VSEPR构型为____________ ,分子的立体构型为___________ 。
(2)BF3分子中,中心原子上的σ键电子对数为___ ,孤电子对数为___ ,价层电子对数为___ ,中心原子的杂化方式为___ 杂化,VSEPR构型为____________ ,分子的立体构型为___________ 。
(3)SO42-分子中,中心原子上的σ键电子对数为___ ,孤电子对数为___ ,价层电子对数为___ ,中心原子的杂化方式为___ 杂化,VSEPR构型为____________ ,分子的立体构型为___________ 。
(1)OF2分子中,中心原子上的σ键电子对数为
(2)BF3分子中,中心原子上的σ键电子对数为
(3)SO42-分子中,中心原子上的σ键电子对数为
您最近一年使用:0次
2019-08-13更新
|
995次组卷
|
4卷引用:新疆疏勒八一中2018-2019学年高二4月月考化学试题
新疆疏勒八一中2018-2019学年高二4月月考化学试题(已下线)易错27 分子的立体结构-备战2021年高考化学一轮复习易错题第二章 分子结构与性质(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)(已下线)第4讲 空间构型
10 . 下表中实线是元素周期表的部分边界,其中上边界并未用实线画出。
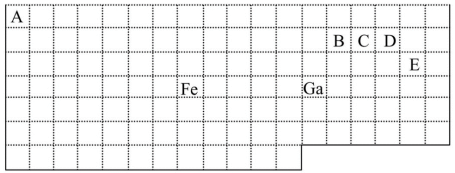
根据信息回答下列问题:
(1)基态Ga原子的最外层电子排布式为_________________ 。
(2)铁元素位于元素周期表的________ 区;Fe和CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为__________ 。
(3)已知:原子数目和价电子总数均相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO互为等电子体的分子和离子分别为_______ 和______ (填化学式)。
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有__________ 。
(5)根据VSEPR模型预测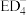 的空间构型为
的空间构型为__________ 。

根据信息回答下列问题:
(1)基态Ga原子的最外层电子排布式为
(2)铁元素位于元素周期表的
(3)已知:原子数目和价电子总数均相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO互为等电子体的分子和离子分别为
(4)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有
(5)根据VSEPR模型预测
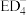 的空间构型为
的空间构型为
您最近一年使用:0次
2017-07-08更新
|
161次组卷
|
2卷引用:新疆呼图壁县第一中学2016-2017学年高二下学期期末考试化学试题



