1 . 现有四种短周期元素A、B、C、D。已知:①C、D位于同一周期,A、B位于同一主族;②四种元素可以组成化合物 、
、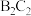 、
、 、
、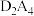 等;③B的简单阳离子与C的简单阴离子的核外电子排布相同;④
等;③B的简单阳离子与C的简单阴离子的核外电子排布相同;④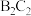 与
与 或
或 反应均能生成气体
反应均能生成气体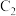 ,B的单质与
,B的单质与 反应可生成气体
反应可生成气体 ,气体
,气体 与气体
与气体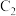 混合后点燃的产物在常温常压下是一种常见的无色无味的液体。请回答下列问题:
混合后点燃的产物在常温常压下是一种常见的无色无味的液体。请回答下列问题:
(1)写出下列元素的符号:A_______ 、B_______ 、C_______ 、D_______ 。
(2)在化合物 、
、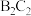 、
、 和
和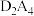 中,既含有离子键又含有非极性共价键的化合物的电子式为
中,既含有离子键又含有非极性共价键的化合物的电子式为_______ ,按原子轨道重叠方式,其非极性键的类型是_______ σ键;化合物分子中键角为180°的是_______ (填化学式),其结构式是_______ 。
(3) 分子的空间结构是
分子的空间结构是_______ 形,其键角_______ (填“>”“<”或“=”)180°;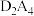 是平面形分子,其分子中含有
是平面形分子,其分子中含有_______ 个σ键,_______ 个π键。
 、
、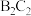 、
、 、
、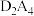 等;③B的简单阳离子与C的简单阴离子的核外电子排布相同;④
等;③B的简单阳离子与C的简单阴离子的核外电子排布相同;④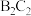 与
与 或
或 反应均能生成气体
反应均能生成气体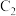 ,B的单质与
,B的单质与 反应可生成气体
反应可生成气体 ,气体
,气体 与气体
与气体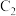 混合后点燃的产物在常温常压下是一种常见的无色无味的液体。请回答下列问题:
混合后点燃的产物在常温常压下是一种常见的无色无味的液体。请回答下列问题:(1)写出下列元素的符号:A
(2)在化合物
 、
、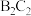 、
、 和
和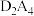 中,既含有离子键又含有非极性共价键的化合物的电子式为
中,既含有离子键又含有非极性共价键的化合物的电子式为(3)
 分子的空间结构是
分子的空间结构是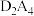 是平面形分子,其分子中含有
是平面形分子,其分子中含有
您最近一年使用:0次
2 . 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两种元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D四种元素电负性由大到小排列顺序为_____________________ 。
(2)B的氢化物的结构式_____________ ,其空间构型为_________________________ 。
(3)E核外电子排布式是_________ ,E的某种化合物的结构如下图所示。
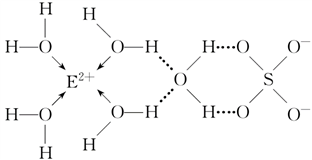
微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有___________ 。
(4)A与B的气态氢化物的沸点______ 更高,A与D的气态氢化物的沸点________ 更高。
(5)A的稳定氧化物中,中心原子的杂化类型为______ ,空间构型为______ 。
(1)A、B、C、D四种元素电负性由大到小排列顺序为
(2)B的氢化物的结构式
(3)E核外电子排布式是

微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有
(4)A与B的气态氢化物的沸点
(5)A的稳定氧化物中,中心原子的杂化类型为
您最近一年使用:0次
2018-02-10更新
|
1021次组卷
|
6卷引用:山西省怀仁市大地学校2020-2021学年高二下学期第三次月考化学试题
山西省怀仁市大地学校2020-2021学年高二下学期第三次月考化学试题人教版2017-2018学年高二化学选修三同步训练:第二章 分子结构与性质(人教版2019)选择性必修2 模块综合测评(已下线)模块同步卷07 第二章综合检测-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)四川省安岳县兴隆中学高2021-2022学年 高二上学期10月月考化学试题 贵州省凯里学院附属中学2021-2022学年高二下学期3月月考化学试题
解题方法
3 . A、B、X、Y、Z、R、Q为前四周期元素,且原子序数依次增大。A是所有元素中原子半径最小的;B的核外电子排布式为ls22s22p2;X原子单电子数在同周期元素中最多;Y与X同周期,第一电离能比X的低;Z的M层电子数是K层电子数的2倍;R与Y同主族;Q的最外层只有一个电子,其它电子层电子均处于饱和状态。
回答下列问题:
(1)Q+的核外电子排布式为______ ,Z的价电子轨道表达式(价电子排布图)为_______ 。
(2)化合物XA3中X原子的杂化方式为______ ;A3Y+的立体构型为______ 。
(3)① B、Z的最高价氧化物的沸点较高的是______ (填化学式),原因是______ 。
② Y与R的简单氢化物中Y的熔沸点更高,原因是______ 。
(4)向Q元素的硫酸盐溶液中通入足量XA3,充分反应后溶液呈深蓝色,该反应的离子方程式为______ 。
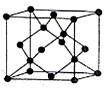
(5)B有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞中B原子数为______ ,B原子的配位数为______ ,若晶胞的边长为apm,晶体的密度为ρg/cm3,则阿伏伽德罗常数为______ (用含a和p的式子表示)。
回答下列问题:
(1)Q+的核外电子排布式为
(2)化合物XA3中X原子的杂化方式为
(3)① B、Z的最高价氧化物的沸点较高的是
② Y与R的简单氢化物中Y的熔沸点更高,原因是
(4)向Q元素的硫酸盐溶液中通入足量XA3,充分反应后溶液呈深蓝色,该反应的离子方程式为
(5)B有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞中B原子数为

您最近一年使用:0次
真题
名校
4 . M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。请回答下列问题:
(1)R基态原子的电子排布式是_____ ,X和Y中电负性较大的是__ (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是___________ 。
(3)X与M形成的XM3分子的空间构型是__________ 。
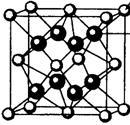
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是_________ (填离子符号)。
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是____________ 。
(1)R基态原子的电子排布式是
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是
(3)X与M形成的XM3分子的空间构型是
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如图所示,则图中黑球代表的离子是

(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是
您最近一年使用:0次
2016-12-09更新
|
887次组卷
|
10卷引用:2017届山西省重点中学协作体高三暑假第一次联考化学试卷
2017届山西省重点中学协作体高三暑假第一次联考化学试卷2016年全国普通高等学校招生统一考试化学(四川卷精编版)2015-2016学年黑龙江哈尔滨六中高二下期末化学试卷贵州省遵义市2017届高三上学期第二次联考理综化学试题河北省秦皇岛市卢龙县2016-2017学年高二下学期期末考试化学试题甘肃省张掖市民乐县第一中学2019届高三上学期10月月考化学试题河北省石家庄市第二中学2020届高中毕业班二月份网络教学质量监测卷理科综合化学部分河南省郑州市第一中学2020年高中毕业班教学质量监测卷理科综合化学试题福建省莆田市第一中学2021-2022学年高二下学期期末考试化学试题(已下线)2016年全国普通高等学校招生统一考试化学(四川卷参考版)



