1 . 钛和钛的化合物在航天、化工、建筑、日常生活中都有着广泛的用途。请回答下列问题:
(1)钛在周期表中的位置是___________ 。
(2)钛的一种常见化合物是[Ti(H2O)6]Cl3,1mol该物质中含有σ键的数目为___________ NA,配体H2O的VSEPR模型是___________ 。
(3)常温下,TiCl4是易溶于CCl4.易挥发的无色液体。TiCl4挥发过程中破坏的作用力类型是___________ 。
(4)已知:TiCl4(g)+O2(g)⇌TiO2(s)+2Cl2(g) ΔH1=-175.4kJ·mol-1 I
2C(s)+O2(g)⇌2CO(g) ΔH2=-220.9kJ·mol-1 Ⅱ
①TiCl4(g)与CO(g)反应生成TiO2(s)、C(s)和氯气的热化学方程式为___________ 。升高温度对该反应的影响为___________ 。
②t℃时,向10L恒容密闭容器中充入1molTiCl4和2molO2发生反应I.5min时达到平衡,测得TiO2的物质的量为0.2mol。0~5min内,用Cl2表示的反应速率v(Cl2)=___________ ,TiCl4的平衡转化率为___________ 。
(5)氮化钛(TiN)晶体呈金黄色,化学稳定性好,可应用于超导材料。已知氮化钛晶体结构与NaCl相同,则该晶体中阳离子的配位数为___________ 。已知该晶体的晶胞参数为423.5pm,其晶体密度为___________ g/cm3(写出表达式即可)。
(1)钛在周期表中的位置是
(2)钛的一种常见化合物是[Ti(H2O)6]Cl3,1mol该物质中含有σ键的数目为
(3)常温下,TiCl4是易溶于CCl4.易挥发的无色液体。TiCl4挥发过程中破坏的作用力类型是
(4)已知:TiCl4(g)+O2(g)⇌TiO2(s)+2Cl2(g) ΔH1=-175.4kJ·mol-1 I
2C(s)+O2(g)⇌2CO(g) ΔH2=-220.9kJ·mol-1 Ⅱ
①TiCl4(g)与CO(g)反应生成TiO2(s)、C(s)和氯气的热化学方程式为
②t℃时,向10L恒容密闭容器中充入1molTiCl4和2molO2发生反应I.5min时达到平衡,测得TiO2的物质的量为0.2mol。0~5min内,用Cl2表示的反应速率v(Cl2)=
(5)氮化钛(TiN)晶体呈金黄色,化学稳定性好,可应用于超导材料。已知氮化钛晶体结构与NaCl相同,则该晶体中阳离子的配位数为
您最近一年使用:0次
2 . 现有四种短周期元素A、B、C、D。已知:①C、D位于同一周期,A、B位于同一主族;②四种元素可以组成化合物 、
、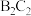 、
、 、
、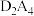 等;③B的简单阳离子与C的简单阴离子的核外电子排布相同;④
等;③B的简单阳离子与C的简单阴离子的核外电子排布相同;④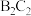 与
与 或
或 反应均能生成气体
反应均能生成气体 ,B的单质与
,B的单质与 反应可生成气体
反应可生成气体 ,气体
,气体 与气体
与气体 混合后点燃的产物在常温常压下是一种常见的无色无味的液体。请回答下列问题:
混合后点燃的产物在常温常压下是一种常见的无色无味的液体。请回答下列问题:
(1)写出下列元素的符号:A_______ 、B_______ 、C_______ 、D_______ 。
(2)在化合物 、
、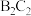 、
、 和
和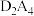 中,既含有离子键又含有非极性共价键的化合物的电子式为
中,既含有离子键又含有非极性共价键的化合物的电子式为_______ ,按原子轨道重叠方式,其非极性键的类型是_______ σ键;化合物分子中键角为180°的是_______ (填化学式),其结构式是_______ 。
(3) 分子的空间结构是
分子的空间结构是_______ 形,其键角_______ (填“>”“<”或“=”)180°;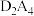 是平面形分子,其分子中含有
是平面形分子,其分子中含有_______ 个σ键,_______ 个π键。
 、
、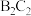 、
、 、
、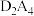 等;③B的简单阳离子与C的简单阴离子的核外电子排布相同;④
等;③B的简单阳离子与C的简单阴离子的核外电子排布相同;④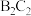 与
与 或
或 反应均能生成气体
反应均能生成气体 ,B的单质与
,B的单质与 反应可生成气体
反应可生成气体 ,气体
,气体 与气体
与气体 混合后点燃的产物在常温常压下是一种常见的无色无味的液体。请回答下列问题:
混合后点燃的产物在常温常压下是一种常见的无色无味的液体。请回答下列问题:(1)写出下列元素的符号:A
(2)在化合物
 、
、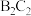 、
、 和
和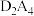 中,既含有离子键又含有非极性共价键的化合物的电子式为
中,既含有离子键又含有非极性共价键的化合物的电子式为(3)
 分子的空间结构是
分子的空间结构是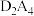 是平面形分子,其分子中含有
是平面形分子,其分子中含有
您最近一年使用:0次
解题方法
3 . TIC、TiN、MnS、MnSe在电化学领域均有巨大的应用潜力。回答下列问题:
(1)基态Ti2+和Mn2+中未成对电子数之比为_______ ;N、S、Mn的第一电离能由大到小的顺序为_______ 。
(2)键能:H—S_______ H—Se(填“>”或“<"),理由为_______ 。
(3)C3N4的硬度可以和金刚石媲美,其中N原子的杂化方式为_______ 。
(4)SeO2的VSEPR模型为_______ 。
(5)H2S2O8是一种强氧化剂,可看作两个H2SO4分子通过形成过氧键结合而成。1molH2S2O8中σ键的数目为_______ 。
(6)MnSe具有NaCl型结构,其立方晶胞结构如图1所示。
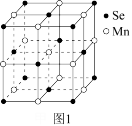
①MnSe晶体可以看成是由Se原子堆成的正八面体中空隙被Mn原子填充,填充率为_______ 。
②图2所示单元不是MnSe的晶胞单元,原因为_______ 。

③若阿伏加德罗常数的值为NA,晶体密度为ρg·cm-3,则该晶体中Se原子与Mn原子之间最短距离为_______ pm。
(1)基态Ti2+和Mn2+中未成对电子数之比为
(2)键能:H—S
(3)C3N4的硬度可以和金刚石媲美,其中N原子的杂化方式为
(4)SeO2的VSEPR模型为
(5)H2S2O8是一种强氧化剂,可看作两个H2SO4分子通过形成过氧键结合而成。1molH2S2O8中σ键的数目为
(6)MnSe具有NaCl型结构,其立方晶胞结构如图1所示。

①MnSe晶体可以看成是由Se原子堆成的正八面体中空隙被Mn原子填充,填充率为
②图2所示单元不是MnSe的晶胞单元,原因为

③若阿伏加德罗常数的值为NA,晶体密度为ρg·cm-3,则该晶体中Se原子与Mn原子之间最短距离为
您最近一年使用:0次
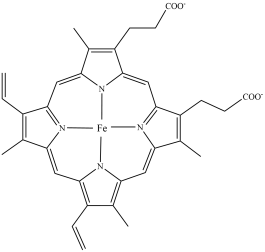
4 . 近年,我国科学家通过热磷化法制备出了电催化分解水的催化剂Co-Fe-P和Ni-Fe-P等过渡金属磷化物,将推动电解水制氢技术的快速发展。回答下列问题:
(1)铁元素在元素周期表中的位置_______ ,Fe3+的价电子排布式_______ 。
(2)磷的一些卤化物的熔沸点如表所示,试解释PF3、PCl3、PBr3、PI3熔沸点逐渐升高的原因_______
(3)磷酸具有很强的配位能力,PO 的中心原子杂化类型为
的中心原子杂化类型为_______ ,写出与PO 互为等电子体的一种分子
互为等电子体的一种分子_______
(4)钴的配合物种类很多,如[Co(NO2)(NH3)5]Cl2和[Co(NH3)4Cl2]Cl等,[Co(NO2)(NH3)5]2+的配位数是_______ ,其配体中的NH3的分子空间构型为_______ ;等物质的量的[Co(NO2)(NH3)5]Cl2和[Co(NH3)4Cl2]Cl分别与足量的硝酸银溶液反应,两者生成氯化银的质量比为_______ 。
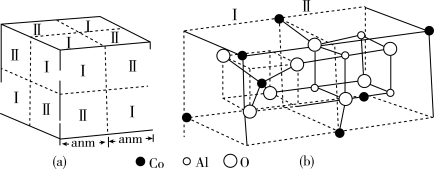
(5)钴蓝晶体结构如图(a)所示,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成,求晶体的化学式为_______ ,密度为_______ g·cm-3。
(1)铁元素在元素周期表中的位置
(2)磷的一些卤化物的熔沸点如表所示,试解释PF3、PCl3、PBr3、PI3熔沸点逐渐升高的原因
| 卤化磷 | 熔点/K | 沸点/K |
| PF3 | 121.5 | 171.5 |
| PCl3 | 161 | 348.5 |
| PBr3 | 233 | 451.2 |
| PI3 | 334 | 573 |
 的中心原子杂化类型为
的中心原子杂化类型为 互为等电子体的一种分子
互为等电子体的一种分子(4)钴的配合物种类很多,如[Co(NO2)(NH3)5]Cl2和[Co(NH3)4Cl2]Cl等,[Co(NO2)(NH3)5]2+的配位数是
(5)钴蓝晶体结构如图(a)所示,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成,求晶体的化学式为

您最近一年使用:0次
5 . 已知W、X、Y、Z、N是周期表中前四周期元素,它们的核电荷数依次增大。
回答下列问题:
(1)X对应单质的化学式为_______ ,基态Y原子核外电子排布式为_______ 。
(2)X、Y、Z任意两种元素形成的化合物之间发生氧化还原反应的化学方程式为_______ 。
(3)上述五种元素中第一电离能最小的是_______ (填元素符号,下同);W、X、Z三种元素的电负性由大到小的顺序为_______ 。
(4)N2X与N2Z的熔点更高的是_______ 。(填化学式),原因是_______ 。
(5)ZX 和ZX
和ZX 中键角较小的是
中键角较小的是_______ (用离子符号表示),原因是_______ 。
| 元素 | 元素性质或原子结构或离子结构 |
| W | 原子核内无中子 |
| X | 基态原子核外s能级上的电子总数与p能级上的电子总数相等 |
| Y | 元素的原子半径在同周期中最大 |
| Z | 基态原子核外有9种不同空间运动状态的电子,且有2个未成对电子 |
| N | N+的M层全充满 |
(1)X对应单质的化学式为
(2)X、Y、Z任意两种元素形成的化合物之间发生氧化还原反应的化学方程式为
(3)上述五种元素中第一电离能最小的是
(4)N2X与N2Z的熔点更高的是
(5)ZX
 和ZX
和ZX 中键角较小的是
中键角较小的是
您最近一年使用:0次
名校
解题方法
6 . 碳和硅是自然界中大量存在的元素,硅及其化合物是工业上最重要的材料。设NA代表阿伏加德罗常数的值。粗硅的制备方法有两种:
方法一:
方法二:
(1)基态Si原子中存在_______ 对自旋状态相反的电子,基态Mg原子的最外层电子的电子云轮廓图是_______ 。
(2)上述2个反应中,涉及的所有元素中第一电离能最小的_______ (填元素符号)。
(3)C (金刚石)、晶体硅、CO三种晶体的熔点由高到低的顺序_______ ,其原因是_______ 。
(4)CO在配合物中可作为配体,在 配合物中配位原子是
配合物中配位原子是_______ (填元素符号),1 mol该配合物中含有π键的数目是_______ 。
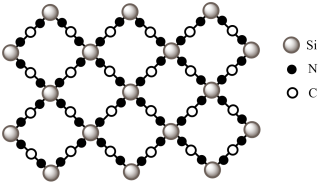
(5)SiO2晶胞(如图1)可理解成将金刚石晶胞(如图2)中的C原子置换成Si原子,然后在Si—Si键中间插入O原子而形成。
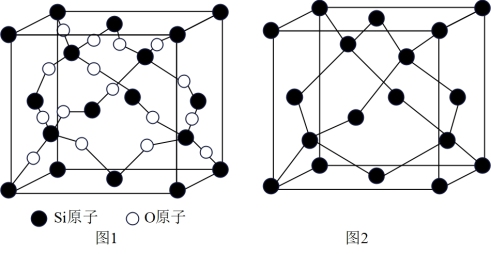
①SiO2晶胞中Si采取_______ 杂化,含有_______ 个O原子。
②SiO2晶胞中假设金刚石晶胞的边长为a pm,试计算该晶胞的密度_______  (写出表达式即可)
(写出表达式即可)
方法一:

方法二:

(1)基态Si原子中存在
(2)上述2个反应中,涉及的所有元素中第一电离能最小的
(3)C (金刚石)、晶体硅、CO三种晶体的熔点由高到低的顺序
(4)CO在配合物中可作为配体,在
 配合物中配位原子是
配合物中配位原子是(5)SiO2晶胞(如图1)可理解成将金刚石晶胞(如图2)中的C原子置换成Si原子,然后在Si—Si键中间插入O原子而形成。

①SiO2晶胞中Si采取
②SiO2晶胞中假设金刚石晶胞的边长为a pm,试计算该晶胞的密度
 (写出表达式即可)
(写出表达式即可)
您最近一年使用:0次
2022-04-16更新
|
78次组卷
|
2卷引用:山西省晋中市祁县中学2021-2022学年高二下学期4月月考化学试题(A卷)
名校
7 . 心是用来碎的,周期表是用来背的,X、Y、Z、W、E、F是元素周期表中前四周期元素,原子序数依次增大,结合表中所给信息,请回答下列问题。
(1)ZX 的空间构型为
的空间构型为_______ ,ZX3的VSEPR模型为_______ ,ZX3极易溶于水的原因是_______ ;
(2)X、Y、Z、W四种元素中第一电离能最大的是_______ ,电负性最大的是_______ (填元素符号);
(3)YW和Z2的结构相似,在YW分子中,Y与W之间形成_______ 个σ键_______ 个π键;
(4)E元素位于周期表的_______ 区,原子的价层电子排布式为_______ ;
(5)F2+在水溶液中呈蓝色是因为形成了水合铜离子,其化学式为_______ ,提供孤电子对的是_______ ;
| 原子 | 结构特征 |
| X | 原子核外只有一个质子 |
| Y | 原子中有三个能级,且电子数目相等 |
| Z | 其原子的2p轨道为半充满 |
| W | 其单质之一是极性分子 |
| E | 价电子层有6个电子且均未成对 |
| F | 第29号元素 |
 的空间构型为
的空间构型为(2)X、Y、Z、W四种元素中第一电离能最大的是
(3)YW和Z2的结构相似,在YW分子中,Y与W之间形成
(4)E元素位于周期表的
(5)F2+在水溶液中呈蓝色是因为形成了水合铜离子,其化学式为
您最近一年使用:0次
2022-04-16更新
|
101次组卷
|
2卷引用:山西省晋中市祁县中学2021-2022学年高二下学期4月月考化学试题(B卷)
名校
解题方法
8 . 碳及其化合物在生产生活中有着广泛的应用。回答下列问题:
(1)画出基态碳原子的价电子排布图:_______ 。
(2)1个 分子含有
分子含有_______ 个σ键; 的立体构型为
的立体构型为_______ ,写出一种与 具有相同立体构型的分子:
具有相同立体构型的分子:_______ (填化学式)。
(3)CO易与人体的血红蛋白结合,导致人体供氧不足而出现中毒症状。血红蛋白的局部结构如下图所示。该结构中碳原子的杂化类型为_______ ,配位原子为_______ (填原子符号)。第一电离能: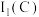
_______  (填“>”或“<”)。
(填“>”或“<”)。
(4)①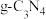 具有和石墨相似的层状结构,其中一种二维平面结构如下图所示,
具有和石墨相似的层状结构,其中一种二维平面结构如下图所示,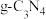 晶体中存在的微粒间作用力不包括
晶体中存在的微粒间作用力不包括_______ (填标号)。

a.非极性键 b.极性键 c.π键 d.范德华力
②用硅原子替换氮化碳的部分碳原子可形成具有相似性质的化合物(如下图所示),该化合物的化学式为_______ 。
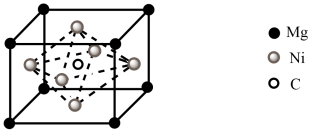
(5)C与Mg、Ni可形成一种新型超导体,其立方晶胞结构如下图所示。已知该晶胞密度为 ,若C、Mg、Ni的原子半径分别为a pm、b pm、c pm,则其原子的空间利用率(即晶胞中原子体积占晶胞体积的百分率)为
,若C、Mg、Ni的原子半径分别为a pm、b pm、c pm,则其原子的空间利用率(即晶胞中原子体积占晶胞体积的百分率)为_______ 。(用含a、b、c、 、
、 的代数式表示,其中
的代数式表示,其中 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(1)画出基态碳原子的价电子排布图:
(2)1个
 分子含有
分子含有 的立体构型为
的立体构型为 具有相同立体构型的分子:
具有相同立体构型的分子:(3)CO易与人体的血红蛋白结合,导致人体供氧不足而出现中毒症状。血红蛋白的局部结构如下图所示。该结构中碳原子的杂化类型为
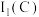
 (填“>”或“<”)。
(填“>”或“<”)。
(4)①
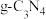 具有和石墨相似的层状结构,其中一种二维平面结构如下图所示,
具有和石墨相似的层状结构,其中一种二维平面结构如下图所示,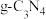 晶体中存在的微粒间作用力不包括
晶体中存在的微粒间作用力不包括
a.非极性键 b.极性键 c.π键 d.范德华力
②用硅原子替换氮化碳的部分碳原子可形成具有相似性质的化合物(如下图所示),该化合物的化学式为

(5)C与Mg、Ni可形成一种新型超导体,其立方晶胞结构如下图所示。已知该晶胞密度为
 ,若C、Mg、Ni的原子半径分别为a pm、b pm、c pm,则其原子的空间利用率(即晶胞中原子体积占晶胞体积的百分率)为
,若C、Mg、Ni的原子半径分别为a pm、b pm、c pm,则其原子的空间利用率(即晶胞中原子体积占晶胞体积的百分率)为 、
、 的代数式表示,其中
的代数式表示,其中 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
2022-03-31更新
|
926次组卷
|
3卷引用:山西省山西大学附属中学校2022届高三5月三模(总第七次)模块诊断考试理综化学试题
解题方法
9 . 周期表中前四周期元素R、W、X、Y、Z的原子序数依次增大。R基态原子中,电子占据的最高能层为L层,最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y原子核外有5种能量不同的电子,且最外层只有一个未成对的电子,该层其它电子均已成对。Z基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)R元素在周期表中的位置为___________ ,Z元素在周期表的___________ 区。
(2)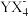 的立体构型是
的立体构型是___________ 。与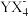 互为等电子体的一种分子为
互为等电子体的一种分子为___________ (填化学式)。
(3)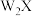 与
与 互为等电子体,且
互为等电子体,且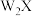 分子中X只与一个W相连,则
分子中X只与一个W相连,则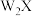 的电子式为
的电子式为___________ ; 易水解生成一种碱性气体和一种具有漂白性的物质。写出该应的化学方程式
易水解生成一种碱性气体和一种具有漂白性的物质。写出该应的化学方程式___________ 。
(4)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。
①该晶体的化学式为___________ 。
②已知该晶体的密度为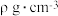 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶胞中立方体的边长为
,则该晶胞中立方体的边长为___________ cm(只写计算式)。

(1)R元素在周期表中的位置为
(2)
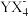 的立体构型是
的立体构型是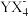 互为等电子体的一种分子为
互为等电子体的一种分子为(3)
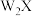 与
与 互为等电子体,且
互为等电子体,且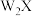 分子中X只与一个W相连,则
分子中X只与一个W相连,则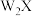 的电子式为
的电子式为 易水解生成一种碱性气体和一种具有漂白性的物质。写出该应的化学方程式
易水解生成一种碱性气体和一种具有漂白性的物质。写出该应的化学方程式(4)某Y与Z形成的化合物的晶胞如图所示(黑点代表Z原子)。
①该晶体的化学式为
②已知该晶体的密度为
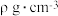 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶胞中立方体的边长为
,则该晶胞中立方体的边长为
您最近一年使用:0次
解题方法
10 . 我国云南镍白铜(铜镍合金)闻名中外,曾主要用于制作仿银饰品和造币。请回答:
(1)铜元素在元素周期表中的位置为______ 。
(2)基态镍原子的价层电子排布式为______ ,未成对的电子数为______ ,位于周期表______ 区。
(3)铜元素的第二电离能为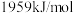 ,镍元素的第二电离能为
,镍元素的第二电离能为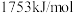 ,铜的第二电离能较大,其主要原因是
,铜的第二电离能较大,其主要原因是______ 。
(4)向硫酸铜溶液逐渐滴加氨水可得到 溶液,
溶液, 中阴离子的立体构型是
中阴离子的立体构型是______ ,NH3中N的杂化方式为______ 。
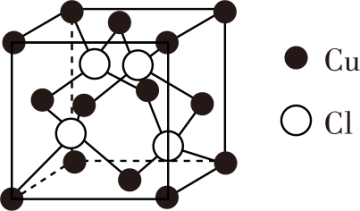
(5)铜原子与氯原子形成化合物的晶胞如下图所示。该晶体的化学式为______ ,每个铜原子周围距离最近的铜原子数目为______ 个。已知该晶体的密度为 ,阿伏加德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为
,阿伏加德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为______ pm(列出计算式即可)。
(1)铜元素在元素周期表中的位置为
(2)基态镍原子的价层电子排布式为
(3)铜元素的第二电离能为
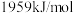 ,镍元素的第二电离能为
,镍元素的第二电离能为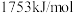 ,铜的第二电离能较大,其主要原因是
,铜的第二电离能较大,其主要原因是(4)向硫酸铜溶液逐渐滴加氨水可得到
 溶液,
溶液, 中阴离子的立体构型是
中阴离子的立体构型是(5)铜原子与氯原子形成化合物的晶胞如下图所示。该晶体的化学式为
 ,阿伏加德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为
,阿伏加德罗常数的值为NA,则该晶体中铜原子和氯原子之间的最短距离为
您最近一年使用:0次



