名校
解题方法
1 . 回答下列问题。
(1)写出基态As原子的简化电子排布式:___________ ,其核外有___________ 种不同空间运动状态的电子。
(2)1 mol [Ni(NH3)6]SO4中σ键的数目为___________ NA。
(3)SCN-中C原子的杂化轨道类型为___________ ,其中含有两个相同的大π键,其形式为___________ (用 表示,n为原子数,m为电子数),检验Fe3+时,SCN-以S原子配位不以N原子配位的原因是
表示,n为原子数,m为电子数),检验Fe3+时,SCN-以S原子配位不以N原子配位的原因是___________ 。
(4)某主族元素的电离能I1~I7数据如表所示(单位:kJ/mol),可推测该元素位于元素周期表第___________ 族。
(5)光气(COCl2)分子中,所有原子均满足8电子稳定结构,其电子式为___________ 。
(6)下列酸中:CF3COOH、CCl3COOH、CHCl2COOH、CH2ClCOOH,酸性最强的是___________ 。
(7)已知:硫代乙酰胺(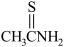 )在酸性溶液中会水解为乙酰胺(
)在酸性溶液中会水解为乙酰胺(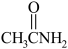 )和硫化氢,硫代乙酰胺比乙酰胺的沸点低,解释其原因为
)和硫化氢,硫代乙酰胺比乙酰胺的沸点低,解释其原因为___________ 。
(8)H3BO3分子中的O-B-O的键角___________ (填“大于”“等于”或“小于”) 中的H-B-H的键角,判断依据是
中的H-B-H的键角,判断依据是___________ 。
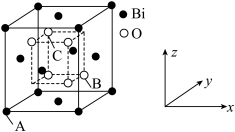
(9)Bi2O3的立方晶胞结构如图所示,以A点为原点建立分数坐标,已知A点坐标为(0,0,0),B点坐标为( ,
, ,
, ),则C点坐标为
),则C点坐标为___________ 。
(1)写出基态As原子的简化电子排布式:
(2)1 mol [Ni(NH3)6]SO4中σ键的数目为
(3)SCN-中C原子的杂化轨道类型为
 表示,n为原子数,m为电子数),检验Fe3+时,SCN-以S原子配位不以N原子配位的原因是
表示,n为原子数,m为电子数),检验Fe3+时,SCN-以S原子配位不以N原子配位的原因是(4)某主族元素的电离能I1~I7数据如表所示(单位:kJ/mol),可推测该元素位于元素周期表第
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 578 | 1817 | 2748 | 11575 | 14830 | 18376 | 23293 |
(5)光气(COCl2)分子中,所有原子均满足8电子稳定结构,其电子式为
(6)下列酸中:CF3COOH、CCl3COOH、CHCl2COOH、CH2ClCOOH,酸性最强的是
(7)已知:硫代乙酰胺(
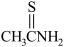 )在酸性溶液中会水解为乙酰胺(
)在酸性溶液中会水解为乙酰胺(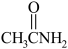 )和硫化氢,硫代乙酰胺比乙酰胺的沸点低,解释其原因为
)和硫化氢,硫代乙酰胺比乙酰胺的沸点低,解释其原因为(8)H3BO3分子中的O-B-O的键角
 中的H-B-H的键角,判断依据是
中的H-B-H的键角,判断依据是(9)Bi2O3的立方晶胞结构如图所示,以A点为原点建立分数坐标,已知A点坐标为(0,0,0),B点坐标为(
 ,
, ,
, ),则C点坐标为
),则C点坐标为
您最近一年使用:0次
名校
解题方法
2 . NaClO2在工业生产中常用作漂白剂、脱色剂、消毒剂、拔染剂等。实验室中可用H2O2和NaOH混合溶液吸收ClO2的方法制取NaClO2,现利用如下装置及试剂制备NaClO2晶体:
已知:①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2气体浓度较大时易发生爆炸。
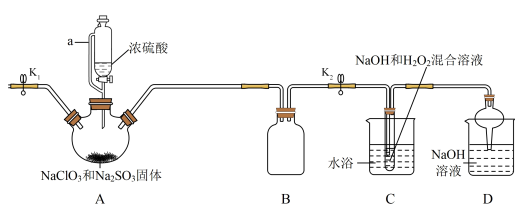
(1)A装置中仪器a的名称为______ 。装置D中NaOH溶液的作用是______ 。
(2)装置A中生成ClO2的化学方程式为______ 。
(3)关于装置C及后续操作的下列说法中,错误的是______ 。
(4)仪器A中NaClO3需稍微过量,原因是______ 。
(5)实验过程中,常需要打开K1,鼓入一定量空气。该操作的目的是______ 。
(6)Cl和O可形成另一种化合物Cl2O,中心原子为O,Cl2O的VSEPR模型是______ ;Cl2O键角比F2O键角______ (填“大”“小”或“相等”)。
(7)NaClO2纯度的测定:用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品1.810g配制成250mL溶液,从中取出25.00mL;加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O =S4O
=S4O +2I-)。样品中NaClO2的纯度为
+2I-)。样品中NaClO2的纯度为______ %(用含c、V的代数式表示)。
已知:①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2气体浓度较大时易发生爆炸。

(1)A装置中仪器a的名称为
(2)装置A中生成ClO2的化学方程式为
(3)关于装置C及后续操作的下列说法中,错误的是
| A.装置C中H2O2作氧化剂 |
| B.为获得NaClO2晶体,可将C试管中的溶液在55℃蒸发浓缩结晶并趁热过滤 |
| C.用50℃左右温水洗涤所得晶体 |
| D.高温烘干过滤后所得滤渣即可得到产物 |
(4)仪器A中NaClO3需稍微过量,原因是
(5)实验过程中,常需要打开K1,鼓入一定量空气。该操作的目的是
(6)Cl和O可形成另一种化合物Cl2O,中心原子为O,Cl2O的VSEPR模型是
(7)NaClO2纯度的测定:用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品1.810g配制成250mL溶液,从中取出25.00mL;加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O =S4O
=S4O +2I-)。样品中NaClO2的纯度为
+2I-)。样品中NaClO2的纯度为
您最近一年使用:0次
2023-10-27更新
|
1096次组卷
|
5卷引用:河北省衡水市武邑中学2023-2024学年高三上学期12月期中考试化学试题
河北省衡水市武邑中学2023-2024学年高三上学期12月期中考试化学试题广西部分高中2024届高三第一次摸底测试化学试题广西南宁市2024届高三上学期毕业班摸底测试化学试题江西省赣州市全南中学2023-2024学年高三上学期11月期中考试化学试题(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
解题方法
3 . 我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、P、Ni、Fe 等元素。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是___________ (填标号,下同),用光谱仪可捕捉到发射光谱的是___________ 。___________ 。
(3)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。___________ 。
②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为___________ 。
③立方相氮化硼晶胞边长为apm, NA代表阿伏加德罗常数的值,则该晶体的密度为___________ g·cm-3。
(4)FeSO4·7H2O的结构如图所示,FeSO4·7H2O中∠1、∠2、∠3由大到小的顺序是___________ 。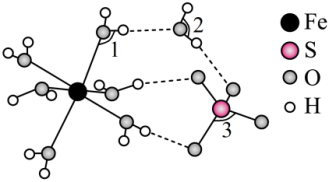
(5)镍的某种氧化物常用作催化剂,其晶胞有如图结构特征:镍离子形成面心立方结构,氧离子填充在镍离子构成的八面体空隙中,填充率为100%。
①从该晶胞中能分割出来的结构图有___________ (填标号)。___________ 个,该距离为___________ pm(用含ρ和NA的代数式表示)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A.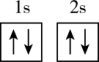 B.
B.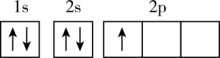 C.
C.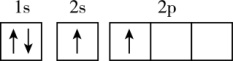 D.
D.
(3)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。

②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为
③立方相氮化硼晶胞边长为apm, NA代表阿伏加德罗常数的值,则该晶体的密度为
(4)FeSO4·7H2O的结构如图所示,FeSO4·7H2O中∠1、∠2、∠3由大到小的顺序是

(5)镍的某种氧化物常用作催化剂,其晶胞有如图结构特征:镍离子形成面心立方结构,氧离子填充在镍离子构成的八面体空隙中,填充率为100%。
①从该晶胞中能分割出来的结构图有
a.  b.
b.  c.
c. d.
d. 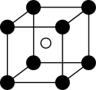 e.
e.
您最近一年使用:0次
2023-07-21更新
|
337次组卷
|
3卷引用:河北省石家庄市第二中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
4 . 三卤化氮( )如
)如 、
、 等有广泛的用途。
等有广泛的用途。 是液晶显示器生产过程中常用的化学清洗剂,
是液晶显示器生产过程中常用的化学清洗剂, 可用于面粉的漂白和杀菌。回答下面问题:
可用于面粉的漂白和杀菌。回答下面问题:
(1)锑是制造液晶显示器的一种原材料,基态锑的价层电子排布式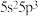 ,可知锑在元素周期表的位置是
,可知锑在元素周期表的位置是___________ 。基态锑原子中有___________ 个未成对电子,这些未成对电子具有___________ (填“相同”或“不同”)的自旋状态。
(2)元素F、O、N位于同一周期,其第一电离能由大到小的顺序是___________ ,原子半径由大到小的顺序是___________ 。
(3)液晶显示器材料因含微量杂质元素铬(Cr)而呈浅红色。基态铬原子的价层电子排布式为___________ 。液晶在放电过程中会产生 和
和 离子,其中N原子的杂化类型分别是
离子,其中N原子的杂化类型分别是___________ ,键角:
___________  (填“<”或“=”或“>”)。
(填“<”或“=”或“>”)。
(4)已知热稳定性 高于
高于 ,解释其原因是
,解释其原因是___________ 。常温常压下 为无色气体,
为无色气体, 为黄色油状液体,
为黄色油状液体, 和
和 价层电子对互斥模型均为
价层电子对互斥模型均为___________ , 和
和 的分子空间构型均为
的分子空间构型均为___________ 。
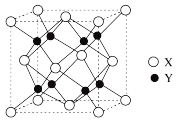
(5) 的晶胞结构如图所示,X代表的离子是
的晶胞结构如图所示,X代表的离子是___________ ;若该立方晶胞参数为apm, 的摩尔质量用
的摩尔质量用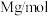 ,阿伏加德罗常数用
,阿伏加德罗常数用 来表示,则
来表示,则 晶体的密度=
晶体的密度=___________  (写出表达式)。
(写出表达式)。
 )如
)如 、
、 等有广泛的用途。
等有广泛的用途。 是液晶显示器生产过程中常用的化学清洗剂,
是液晶显示器生产过程中常用的化学清洗剂, 可用于面粉的漂白和杀菌。回答下面问题:
可用于面粉的漂白和杀菌。回答下面问题:(1)锑是制造液晶显示器的一种原材料,基态锑的价层电子排布式
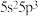 ,可知锑在元素周期表的位置是
,可知锑在元素周期表的位置是(2)元素F、O、N位于同一周期,其第一电离能由大到小的顺序是
(3)液晶显示器材料因含微量杂质元素铬(Cr)而呈浅红色。基态铬原子的价层电子排布式为
 和
和 离子,其中N原子的杂化类型分别是
离子,其中N原子的杂化类型分别是
 (填“<”或“=”或“>”)。
(填“<”或“=”或“>”)。(4)已知热稳定性
 高于
高于 ,解释其原因是
,解释其原因是 为无色气体,
为无色气体, 为黄色油状液体,
为黄色油状液体, 和
和 价层电子对互斥模型均为
价层电子对互斥模型均为 和
和 的分子空间构型均为
的分子空间构型均为(5)
 的晶胞结构如图所示,X代表的离子是
的晶胞结构如图所示,X代表的离子是 的摩尔质量用
的摩尔质量用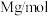 ,阿伏加德罗常数用
,阿伏加德罗常数用 来表示,则
来表示,则 晶体的密度=
晶体的密度= (写出表达式)。
(写出表达式)。
您最近一年使用:0次
2023-05-14更新
|
93次组卷
|
3卷引用:河北省尚义县第一中学2022-2023学年高二下学期第三次阶段测试化学试题
5 . 金属元素Cu、Mn、Co、Ni等在电池、储氢材料、催化剂等方面都有广泛应用。请回答下列问题:
(1)基态Cu原子中,核外电子占据最高能层的符号是_______ 。
(2)原子核外运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,
表示,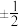 即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为
即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为_______ 。
(3)铜锰氧化物(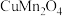 )能在常温下催化氧化甲醛(结构如图)生成甲酸。
)能在常温下催化氧化甲醛(结构如图)生成甲酸。
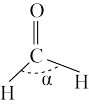
①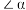
_______ (填“>”、“=”或“<”)120°;从原子轨道重叠方式分类,分子中 键的类型是
键的类型是_______ 。
②气态时,测得甲酸的相对分子质量大于46,其原因可能是_______ 。
(4) 是有机催化剂,其溶液为天蓝色。
是有机催化剂,其溶液为天蓝色。
①使溶液呈现天蓝色的四水合铜离子,其空间构型为平面正方形,则 的杂化轨道类型为
的杂化轨道类型为_______ (填标号)。
A. B.sp C.
B.sp C. D.
D.
② 的空间构型为
的空间构型为_______ ;分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为
中的大π键应表示为_______ 。
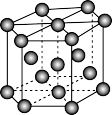
(5)Co晶体堆积方式为六方最密堆积,其晶胞结构如图所示,已知Co的原子半径为r,该晶胞的空间利用率为_______ (晶胞上占有的原子的体积与晶胞体积之比为晶胞的空间利用率,用含π的代数式表示)。
(1)基态Cu原子中,核外电子占据最高能层的符号是
(2)原子核外运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,
表示,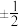 即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为
即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为(3)铜锰氧化物(
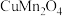 )能在常温下催化氧化甲醛(结构如图)生成甲酸。
)能在常温下催化氧化甲醛(结构如图)生成甲酸。
①
 键的类型是
键的类型是②气态时,测得甲酸的相对分子质量大于46,其原因可能是
(4)
 是有机催化剂,其溶液为天蓝色。
是有机催化剂,其溶液为天蓝色。①使溶液呈现天蓝色的四水合铜离子,其空间构型为平面正方形,则
 的杂化轨道类型为
的杂化轨道类型为A.
 B.sp C.
B.sp C. D.
D.
②
 的空间构型为
的空间构型为 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为
中的大π键应表示为(5)Co晶体堆积方式为六方最密堆积,其晶胞结构如图所示,已知Co的原子半径为r,该晶胞的空间利用率为

您最近一年使用:0次
2022-04-22更新
|
1127次组卷
|
4卷引用:河北省部分学校2022届高三4月份联考化学试题
河北省部分学校2022届高三4月份联考化学试题河北省秦皇岛市2022届高三二模化学试题青海省西宁市大通回族土族自治县2022届高三第二次模拟考试理科综合化学试题(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)
名校
解题方法
6 . 光电材料在能源军事等领域有重要应用,分为无机光电材料如ZnS、ZnSe、GaAs、 等,及有机光电材料(如图1所示化合物)。回答下列问题:
等,及有机光电材料(如图1所示化合物)。回答下列问题:
(1)基态Zn原子的价层电子排布图为_____ ;Ga、As、Se的第一电离能由大到小的顺序为___________ 。
(2)图1所示化合物中所含有的化学键类型有_____ (填选项字母),N原子的杂化方式为_____ 。
A.共价键 B.离子键 C.配位键 D.氢键
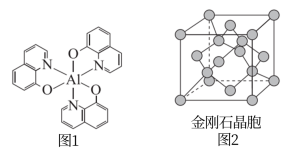
(3)在水溶液中,以 为电子供体,
为电子供体, 在
在 光催化剂上可还原为CO,部分氧化物的沸点如表所示:
光催化剂上可还原为CO,部分氧化物的沸点如表所示:
①表中氧化物之间沸点差异的原因为___________ 。
② 的VSEPR模型为
的VSEPR模型为___________ 。
③ 和
和 分子中,键角更大的是
分子中,键角更大的是___________ 。
(4)ZnS和ZnSe晶体的立方晶胞结构相似,均可看作将金刚石晶胞(如图2)内部的碳原子用Zn代替,晶胞顶角与面心位置的碳原子被S或Se代替。
①ZnS晶体中,Zn原子在S原子围成的正四面体空隙中的占用率为___________ 。
②若阿伏加德罗常数的值为 ,ZnS晶体的密度为
,ZnS晶体的密度为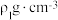 ,ZnSe晶体的密度为
,ZnSe晶体的密度为 ,则ZnS晶体中Zn与S原子最短距离和ZnSe晶体中Zn与Se原子最短距离之比为
,则ZnS晶体中Zn与S原子最短距离和ZnSe晶体中Zn与Se原子最短距离之比为___________ 。
 等,及有机光电材料(如图1所示化合物)。回答下列问题:
等,及有机光电材料(如图1所示化合物)。回答下列问题:(1)基态Zn原子的价层电子排布图为
(2)图1所示化合物中所含有的化学键类型有
A.共价键 B.离子键 C.配位键 D.氢键

(3)在水溶液中,以
 为电子供体,
为电子供体, 在
在 光催化剂上可还原为CO,部分氧化物的沸点如表所示:
光催化剂上可还原为CO,部分氧化物的沸点如表所示:| 氧化物 |  |  |  |
| 沸点/℃ | 100 | -10 | -78.5 |
②
 的VSEPR模型为
的VSEPR模型为③
 和
和 分子中,键角更大的是
分子中,键角更大的是(4)ZnS和ZnSe晶体的立方晶胞结构相似,均可看作将金刚石晶胞(如图2)内部的碳原子用Zn代替,晶胞顶角与面心位置的碳原子被S或Se代替。
①ZnS晶体中,Zn原子在S原子围成的正四面体空隙中的占用率为
②若阿伏加德罗常数的值为
 ,ZnS晶体的密度为
,ZnS晶体的密度为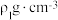 ,ZnSe晶体的密度为
,ZnSe晶体的密度为 ,则ZnS晶体中Zn与S原子最短距离和ZnSe晶体中Zn与Se原子最短距离之比为
,则ZnS晶体中Zn与S原子最短距离和ZnSe晶体中Zn与Se原子最短距离之比为
您最近一年使用:0次
2022-03-23更新
|
295次组卷
|
2卷引用:河北省张家口市2022届高三第一次模拟考试化学试题
解题方法
7 . “祝融号”火星车在火星表面已完成计划内工作,其利用表面成分探测仪、多光谱相机等开展定点探测,一张公布的“祝融号”行进路上的火星岩石图象如图所示。研究发现,火星岩的主要成分为 和
和 。回答下列问题:
。回答下列问题:

(1)基态 原子核外电子占据能量最高的能级的电子云轮廓图为
原子核外电子占据能量最高的能级的电子云轮廓图为______ 。
(2)在上述氧化物中属于原子晶体的是_______ (填化学式)。
(3) 溶于
溶于 溶液生成
溶液生成 。
。 中Al的杂化类型是
中Al的杂化类型是_______ ,Al和O构成的空间结构是_______ 。
(4)配离子 中配位原子是C而不是O,可能的原因是
中配位原子是C而不是O,可能的原因是______ 。
(5)已知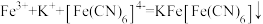 ,利用该离子方程式可以检验溶液中的
,利用该离子方程式可以检验溶液中的 。
。 中σ键、π键数目之比为
中σ键、π键数目之比为_______ 。
(6)已知铁和镁形成的晶胞如图所示。
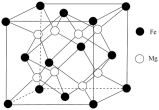
①在该晶胞中铁的配位数为___________ 。
②已知该晶胞参数为 。
。 为阿伏加德罗常数的值。两个
为阿伏加德罗常数的值。两个 原子的最近距离为
原子的最近距离为______  ,该晶胞的密度为
,该晶胞的密度为______ (只列计算式) 。
。
 和
和 。回答下列问题:
。回答下列问题:
(1)基态
 原子核外电子占据能量最高的能级的电子云轮廓图为
原子核外电子占据能量最高的能级的电子云轮廓图为(2)在上述氧化物中属于原子晶体的是
(3)
 溶于
溶于 溶液生成
溶液生成 。
。 中Al的杂化类型是
中Al的杂化类型是(4)配离子
 中配位原子是C而不是O,可能的原因是
中配位原子是C而不是O,可能的原因是(5)已知
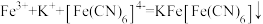 ,利用该离子方程式可以检验溶液中的
,利用该离子方程式可以检验溶液中的 。
。 中σ键、π键数目之比为
中σ键、π键数目之比为(6)已知铁和镁形成的晶胞如图所示。

①在该晶胞中铁的配位数为
②已知该晶胞参数为
 。
。 为阿伏加德罗常数的值。两个
为阿伏加德罗常数的值。两个 原子的最近距离为
原子的最近距离为 ,该晶胞的密度为
,该晶胞的密度为 。
。
您最近一年使用:0次
名校
解题方法
8 . 铜是人类广泛使用的第一种金属,含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)基态 原子最高能层的电子排布式为
原子最高能层的电子排布式为___________ 。
(2) 稀溶液中存在
稀溶液中存在 。已知d轨道也可以参与杂化,则
。已知d轨道也可以参与杂化,则 中
中 的杂化方式为___________(填选项字母)。
的杂化方式为___________(填选项字母)。
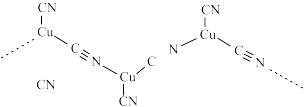
(3) 与
与 形成长链结构的阴离子如图所示,该阴离子中
形成长链结构的阴离子如图所示,该阴离子中 键与
键与 键数目之比为
键数目之比为___________ 。
(4)铜能与拟卤素 反应。拟卤素
反应。拟卤素 对应的酸有两种,理论上异硫氰酸
对应的酸有两种,理论上异硫氰酸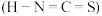 的沸点高于硫氰酸
的沸点高于硫氰酸 ,其原因为
,其原因为___________ ;写出一种与 互为等电子体的分子式
互为等电子体的分子式___________ 。
(5) 可形成
可形成 ,其中
,其中 代表
代表 。
。
①该化合物分子中, 模型为四面体或正四面体的非金属原子共有
模型为四面体或正四面体的非金属原子共有___________ 个。
②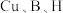 的电负性由大到小的顺序为
的电负性由大到小的顺序为___________ 。
(6)一种由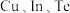 组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
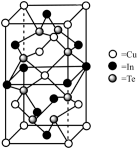
① 的配位数为
的配位数为___________ ;晶体中 原子填充在
原子填充在 、
、 围成的四面体空隙中,则四面体空隙的占有率为
围成的四面体空隙中,则四面体空隙的占有率为___________ 。
②若晶胞底边的边长均为 ,高为
,高为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,设晶体的最简式的式量为
,设晶体的最简式的式量为 ,则该晶体的密度为
,则该晶体的密度为___________  (列出计算式)。
(列出计算式)。
(1)基态
 原子最高能层的电子排布式为
原子最高能层的电子排布式为(2)
 稀溶液中存在
稀溶液中存在 。已知d轨道也可以参与杂化,则
。已知d轨道也可以参与杂化,则 中
中 的杂化方式为___________(填选项字母)。
的杂化方式为___________(填选项字母)。A. | B. | C. | D. |
 与
与 形成长链结构的阴离子如图所示,该阴离子中
形成长链结构的阴离子如图所示,该阴离子中 键与
键与 键数目之比为
键数目之比为
(4)铜能与拟卤素
 反应。拟卤素
反应。拟卤素 对应的酸有两种,理论上异硫氰酸
对应的酸有两种,理论上异硫氰酸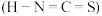 的沸点高于硫氰酸
的沸点高于硫氰酸 ,其原因为
,其原因为 互为等电子体的分子式
互为等电子体的分子式(5)
 可形成
可形成 ,其中
,其中 代表
代表 。
。①该化合物分子中,
 模型为四面体或正四面体的非金属原子共有
模型为四面体或正四面体的非金属原子共有②
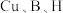 的电负性由大到小的顺序为
的电负性由大到小的顺序为(6)一种由
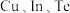 组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
组成的高熵合金具有优良的热电性能,其四方晶胞如图所示:
①
 的配位数为
的配位数为 原子填充在
原子填充在 、
、 围成的四面体空隙中,则四面体空隙的占有率为
围成的四面体空隙中,则四面体空隙的占有率为②若晶胞底边的边长均为
 ,高为
,高为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,设晶体的最简式的式量为
,设晶体的最简式的式量为 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2021-12-03更新
|
997次组卷
|
5卷引用:河北省石家庄市2021-2022学年高三上学期毕业班教学质量检测(一)化学试题
河北省石家庄市2021-2022学年高三上学期毕业班教学质量检测(一)化学试题河北省石家庄市2022届高三上学期教学质量检测(一)化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】20(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)广东省佛山市李兆基中学、郑裕彤中学两校2021-2022学年高三下学期3月联考化学试题
名校
解题方法
9 . 铝及其化合物广泛应用于金属冶炼、有机合成等领域。
(1)铝热反应可以冶炼金属铬,Cr基态核外电子排布式为_______ 。
(2)单个AlCl3气态分子的空间构型为_______ ,AlCl3可与Cl-形成AlCl ,与AlCl
,与AlCl 互为等电子体的分子为
互为等电子体的分子为_______ 。
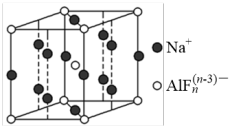
(3)某遮光剂的晶胞如图所示,则n=_______ 。
(1)铝热反应可以冶炼金属铬,Cr基态核外电子排布式为
(2)单个AlCl3气态分子的空间构型为
 ,与AlCl
,与AlCl 互为等电子体的分子为
互为等电子体的分子为(3)某遮光剂的晶胞如图所示,则n=

您最近一年使用:0次
10 . I.芦笋中的天冬酰胺(结构如下图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。
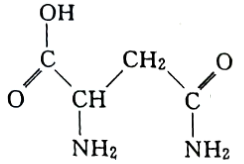
(1)天冬酰胺所含元素中,___________ (填元素名称)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型为___________ 。
(3)写出铬元素基态原子的电子排布式___________ 。
(4)H2S和H2Se的参数对比见下表。
H2S的键角大于H2Se的原因可能为___________ 。
II.钴的一种配位聚合物的化学式为{[Co(bte)2(H2O)2](NO3)2}n。
(1)bte的分子式为C6H8N6,其结构简式如图所示。
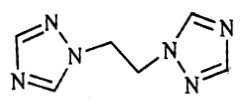
①[Co(bte)2(H2O)2]2+中,与Co2+形成配位键的原子是___________ 和___________ (填元素符号),配位数为___________ 。
②1molbte分子中含σ键的数目为___________ 。
(2)钴的另外四种配合物为CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)。取四种化合物各1mol,分别溶于水,加入足量硝酸银溶液,立即产生氯化银,沉淀的量分别为3mol、2mol、1mol和1mol,请根据实验事实用配合物的形式写出它们的化学式。CoCl3·6NH3___________ ,CoCl3·4NH3(绿色和紫色)___________ 。

(1)天冬酰胺所含元素中,
(2)天冬酰胺中碳原子的杂化轨道类型为
(3)写出铬元素基态原子的电子排布式
(4)H2S和H2Se的参数对比见下表。
| 化学式 | 键长/nm | 键角 | 沸点/°C |
| H2S | 1.34 | 92.3° | -60.75 |
| H2Se | 1.47 | 91.0° | -41.50 |
II.钴的一种配位聚合物的化学式为{[Co(bte)2(H2O)2](NO3)2}n。
(1)bte的分子式为C6H8N6,其结构简式如图所示。

①[Co(bte)2(H2O)2]2+中,与Co2+形成配位键的原子是
②1molbte分子中含σ键的数目为
(2)钴的另外四种配合物为CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)。取四种化合物各1mol,分别溶于水,加入足量硝酸银溶液,立即产生氯化银,沉淀的量分别为3mol、2mol、1mol和1mol,请根据实验事实用配合物的形式写出它们的化学式。CoCl3·6NH3
您最近一年使用:0次



