解题方法
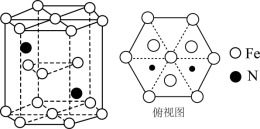
1 . 近日,科学家利用铁配合物催化氮气选择性转化成肼。铁配合物结构如图所示(Et为乙基:-CH2CH3)。

回答下列问题:
(1)基态 的价层电子排布式
的价层电子排布式___________ ,微粒半径Fe___________  。(填“大于”、“小于”或“等于”)
。(填“大于”、“小于”或“等于”)
(2) 所含元素中,电负性最大的元素是
所含元素中,电负性最大的元素是___________ 。P原子的杂化类型是___________ 。
(3) 和
和 的相对分子质量相同,但是常温常压下,
的相对分子质量相同,但是常温常压下, 呈液态,而
呈液态,而 呈气态,其主要原因是
呈气态,其主要原因是___________ 。
(4) 的VSEPR模型为
的VSEPR模型为___________ 。写出N2的一种等电子体___________ 。
(5)某种磁性氮化铁的晶胞结构如图所示。已知: 为阿伏加德罗常数的值,六棱柱底边的边长为
为阿伏加德罗常数的值,六棱柱底边的边长为 ,高为
,高为 ,该晶体中Fe、N原子个数最简比为
,该晶体中Fe、N原子个数最简比为___________ 。该晶体的密度为___________  (只列计算式)。
(只列计算式)。

回答下列问题:
(1)基态
 的价层电子排布式
的价层电子排布式 。(填“大于”、“小于”或“等于”)
。(填“大于”、“小于”或“等于”)(2)
 所含元素中,电负性最大的元素是
所含元素中,电负性最大的元素是(3)
 和
和 的相对分子质量相同,但是常温常压下,
的相对分子质量相同,但是常温常压下, 呈液态,而
呈液态,而 呈气态,其主要原因是
呈气态,其主要原因是(4)
 的VSEPR模型为
的VSEPR模型为(5)某种磁性氮化铁的晶胞结构如图所示。已知:
 为阿伏加德罗常数的值,六棱柱底边的边长为
为阿伏加德罗常数的值,六棱柱底边的边长为 ,高为
,高为 ,该晶体中Fe、N原子个数最简比为
,该晶体中Fe、N原子个数最简比为 (只列计算式)。
(只列计算式)。
您最近一年使用:0次
解题方法
2 . 钙是一种重要的化学元素,钙在地壳中含量较高且在多方面有着广泛的用途。回答下列问题:
(1)如图是石膏的部分层状结构,中间的虚线代表层与层的分界线。(已知:O:H2O、●:Ca2+、 :硫氧四面体)
:硫氧四面体) 的空间构型是
的空间构型是___________ ,石膏中层与层之间的作用力主要是___________ 。

(2)钙钛矿材料是与钛酸钙(CaTiO3)具备相同晶体结构的一类“陶瓷氧化物”的统称,在太阳能电池中应用广泛。其化学式可表示为ABX3,A代表“大半径阳离子”,B代表“金属阳离子”,X代表“阴离子”。常见的A有MA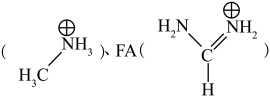 、Cs+,Rb+等,其中MA中N原子的杂化轨道类型是
、Cs+,Rb+等,其中MA中N原子的杂化轨道类型是___________ ,1molFA中存在___________ 个 键(NA表示阿伏加德罗常数的值)。
键(NA表示阿伏加德罗常数的值)。
(3)一种立方钙钛矿型晶体LaCrO3有两种晶胞结构,其三视图如下(重叠处仅画出大的微粒),La的配位数均是12。

①基态Cr原子的价层电子排布式为___________ ,同周期元素中与其最外层电子数相同的元素为___________ (填元素符号)。
②图a晶胞中O的位置为___________ (填“体心”“顶点”“面心”“棱心”,下同);图b晶胞中O的位置为___________ 。图a的晶胞参数为393.9pm,则O与O的最小核间距为___________ pm(写出表达式)。
(1)如图是石膏的部分层状结构,中间的虚线代表层与层的分界线。(已知:O:H2O、●:Ca2+、
 :硫氧四面体)
:硫氧四面体) 的空间构型是
的空间构型是
(2)钙钛矿材料是与钛酸钙(CaTiO3)具备相同晶体结构的一类“陶瓷氧化物”的统称,在太阳能电池中应用广泛。其化学式可表示为ABX3,A代表“大半径阳离子”,B代表“金属阳离子”,X代表“阴离子”。常见的A有MA
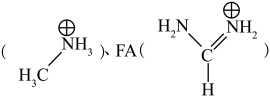 、Cs+,Rb+等,其中MA中N原子的杂化轨道类型是
、Cs+,Rb+等,其中MA中N原子的杂化轨道类型是 键(NA表示阿伏加德罗常数的值)。
键(NA表示阿伏加德罗常数的值)。(3)一种立方钙钛矿型晶体LaCrO3有两种晶胞结构,其三视图如下(重叠处仅画出大的微粒),La的配位数均是12。

①基态Cr原子的价层电子排布式为
②图a晶胞中O的位置为
您最近一年使用:0次
解题方法
3 . 磷、硼及其化合物用途非常广泛。回答下列问题:
(1)镍的一种配合物为 ,Ph表示苯基。
,Ph表示苯基。
①基态Ni原子价电子排布式为___________ ;镍在周期表中位于第___________ 周期第___________ 族。
②配体为___________ ; 分子中含σ键数为
分子中含σ键数为___________ 个。
(2) 是合成聚丙烯的一种催化剂,可通过反应
是合成聚丙烯的一种催化剂,可通过反应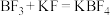 制备。
制备。
① 中阴离子空间构型为
中阴离子空间构型为___________ ,该物质中含有的化学键类型有___________ (填字母)
A.离子键 B.共价键 C.配位键 D.氢键
② 分子的B-F键间的键角比
分子的B-F键间的键角比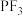 中P-F间的键角(96.3°)大,其原因是
中P-F间的键角(96.3°)大,其原因是___________ 。
(3)磷化硼是一种半导体材料,密度为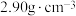 ,熔点为1100℃,晶胞结构如下图所示:磷化硼属于
,熔点为1100℃,晶胞结构如下图所示:磷化硼属于___________ 晶体;其晶胞参数a=___________ nm(列出计算式)。

(1)镍的一种配合物为
 ,Ph表示苯基。
,Ph表示苯基。①基态Ni原子价电子排布式为
②配体为
 分子中含σ键数为
分子中含σ键数为(2)
 是合成聚丙烯的一种催化剂,可通过反应
是合成聚丙烯的一种催化剂,可通过反应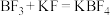 制备。
制备。①
 中阴离子空间构型为
中阴离子空间构型为A.离子键 B.共价键 C.配位键 D.氢键
②
 分子的B-F键间的键角比
分子的B-F键间的键角比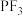 中P-F间的键角(96.3°)大,其原因是
中P-F间的键角(96.3°)大,其原因是(3)磷化硼是一种半导体材料,密度为
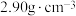 ,熔点为1100℃,晶胞结构如下图所示:磷化硼属于
,熔点为1100℃,晶胞结构如下图所示:磷化硼属于
您最近一年使用:0次
名校
解题方法
4 . 主族元素N、F、Cl等的某些化合物对工农业生产意义重大。回答下列问题:
(1)氰化物曾是杀虫剂中的成分之一,KCN中C原子采取的杂化类型是___________ ,基态N原子价层电子排布式为___________ 。
(2)次氟酸(HOF)为淡黄色液体,是很好的氧化剂。
①键角:
___________ (填“>”或“<”) 。
。
② 分子的空间构型为
分子的空间构型为___________ ,其熔、沸点低于 的原因是
的原因是___________ 。
(3)苏氨酸(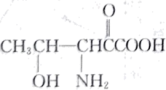 )主要用于制作医药、食品强化剂等。
)主要用于制作医药、食品强化剂等。
①1个该分子中含有___________ 个 键。
键。
②N的第一电离能比O的第一电离能大,其原因是___________ 。
(4) 晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点、M点原子的分数坐标分别为 (
晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点、M点原子的分数坐标分别为 (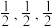 )、(0,0,0)。已知Xe-F键长为rpm。
)、(0,0,0)。已知Xe-F键长为rpm。
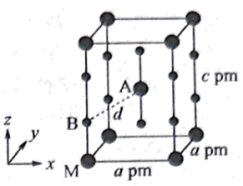
①该晶胞中有___________ 个 分子。
分子。
②B点原子的分数坐标为___________ 。
③晶胞中A、B间距离d=___________ pm(列出算式即可)。
(1)氰化物曾是杀虫剂中的成分之一,KCN中C原子采取的杂化类型是
(2)次氟酸(HOF)为淡黄色液体,是很好的氧化剂。
①键角:

 。
。②
 分子的空间构型为
分子的空间构型为 的原因是
的原因是(3)苏氨酸(
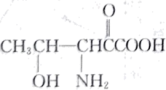 )主要用于制作医药、食品强化剂等。
)主要用于制作医药、食品强化剂等。①1个该分子中含有
 键。
键。②N的第一电离能比O的第一电离能大,其原因是
(4)
 晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点、M点原子的分数坐标分别为 (
晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点、M点原子的分数坐标分别为 (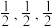 )、(0,0,0)。已知Xe-F键长为rpm。
)、(0,0,0)。已知Xe-F键长为rpm。
①该晶胞中有
 分子。
分子。②B点原子的分数坐标为
③晶胞中A、B间距离d=
您最近一年使用:0次
名校
解题方法
5 . 由H、C、O、N、S、Al、Fe、Ti等元素能形成多种物质。这些物质有许多用途。请回答下列问题:
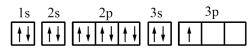
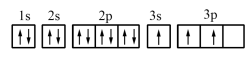
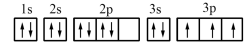
(1)某同学写出了铝原子的4种不同状态的电子排布图:
 .
.
 .
.
 .
.
 .
.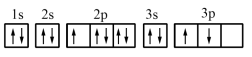
其中能量最低的是_______ (填字母)。
(2)C、O、N 原子的第一电离能由大到小的顺序为_______ ;H2S的键角比H2O的键角_______ (填“大”或“小”)
(3)铁能与三氮唑(结构见图甲)形成多种配合物。
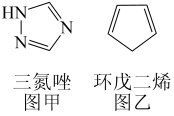
①l mol三氮唑中所含σ键的数目为_______ mol; 碳原子杂化方式是_______ ;
②三氮唑的沸点为260℃,与之结构相似且相对分子质量接近的环戊二烯(结构见图乙)的沸点为42.5℃,前者沸点较高的原因是_______ 。
(4)近年来,钙钛矿太阳能电池是光电材料领域的研究热门,其晶胞结构如下图所示:
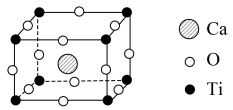
钙钛矿的化学式为_______ ,该晶胞中Ca2+与O2-的最短距离是_______ cm(已知晶胞参数为anm)。
(1)某同学写出了铝原子的4种不同状态的电子排布图:
 .
.
 .
.
 .
.
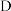 .
.
其中能量最低的是
(2)C、O、N 原子的第一电离能由大到小的顺序为
(3)铁能与三氮唑(结构见图甲)形成多种配合物。

①l mol三氮唑中所含σ键的数目为
②三氮唑的沸点为260℃,与之结构相似且相对分子质量接近的环戊二烯(结构见图乙)的沸点为42.5℃,前者沸点较高的原因是
(4)近年来,钙钛矿太阳能电池是光电材料领域的研究热门,其晶胞结构如下图所示:

钙钛矿的化学式为
您最近一年使用:0次
2023-08-27更新
|
71次组卷
|
2卷引用:陕西省汉中中学2024届高三上学期8月质量检测化学试题
解题方法
6 . 钛被称为继铁、铝之后的“第三金属”,其单质及化合物在航天、军事、航海、医疗等领域都有着重要的应用。回答下列问题:
(1)基态钛原子的价电子排布式为_______ 。
(2)硫酸氧钛( )中
)中 的空间结构为
的空间结构为_______ , 中心原子的轨道杂化类型为
中心原子的轨道杂化类型为_______ 。
(3)几种卤化钛晶体熔点如下表所示:
 的熔点明显高于
的熔点明显高于 ,原因是
,原因是_______ 。 、
、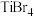 、
、 的点依次升高的原因是
的点依次升高的原因是_______ 。
(4)钛的配合物有多种。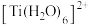 、
、 、
、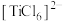 的配体中所含原子电负性由大到小的顺序是
的配体中所含原子电负性由大到小的顺序是_______ ,其中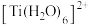 中
中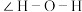
_______ (填“大于”、“小于”或“等于”)单个水分子中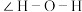 。
。
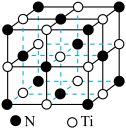
(5)硼钛二元化合物是一种高熔点、高硬度、抗氧化的新型陶瓷材料,属于六方晶系,其晶体结构如图,该硼钛二元化合物的化学式为_______ 。

(6)氮化钛具有典型的 型晶体结构,晶胞结构如图所示,若该晶胞的密度为
型晶体结构,晶胞结构如图所示,若该晶胞的密度为 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为 ,则晶胞中Ti原子与Ti原子的最近距离为
,则晶胞中Ti原子与Ti原子的最近距离为_______ pm(用含 、
、 的代数式表示)。
的代数式表示)。
(1)基态钛原子的价电子排布式为
(2)硫酸氧钛(
 )中
)中 的空间结构为
的空间结构为 中心原子的轨道杂化类型为
中心原子的轨道杂化类型为(3)几种卤化钛晶体熔点如下表所示:
| 卤化钛 |  |  |  |  |
| 熔点/℃ | 1200 |  | 39 | 150 |
 的熔点明显高于
的熔点明显高于 ,原因是
,原因是 、
、 、
、 的点依次升高的原因是
的点依次升高的原因是(4)钛的配合物有多种。
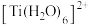 、
、 、
、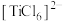 的配体中所含原子电负性由大到小的顺序是
的配体中所含原子电负性由大到小的顺序是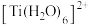 中
中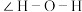
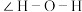 。
。(5)硼钛二元化合物是一种高熔点、高硬度、抗氧化的新型陶瓷材料,属于六方晶系,其晶体结构如图,该硼钛二元化合物的化学式为

(6)氮化钛具有典型的
 型晶体结构,晶胞结构如图所示,若该晶胞的密度为
型晶体结构,晶胞结构如图所示,若该晶胞的密度为 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为 ,则晶胞中Ti原子与Ti原子的最近距离为
,则晶胞中Ti原子与Ti原子的最近距离为 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
7 . 回答下列问题:
(1)基态硫原子电子占据的最高能层符号为_______ ,核外有_______ 种能量不同的电子,硫原子核外电子有_______ 种空间运动状态。与S同主族的第4种元素的符号是_______ ,其价电子排布式为_______ 。
(2)已知有下列转化:
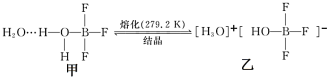
H3O+的VSEPR模型为_______ 。化学物乙中微粒间不存在的作用力有_______ (填序号)。
A.离子键 B.共价键 C.配位键 D.σ键 E.金属键
(3)向 CuSO4溶液中加入过量氨水可生成[Cu(NH3)4]2+,不考虑空间构型,该配离子的结构示意图为_______ 。1mol[Cu(NH3)4]2+中σ键的数目为_______ 。
(4)已知胆矾的结构式如下,则胆矾的化学式用配合物的形式表示为_______ 。

(1)基态硫原子电子占据的最高能层符号为
(2)已知有下列转化:

H3O+的VSEPR模型为
A.离子键 B.共价键 C.配位键 D.σ键 E.金属键
(3)向 CuSO4溶液中加入过量氨水可生成[Cu(NH3)4]2+,不考虑空间构型,该配离子的结构示意图为
(4)已知胆矾的结构式如下,则胆矾的化学式用配合物的形式表示为

您最近一年使用:0次
名校
8 . 铁在史前就为人们所用。在人类文明发展过程中,铁所起的作用是其他任何元素都不能比拟的。请回答下列问题:
(1)基态铁原子中,价电子电子云的伸展方向有_______ 种。
(2)五羰基合铁[Fe(CO)5]分解制铁晶体,反应过程中断裂和形成的化学键有_________ ( 填序号);
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是___________________ 。
(3)绿矾(FeSO4·7H2O)结构如图。

①H2O分别与Fe2+、 的相互作用分别为
的相互作用分别为_______________ 、_____________ 。
②比较 中的键角∠O−S−O
中的键角∠O−S−O________ H2O中的键角∠H−O−H。 (填“<” “>”或“=”)
(4)铁的化合物种类众多,其中FeF3的熔点高于1000°C,而FeBr3的熔点只有200°C,原因是___________ 。
(5)铁的一种配位化合物(普鲁士蓝)中铁氰骨架结构如图(a)所所示,骨架为正六面体,K+位于骨架的正六面体的空穴中,以平衡铁氰骨架的负电荷,则该钾盐的化学式为_____________________ 。

(6)一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm=____________ cm3·mol−1 (已知阿伏加德罗常数为NA,晶体的摩尔体积是指单位物质的量晶体所占的体积)。
(1)基态铁原子中,价电子电子云的伸展方向有
(2)五羰基合铁[Fe(CO)5]分解制铁晶体,反应过程中断裂和形成的化学键有
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是
(3)绿矾(FeSO4·7H2O)结构如图。

①H2O分别与Fe2+、
 的相互作用分别为
的相互作用分别为②比较
 中的键角∠O−S−O
中的键角∠O−S−O(4)铁的化合物种类众多,其中FeF3的熔点高于1000°C,而FeBr3的熔点只有200°C,原因是
(5)铁的一种配位化合物(普鲁士蓝)中铁氰骨架结构如图(a)所所示,骨架为正六面体,K+位于骨架的正六面体的空穴中,以平衡铁氰骨架的负电荷,则该钾盐的化学式为

(6)一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm=
您最近一年使用:0次
2023-04-14更新
|
495次组卷
|
3卷引用:陕西省“高考研究831重点课题项目”联盟学校2023届高三第二次大联考理科综合化学试题
陕西省“高考研究831重点课题项目”联盟学校2023届高三第二次大联考理科综合化学试题广东省深圳市龙华中学2022-2023学年高二下学期5月期中考试化学试题(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
解题方法
9 . 2022年9月9日,国家航天局、国家原子能机构联合在北京发布“嫦娥五号”最新科学成果:中国科学家首次在月球上发现新矿物,并命名为“嫦娥石”。“嫦娥石”是一种新的磷酸盐矿物,属于陨磷钠镁钙石(Merrillite)族,颗粒约2~30微米,伴生矿物有钛铁矿等。回答下列问题:
(1)基态钛原子价电子排布式为_______ 。
(2)Fe的配合物有多种。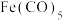 、
、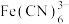 、
、 的配体中所含原子C、N、O、F电负性由大到小的顺序是
的配体中所含原子C、N、O、F电负性由大到小的顺序是_______ (写元素符号,下同);第一电离能由大到小的顺序为_______ 。
(3)磷酸为磷的最高价含氧酸,其空间结构如图:
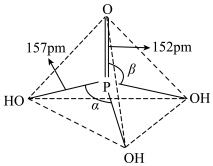
①纯净的磷酸黏度极大,随温度升高黏度迅速下降,原因是_______ 。
② 的立体构型为
的立体构型为_______ ,中心原子的杂化类型是_______ 。
(4)反型钙钛矿电池无须使用具有光催化活性的 (通过氮掺杂生成
(通过氮掺杂生成 ,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。
,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。
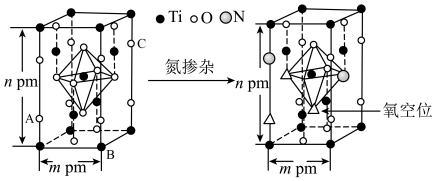
 晶体中
晶体中
_______ ;已知原子A、B的分数坐标分别为 和
和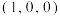 ,则原子C的坐标为
,则原子C的坐标为_______ ,设阿伏加德罗常数的值为 ,
, 的密度为
的密度为_______ g·cm 。
。
(1)基态钛原子价电子排布式为
(2)Fe的配合物有多种。
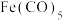 、
、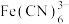 、
、 的配体中所含原子C、N、O、F电负性由大到小的顺序是
的配体中所含原子C、N、O、F电负性由大到小的顺序是(3)磷酸为磷的最高价含氧酸,其空间结构如图:

①纯净的磷酸黏度极大,随温度升高黏度迅速下降,原因是
②
 的立体构型为
的立体构型为(4)反型钙钛矿电池无须使用具有光催化活性的
 (通过氮掺杂生成
(通过氮掺杂生成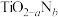 ,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。
,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。
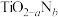 晶体中
晶体中
 和
和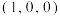 ,则原子C的坐标为
,则原子C的坐标为 ,
, 的密度为
的密度为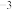 。
。
您最近一年使用:0次
2023-01-02更新
|
387次组卷
|
3卷引用:陕西省榆林市2023届高三第一次模拟理科综合化学试题
名校
解题方法
10 . 硫及其化合物有许多用途,相关物质的物理常数如下表所示:
回答下列问题:
(1)基态S原子价层电子的电子排布图(轨道表达式)为_______ ,其电子占据最高能级的电子云轮廓图为_______ 形。
(2)根据价层电子对互斥理论, 、
、 、
、 的气态分子中,中心原子价层电子对数不同其他分子的是
的气态分子中,中心原子价层电子对数不同其他分子的是_______ 。
(3)气态三氧化硫以单分子形式存在,其分子的立体构型为_______ 形;固体三氧化硫中存在如下图所示的三聚分子,该分子中S原子的杂化轨道类型为_______ 。
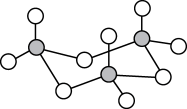
(4)已知亚硫酸根的键角小于硫酸根的键角,请用相关理论解释原因:_______ 。
(5)已知含量酸的酸性与结构中非羟基氧的数目有关,强酸一般有两个非羟基氧(如硫酸: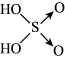 ),中强酸一般有一个非羟基氧(如磷酸:
),中强酸一般有一个非羟基氧(如磷酸: )。已知亚磷酸(H3PO3)是一种二元中强酸。
)。已知亚磷酸(H3PO3)是一种二元中强酸。
①请写出亚磷酸的结构式_______ 。
② 与过量的
与过量的 溶液反应的离子方程式为
溶液反应的离子方程式为_______ 。
| H2S | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | -85.5 | -75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态S原子价层电子的电子排布图(轨道表达式)为
(2)根据价层电子对互斥理论,
 、
、 、
、 的气态分子中,中心原子价层电子对数不同其他分子的是
的气态分子中,中心原子价层电子对数不同其他分子的是(3)气态三氧化硫以单分子形式存在,其分子的立体构型为

(4)已知亚硫酸根的键角小于硫酸根的键角,请用相关理论解释原因:
(5)已知含量酸的酸性与结构中非羟基氧的数目有关,强酸一般有两个非羟基氧(如硫酸:
 ),中强酸一般有一个非羟基氧(如磷酸:
),中强酸一般有一个非羟基氧(如磷酸: )。已知亚磷酸(H3PO3)是一种二元中强酸。
)。已知亚磷酸(H3PO3)是一种二元中强酸。①请写出亚磷酸的结构式
②
 与过量的
与过量的 溶液反应的离子方程式为
溶液反应的离子方程式为
您最近一年使用:0次



