名校
解题方法
1 . 锌的合金及化合物应用广泛。碳酸酐酶是一种含锌金属酶,人体内碳酸酐酶可以大大加快 水合和脱水的反应速率。碳酸酐酶的结构片段如图所示,请回答下列问题:
水合和脱水的反应速率。碳酸酐酶的结构片段如图所示,请回答下列问题:
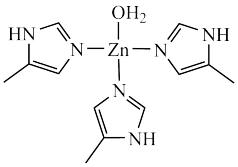
(1) 位于元素周期表的
位于元素周期表的__________ 区。
(2)碳酸酐酶的结构片段中, 的配位数为
的配位数为__________ , 碳酸酐酶结构片段中含有的
碳酸酐酶结构片段中含有的 键数目为
键数目为__________  。
。
(3)金属 能溶于氨水,生成以氨为配体且配位数为4的配离子,
能溶于氨水,生成以氨为配体且配位数为4的配离子, 与氨水反应的离子方程式为
与氨水反应的离子方程式为__________ ; 的键角大于
的键角大于 的,原因为
的,原因为__________ 。
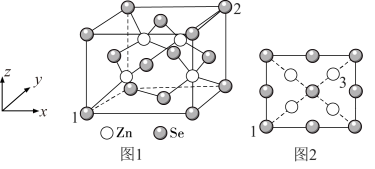
(4)硒化锌是一种重要的半导体材料,其晶胞结构如图1所示,晶胞边长为 。
。
①与 原子距离最近且等距离的
原子距离最近且等距离的 的个数为
的个数为__________ 。
②1号原子的坐标为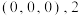 号原子的坐标为
号原子的坐标为 ,图2是
,图2是 晶胞沿
晶胞沿 轴的投影图,3号原子的坐标为
轴的投影图,3号原子的坐标为__________ 。
③设 为阿伏加德罗常数的值,该晶体密度为
为阿伏加德罗常数的值,该晶体密度为__________  。
。
 水合和脱水的反应速率。碳酸酐酶的结构片段如图所示,请回答下列问题:
水合和脱水的反应速率。碳酸酐酶的结构片段如图所示,请回答下列问题:
(1)
 位于元素周期表的
位于元素周期表的(2)碳酸酐酶的结构片段中,
 的配位数为
的配位数为 碳酸酐酶结构片段中含有的
碳酸酐酶结构片段中含有的 键数目为
键数目为 。
。(3)金属
 能溶于氨水,生成以氨为配体且配位数为4的配离子,
能溶于氨水,生成以氨为配体且配位数为4的配离子, 与氨水反应的离子方程式为
与氨水反应的离子方程式为 的键角大于
的键角大于 的,原因为
的,原因为(4)硒化锌是一种重要的半导体材料,其晶胞结构如图1所示,晶胞边长为
 。
。①与
 原子距离最近且等距离的
原子距离最近且等距离的 的个数为
的个数为②1号原子的坐标为
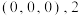 号原子的坐标为
号原子的坐标为 ,图2是
,图2是 晶胞沿
晶胞沿 轴的投影图,3号原子的坐标为
轴的投影图,3号原子的坐标为③设
 为阿伏加德罗常数的值,该晶体密度为
为阿伏加德罗常数的值,该晶体密度为 。
。
您最近一年使用:0次
解题方法
2 . 一种硫酸镍粗品中含有 、
、 、
、 、
、 、
、 等杂质离子,采用下列流程可以对硫酸镍进行提纯,并能获取蓝矾。
等杂质离子,采用下列流程可以对硫酸镍进行提纯,并能获取蓝矾。 ;
;
②部分金属离子(起始浓度为0.1 ,沉淀完全的浓度为
,沉淀完全的浓度为 )生成氢氧化物沉淀的pH范围如下表:
)生成氢氧化物沉淀的pH范围如下表:
回答下列问题:
(1)“水浸”时常适当加热,加热的目的是___________ 。
(2)常温下,X是一种气体,则X、 、
、 中键角从大到小的顺序是
中键角从大到小的顺序是___________ (用化学式表示),其原因是______________ 。
(3)“沉铁”时,总反应的离子方程式为______________ ;其中加入 的作用是调节溶液pH=
的作用是调节溶液pH=___________ (填字母)。
A.1.5 B.4.0 C.6.3 D.6.9
(4)若某次工艺生产中,“沉铁”后,1.0t(体积约为 L)滤液中
L)滤液中 ,“沉钙”后,
,“沉钙”后,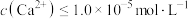 ,则最少加入
,则最少加入___________ g (保留三位有效数字)。
(保留三位有效数字)。
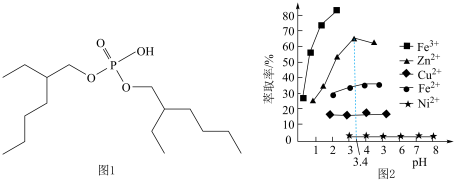
(5)萃取剂P204的结构简式如图1所示,1mol P204中含___________ mol手性碳原子;萃取时,萃取液pH对相关金属离子的影响如图2所示,则最适宜的pH为___________ 。
 、
、 、
、 、
、 、
、 等杂质离子,采用下列流程可以对硫酸镍进行提纯,并能获取蓝矾。
等杂质离子,采用下列流程可以对硫酸镍进行提纯,并能获取蓝矾。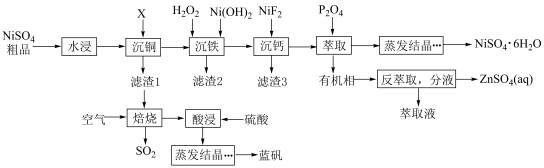
 ;
;②部分金属离子(起始浓度为0.1
 ,沉淀完全的浓度为
,沉淀完全的浓度为 )生成氢氧化物沉淀的pH范围如下表:
)生成氢氧化物沉淀的pH范围如下表:金属离子 |
|
|
|
|
|
|
开始沉淀的pH | 1.5 | 4.2 | 6.2 | 6.3 | 6.9 | 11.8 |
完全沉淀的pH | 2.8 | 6.2 | 8.2 | 8.3 | 8.9 | 13.8 |
(1)“水浸”时常适当加热,加热的目的是
(2)常温下,X是一种气体,则X、
 、
、 中键角从大到小的顺序是
中键角从大到小的顺序是(3)“沉铁”时,总反应的离子方程式为
 的作用是调节溶液pH=
的作用是调节溶液pH=A.1.5 B.4.0 C.6.3 D.6.9
(4)若某次工艺生产中,“沉铁”后,1.0t(体积约为
 L)滤液中
L)滤液中 ,“沉钙”后,
,“沉钙”后,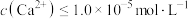 ,则最少加入
,则最少加入 (保留三位有效数字)。
(保留三位有效数字)。(5)萃取剂P204的结构简式如图1所示,1mol P204中含
您最近一年使用:0次
名校
3 . NH3具有易液化、含氢密度高、应用广泛等优点,NH3的合成及应用一直是科学研究的重要课题。
(1)以H2、N2合成NH3,Fe是常用的催化剂。
①基态Fe原子的电子排布式为_____ 。
②我国科学家开发出Fe-LiH等双中心催化剂,在合成NH3中显示出高催化活性。第一电离能(I1):I1(H)>I1(Li)>I1(Na),原因是_____ 。
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
①1体积水可溶解1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是_____ 。
②NaHCO3分解得Na2CO3., 空间结构为
空间结构为_____ 。
(3)NH3、NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
①NH3的中心原子的杂化轨道类型为_____ 。
②比较熔点:NH3BH3_____ CH3CH3(填“>”或“<”)。
(4)NF3的结构与NH3类似,但是性质差异较大。
①NF3的空间结构名称为_____ 。
②NH3BH3具有碱性(可与H+结合)而NF3没有碱性。原因是_____ 。
(1)以H2、N2合成NH3,Fe是常用的催化剂。
①基态Fe原子的电子排布式为
②我国科学家开发出Fe-LiH等双中心催化剂,在合成NH3中显示出高催化活性。第一电离能(I1):I1(H)>I1(Li)>I1(Na),原因是
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱。
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
①1体积水可溶解1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是
②NaHCO3分解得Na2CO3.,
 空间结构为
空间结构为(3)NH3、NH3BH3(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
| 元素 | H | B | N | F |
| 电负性 | 2.1 | 2.0 | 3.0 | 4.0 |
②比较熔点:NH3BH3
(4)NF3的结构与NH3类似,但是性质差异较大。
①NF3的空间结构名称为
②NH3BH3具有碱性(可与H+结合)而NF3没有碱性。原因是
您最近一年使用:0次
2024-03-03更新
|
275次组卷
|
2卷引用:湖南省衡阳市衡阳县第一中学2023-2024学年高二下学期4月期中考试化学试题
名校
4 . 燃油汽车尾气中含有 和氮氧化物,氮氧化物包括
和氮氧化物,氮氧化物包括 等,研究
等,研究 还原氮氧化物及氮氧化物的分解对环境的治理有重要意义。
还原氮氧化物及氮氧化物的分解对环境的治理有重要意义。
(1)已知:
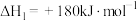 ,
, 的燃烧热为
的燃烧热为 。写出
。写出 与
与 催化转化成
催化转化成 和
和 的热化学方程式
的热化学方程式___________ 。
(2)在 的催化作用下,
的催化作用下, 还原
还原 的反应历程和相对能量变化如图所示(逸出后物质认为状态不发生变化,在图中略去)。
的反应历程和相对能量变化如图所示(逸出后物质认为状态不发生变化,在图中略去)。
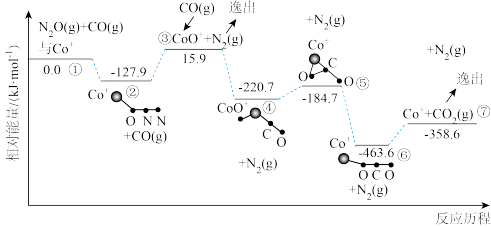
①分析反应历程,

_____  ;
; 分子的中心原子是
分子的中心原子是_____ 。
②该反应分两步进行:a. ;b.
;b._____ 。历程中决定反应速率的变化过程是_____ 。
A.②③ B.③④ C.⑤⑥ D.⑥⑦
(3) 和恒定压强
和恒定压强 时,在密闭容器中模拟某种废气中
时,在密闭容器中模拟某种废气中 直接催化分解过程,分解过程主反应为
直接催化分解过程,分解过程主反应为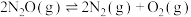 。反应前后各组分的信息如下表:
。反应前后各组分的信息如下表:
分析数据,写出一个 分解的副反应的化学方程式:
分解的副反应的化学方程式:_____ 。该温度下主反应的
_____  (以分压表示,分压=总压
(以分压表示,分压=总压 物质的量分数)。若除去废气中的
物质的量分数)。若除去废气中的 气体,在相同的条件下模拟实验,发现体系中
气体,在相同的条件下模拟实验,发现体系中 的平衡转化率明显降低,解释其原因:
的平衡转化率明显降低,解释其原因:_____ 。
 和氮氧化物,氮氧化物包括
和氮氧化物,氮氧化物包括 等,研究
等,研究 还原氮氧化物及氮氧化物的分解对环境的治理有重要意义。
还原氮氧化物及氮氧化物的分解对环境的治理有重要意义。(1)已知:

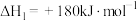 ,
, 的燃烧热为
的燃烧热为 。写出
。写出 与
与 催化转化成
催化转化成 和
和 的热化学方程式
的热化学方程式(2)在
 的催化作用下,
的催化作用下, 还原
还原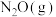 的反应历程和相对能量变化如图所示(逸出后物质认为状态不发生变化,在图中略去)。
的反应历程和相对能量变化如图所示(逸出后物质认为状态不发生变化,在图中略去)。
①分析反应历程,


 ;
; 分子的中心原子是
分子的中心原子是②该反应分两步进行:a.
 ;b.
;b.A.②③ B.③④ C.⑤⑥ D.⑥⑦
(3)
 和恒定压强
和恒定压强 时,在密闭容器中模拟某种废气中
时,在密闭容器中模拟某种废气中 直接催化分解过程,分解过程主反应为
直接催化分解过程,分解过程主反应为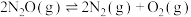 。反应前后各组分的信息如下表:
。反应前后各组分的信息如下表:| 物质 |  |  |  |  |  |  |
 (投料) (投料) | 19 | 34 | 6.5 | 25 | 0 | 0 |
 (平衡) (平衡) | 50 | 1 | 20 | 25 | 2 | 2 |
 分解的副反应的化学方程式:
分解的副反应的化学方程式:
 (以分压表示,分压=总压
(以分压表示,分压=总压 物质的量分数)。若除去废气中的
物质的量分数)。若除去废气中的 气体,在相同的条件下模拟实验,发现体系中
气体,在相同的条件下模拟实验,发现体系中 的平衡转化率明显降低,解释其原因:
的平衡转化率明显降低,解释其原因:
您最近一年使用:0次
2024-02-16更新
|
361次组卷
|
2卷引用:湖南省长沙市长郡中学2024届高三上学期期末适应性考试化学试题
名校
5 . 依据物质结构知识回答下列问题。
Ⅰ.硒是一种非金属,可以用作光敏材料、电解锰行业的催化剂。
(1) 是元素周期表中第34号元素,其基态原子的核外电子简化电子排布式为
是元素周期表中第34号元素,其基态原子的核外电子简化电子排布式为________ 。
(2)根据价层电子对互斥理论,可以推知 的空间构型为
的空间构型为________ ,其中 原子采用的轨道杂化方式为
原子采用的轨道杂化方式为________ 。
(3)已知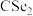 与
与 结构相似,①
结构相似,①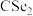 分子内的键角
分子内的键角 、②
、② 分子内的键角
分子内的键角 、③
、③ 分子内的键角
分子内的键角 ,三种键角由大到小的顺序为
,三种键角由大到小的顺序为________ (填序号)。
Ⅱ.碳是一种重要元素,可形成多种单质及化合物。
(4) 分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子稳定结构,则其中
分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子稳定结构,则其中 原子采用的轨道杂化方式为
原子采用的轨道杂化方式为________ 。
(5)已知 与
与 结构相似,推算
结构相似,推算 分子中
分子中 键与
键与 键数目之比为
键数目之比为________ 。氨基氰 为原料可制得类石墨相氮化碳
为原料可制得类石墨相氮化碳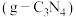 ,氨基氰
,氨基氰 分子中碳、氮原子均满足8电子稳定结构,则该分子的结构简式为
分子中碳、氮原子均满足8电子稳定结构,则该分子的结构简式为________ 。
(6)“C919”飞机机身使用的复合材料——碳纤维和环氧树脂。下列电子排布图能表示碳原子的最低能量状态的是________。
Ⅰ.硒是一种非金属,可以用作光敏材料、电解锰行业的催化剂。
(1)
 是元素周期表中第34号元素,其基态原子的核外电子简化电子排布式为
是元素周期表中第34号元素,其基态原子的核外电子简化电子排布式为(2)根据价层电子对互斥理论,可以推知
 的空间构型为
的空间构型为 原子采用的轨道杂化方式为
原子采用的轨道杂化方式为(3)已知
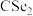 与
与 结构相似,①
结构相似,①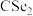 分子内的键角
分子内的键角 、②
、② 分子内的键角
分子内的键角 、③
、③ 分子内的键角
分子内的键角 ,三种键角由大到小的顺序为
,三种键角由大到小的顺序为Ⅱ.碳是一种重要元素,可形成多种单质及化合物。
(4)
 分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子稳定结构,则其中
分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子稳定结构,则其中 原子采用的轨道杂化方式为
原子采用的轨道杂化方式为(5)已知
 与
与 结构相似,推算
结构相似,推算 分子中
分子中 键与
键与 键数目之比为
键数目之比为 为原料可制得类石墨相氮化碳
为原料可制得类石墨相氮化碳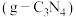 ,氨基氰
,氨基氰 分子中碳、氮原子均满足8电子稳定结构,则该分子的结构简式为
分子中碳、氮原子均满足8电子稳定结构,则该分子的结构简式为(6)“C919”飞机机身使用的复合材料——碳纤维和环氧树脂。下列电子排布图能表示碳原子的最低能量状态的是________。
A.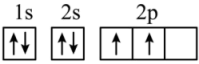 | B. |
C.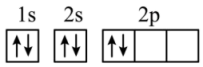 | D.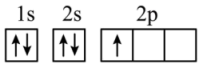 |
您最近一年使用:0次
解题方法
6 . 2022年春晚中舞蹈诗剧《只此青绿》生动还原了北宋名画《千里江山图》。《千里江山图》之所以色彩艳丽,璀璨夺目,与所使用的矿物颜料有关。回答下列问题:
(1)石青,取自蓝铜矿,化学式为Cu3(CO3)2(OH)2. 的空间结构为
的空间结构为_____ ,原子中电子有两种相反的自旋状态,分别用+ 和-
和- 表示,称为电子的自旋磁量子数,则Cu2+中电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则Cu2+中电子自旋磁量子数的代数和为_____ 。
(2)亚铁氰化钾,化学式为K4[Fe(CN)6],呈黄色结晶性粉末。[Fe(CN)6]4-中的C原子的杂化方式为_____ ,[Fe(CN)6]4-中 键和
键和 键的数目之比为
键的数目之比为_____ 。
(3)FeCl3的沸点为319℃,AsCl3的沸点为130.2℃,均属于_____ (填“分子”或“共价”)晶体。列举一种共价晶体:_____ (填化学式)。
(4)某种铜的氧化物的晶胞结构图如图。该铜的氧化物的化学式为_____ ,O2-的配位数为_____ 。若晶胞参数为anm,晶体的密度为dg·cm-3,则阿伏加德罗常数的值为_____ (用含a和d的代数式表示)。

(1)石青,取自蓝铜矿,化学式为Cu3(CO3)2(OH)2.
 的空间结构为
的空间结构为 和-
和- 表示,称为电子的自旋磁量子数,则Cu2+中电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则Cu2+中电子自旋磁量子数的代数和为(2)亚铁氰化钾,化学式为K4[Fe(CN)6],呈黄色结晶性粉末。[Fe(CN)6]4-中的C原子的杂化方式为
 键和
键和 键的数目之比为
键的数目之比为(3)FeCl3的沸点为319℃,AsCl3的沸点为130.2℃,均属于
(4)某种铜的氧化物的晶胞结构图如图。该铜的氧化物的化学式为

您最近一年使用:0次
名校
解题方法
7 . 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、钴、硼、镓、硒、镍等。已知铜的配合物A结构如图。
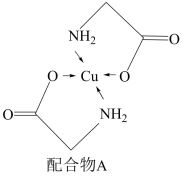
(1)基态硅原子的价电子排布式为_______ ;
(2) 配合物A中含有σ键的数目为
配合物A中含有σ键的数目为_______ NA;
(3)Cu可以形成一种离子化合物 ,若要确定是晶体还是非晶体,最科学的方法是对它进行
,若要确定是晶体还是非晶体,最科学的方法是对它进行_______ 实验;
(4)Co、Ni可形成 、
、 、
、 、
、 等多种配合物。
等多种配合物。
①上述四种配合物中一共有_______ 种配体;
② 的空间构型为
的空间构型为_______ ;
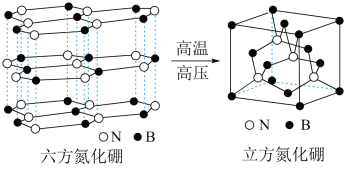
(5)六方氮化硼晶体结构与石墨晶体相似,层间相互作用力为_______ 。
(6)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构、硬度与金刚石相似,其晶胞如图,晶胞边长为 ,立方氮化硼的密度是
,立方氮化硼的密度是_______  (只列算式,
(只列算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。

(1)基态硅原子的价电子排布式为
(2)
 配合物A中含有σ键的数目为
配合物A中含有σ键的数目为(3)Cu可以形成一种离子化合物
 ,若要确定是晶体还是非晶体,最科学的方法是对它进行
,若要确定是晶体还是非晶体,最科学的方法是对它进行(4)Co、Ni可形成
 、
、 、
、 、
、 等多种配合物。
等多种配合物。①上述四种配合物中一共有
②
 的空间构型为
的空间构型为(5)六方氮化硼晶体结构与石墨晶体相似,层间相互作用力为
(6)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构、硬度与金刚石相似,其晶胞如图,晶胞边长为
 ,立方氮化硼的密度是
,立方氮化硼的密度是 (只列算式,
(只列算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2023·山东青岛·二模
解题方法
8 . 我国稀土工艺技术水平世界领先。从离子型稀土矿中(含RE、K、Al、Mg、Si、F等多种铝硅酸盐化合物,RE代表稀土元素)通过阳离子交换法提取 工艺流程如图。
工艺流程如图。
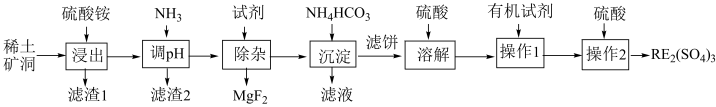
已知:①稀土矿中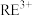 、
、 、
、 等主要吸附于铝硅酸盐中,稀土元素离子
等主要吸附于铝硅酸盐中,稀土元素离子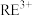
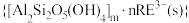 和杂质离子
和杂质离子 在矿洞中可与加入的盐溶液发生阳离子交换,将
在矿洞中可与加入的盐溶液发生阳离子交换,将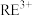 与
与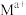 从铝硅酸盐中交换出来。
从铝硅酸盐中交换出来。
②常温下部分难溶物的溶度积如表:
③pH对稀土和铝浸出率的影响如图:

回答下列问题:
(1)“滤渣1”中存在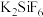 ,其阴离子的空间构型为
,其阴离子的空间构型为___________ 。“浸出”时最佳 为4.5,大于4.5稀土浸出率降低,解释原因
为4.5,大于4.5稀土浸出率降低,解释原因___________ 。
(2)矿洞中“浸出”时发生复杂反应,写出稀土离子交换的离子方程式___________ (注明物质状态)。
(3)“沉淀”稀土离子的离子方程式为___________ 。
(4)回收利用“滤液”的操作单元是___________ 。
(5)“操作2”的名称为___________ ,实验室进行该步操作需要用到的玻璃仪器有___________ 。
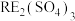 工艺流程如图。
工艺流程如图。
已知:①稀土矿中
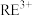 、
、 、
、 等主要吸附于铝硅酸盐中,稀土元素离子
等主要吸附于铝硅酸盐中,稀土元素离子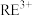
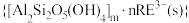 和杂质离子
和杂质离子 在矿洞中可与加入的盐溶液发生阳离子交换,将
在矿洞中可与加入的盐溶液发生阳离子交换,将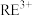 与
与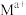 从铝硅酸盐中交换出来。
从铝硅酸盐中交换出来。②常温下部分难溶物的溶度积如表:
| 物质 |  |  | 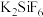 |
 | 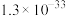 |  |  |

回答下列问题:
(1)“滤渣1”中存在
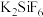 ,其阴离子的空间构型为
,其阴离子的空间构型为 为4.5,大于4.5稀土浸出率降低,解释原因
为4.5,大于4.5稀土浸出率降低,解释原因(2)矿洞中“浸出”时发生复杂反应,写出稀土离子交换的离子方程式
(3)“沉淀”稀土离子的离子方程式为
(4)回收利用“滤液”的操作单元是
(5)“操作2”的名称为
您最近一年使用:0次
9 . 氧化二氯 是国际公认的高效安全灭菌消毒剂之一,某学习小组以
是国际公认的高效安全灭菌消毒剂之一,某学习小组以 为原料用下列装置制备次氯酸溶液。
为原料用下列装置制备次氯酸溶液。

已知:常温常压下, 沸点为3.8℃,42℃以上会分解生成
沸点为3.8℃,42℃以上会分解生成 和
和 ,
, 易溶于水并与水立即反应生成HClO。将氯气和空气(不参与反应)通入
易溶于水并与水立即反应生成HClO。将氯气和空气(不参与反应)通入足量 含水8%的碳酸钠溶液中发生反应,然后用水吸收产生的气体 (不含
(不含 )可制得次氯酸溶液。
)可制得次氯酸溶液。
(1)HClO分子的VSEPR模型(价层电子对互斥模型)名称为_______
(2)各装置的连接顺序为A→_______→_______→_______→_______
(3)写出B中反应的化学方程式_______
(4)装置E中采用棕色圆底烧瓶的原因_______
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是_______ (答一条即可)
(6)用下列实验方案测定所得溶液中次氯酸的物质的量浓度:量取10.00 mL上述次氯酸溶液,并稀释至100.00 mL,再从其中取出10.00 mL于锥形瓶中,加入足量KI溶液,滴加几滴淀粉溶液,用 标准
标准 溶液滴定至终点,消耗25.00 mL标准溶液。该溶液中
溶液滴定至终点,消耗25.00 mL标准溶液。该溶液中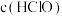 为
为_______  (保留两位小数)。(已知涉及的反应为
(保留两位小数)。(已知涉及的反应为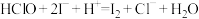 ,
, )
)
(7)滴定过程中滴定前读数正确,滴定后仰视读数,则测得结果会_______ (填“偏高”、“偏低”或“无影响”)。
 是国际公认的高效安全灭菌消毒剂之一,某学习小组以
是国际公认的高效安全灭菌消毒剂之一,某学习小组以 为原料用下列装置制备次氯酸溶液。
为原料用下列装置制备次氯酸溶液。
已知:常温常压下,
 沸点为3.8℃,42℃以上会分解生成
沸点为3.8℃,42℃以上会分解生成 和
和 ,
, 易溶于水并与水立即反应生成HClO。将氯气和空气(不参与反应)通入
易溶于水并与水立即反应生成HClO。将氯气和空气(不参与反应)通入 (不含
(不含 )可制得次氯酸溶液。
)可制得次氯酸溶液。(1)HClO分子的VSEPR模型(价层电子对互斥模型)名称为
(2)各装置的连接顺序为A→_______→_______→_______→____
(3)写出B中反应的化学方程式
(4)装置E中采用棕色圆底烧瓶的原因
(5)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是
(6)用下列实验方案测定所得溶液中次氯酸的物质的量浓度:量取10.00 mL上述次氯酸溶液,并稀释至100.00 mL,再从其中取出10.00 mL于锥形瓶中,加入足量KI溶液,滴加几滴淀粉溶液,用
 标准
标准 溶液滴定至终点,消耗25.00 mL标准溶液。该溶液中
溶液滴定至终点,消耗25.00 mL标准溶液。该溶液中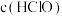 为
为 (保留两位小数)。(已知涉及的反应为
(保留两位小数)。(已知涉及的反应为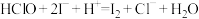 ,
, )
)(7)滴定过程中滴定前读数正确,滴定后仰视读数,则测得结果会
您最近一年使用:0次
名校
解题方法
10 . 磷、硫、氯是重要的非金属元素。回答下列问题:
(1)基态氯原子的核外电子排布式为_______ ;第三周期中第一电离能均大于同周期相邻元素的是_______ (填元素符号)
(2)氮和磷氢化物性质的比较:热稳定性:
_______  (填“>”或“<”)。沸点:
(填“>”或“<”)。沸点:
_______ 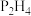 (填“>”或“<”),其沸点大小的判断依据是
(填“>”或“<”),其沸点大小的判断依据是_______ 。
(3)分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),已知
),已知 分子中共含有5对孤电子对,则
分子中共含有5对孤电子对,则 中的大
中的大 键应表示为
键应表示为_______ 。 分子中键角
分子中键角
_______  分子中键角
分子中键角 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
(1)基态氯原子的核外电子排布式为
(2)氮和磷氢化物性质的比较:热稳定性:

 (填“>”或“<”)。沸点:
(填“>”或“<”)。沸点:
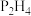 (填“>”或“<”),其沸点大小的判断依据是
(填“>”或“<”),其沸点大小的判断依据是(3)分子中的大
 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),已知
),已知 分子中共含有5对孤电子对,则
分子中共含有5对孤电子对,则 中的大
中的大 键应表示为
键应表示为 分子中键角
分子中键角
 分子中键角
分子中键角 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
您最近一年使用:0次
2023-02-09更新
|
314次组卷
|
2卷引用:湖南省长沙市雅礼中学2022-2023学年高二上学期期末考试化学试题




