名校
解题方法
1 .  、
、 常用于制造农药等。磷在氯气中燃烧生成这两种卤化磷。请回答下列问题:
常用于制造农药等。磷在氯气中燃烧生成这两种卤化磷。请回答下列问题:
(1) 的VSEPR模型是
的VSEPR模型是______ 。已知 中P原子的d能级参与杂化,分子呈三角双锥形(如图甲),由此推知
中P原子的d能级参与杂化,分子呈三角双锥形(如图甲),由此推知 中P的杂化类型为
中P的杂化类型为______ (填标号)。 B.
B. C.
C.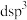 D.
D.
(2)已知,①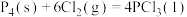
 kJ⋅mol
kJ⋅mol ,
,
②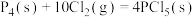
 kJ⋅mol
kJ⋅mol (
(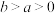 )。
)。
则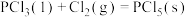

______ (用含a、b、c的式子表示)kJ⋅mol 。
。
(3)实验测得 的速率方程为
的速率方程为 (k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为
(k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为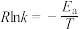 (R为常数,
(R为常数, 为活化能,T为绝对温度)。
为活化能,T为绝对温度)。 和
和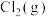 ,实验测得在催化剂Cat1、Cat2下
,实验测得在催化剂Cat1、Cat2下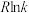 与
与 的关系如图乙所示。催化效能较高的是
的关系如图乙所示。催化效能较高的是______ (填“Cat1”或“Cat2”),判断依据是____________ 。
②将2n mol 和n mol
和n mol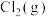 充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时,
充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时, 为a mol,如果此时移走n mol
为a mol,如果此时移走n mol 和0.5n mol
和0.5n mol 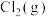 ,在相同温度下再达到平衡时
,在相同温度下再达到平衡时 的物质的量为x,则x为
的物质的量为x,则x为______ (填标号)。
A. mol B.
mol B. mol C.
mol C. mol D.0.5a mol
mol D.0.5a mol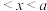 mol
mol
(4)向恒容密闭容器中投入0.2 mol 和0.2 mol
和0.2 mol  ,发生反应:
,发生反应: ,在不同条件下进行,反应体系总压强随时间的变化如图丙所示。
,在不同条件下进行,反应体系总压强随时间的变化如图丙所示。____________ ;曲线c改变的条件可能是____________ 。
②曲线b条件下,该反应平衡常数( )为
)为______ 。[提示:用分压计算的平衡常数为压强平衡常数 ,分压=总压×物质的量分数。]
,分压=总压×物质的量分数。]
 、
、 常用于制造农药等。磷在氯气中燃烧生成这两种卤化磷。请回答下列问题:
常用于制造农药等。磷在氯气中燃烧生成这两种卤化磷。请回答下列问题:(1)
 的VSEPR模型是
的VSEPR模型是 中P原子的d能级参与杂化,分子呈三角双锥形(如图甲),由此推知
中P原子的d能级参与杂化,分子呈三角双锥形(如图甲),由此推知 中P的杂化类型为
中P的杂化类型为
 B.
B. C.
C.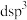 D.
D.
(2)已知,①
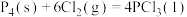
 kJ⋅mol
kJ⋅mol ,
,②
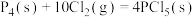
 kJ⋅mol
kJ⋅mol (
(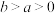 )。
)。则
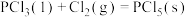

 。
。(3)实验测得
 的速率方程为
的速率方程为 (k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为
(k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为 (R为常数,
(R为常数, 为活化能,T为绝对温度)。
为活化能,T为绝对温度)。
 和
和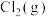 ,实验测得在催化剂Cat1、Cat2下
,实验测得在催化剂Cat1、Cat2下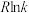 与
与 的关系如图乙所示。催化效能较高的是
的关系如图乙所示。催化效能较高的是②将2n mol
 和n mol
和n mol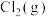 充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时,
充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时, 为a mol,如果此时移走n mol
为a mol,如果此时移走n mol 和0.5n mol
和0.5n mol 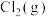 ,在相同温度下再达到平衡时
,在相同温度下再达到平衡时 的物质的量为x,则x为
的物质的量为x,则x为A.
 mol B.
mol B. mol C.
mol C. mol D.0.5a mol
mol D.0.5a mol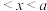 mol
mol(4)向恒容密闭容器中投入0.2 mol
 和0.2 mol
和0.2 mol  ,发生反应:
,发生反应: ,在不同条件下进行,反应体系总压强随时间的变化如图丙所示。
,在不同条件下进行,反应体系总压强随时间的变化如图丙所示。
②曲线b条件下,该反应平衡常数(
 )为
)为 ,分压=总压×物质的量分数。]
,分压=总压×物质的量分数。]
您最近半年使用:0次
昨日更新
|
218次组卷
|
3卷引用:2024届湘豫名校联考高三第二次模拟考试理综试题-高中化学
2024届湘豫名校联考高三第二次模拟考试理综试题-高中化学(已下线)题型11 反应原理综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)2024届江西省吉安市第一中学高三下学期一模化学试题
名校
解题方法
2 . 铁、铜及其化合物在生产生活中有着广泛应用。回答下列问题:
(1)基态 原子核外电子的运动状态有
原子核外电子的运动状态有___________ 种;
 易被氧化为
易被氧化为 ,画出
,画出 的结构示意图
的结构示意图___________ 。
(2) 是检验
是检验 的特征试剂,
的特征试剂, 中心离子配位数是
中心离子配位数是___________ ;1mol 中含有
中含有___________ mol 键,能够证明
键,能够证明 不能电离的试剂是
不能电离的试剂是___________ (填化学式)。
(3) 可形成配合物
可形成配合物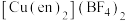 ,其中
,其中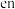 代表
代表 分子。该配合物
分子。该配合物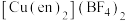 中配位离子所带电荷数为
中配位离子所带电荷数为___________ ,VSEPR模型为四面体的非金属原子共有___________ 个。 单晶的晶胞,其中原子坐标参数A为
单晶的晶胞,其中原子坐标参数A为 ;B为
;B为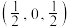 ;C为
;C为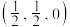 。则D原子的坐标参数为
。则D原子的坐标参数为___________ 。
(1)基态
 原子核外电子的运动状态有
原子核外电子的运动状态有 易被氧化为
易被氧化为 ,画出
,画出 的结构示意图
的结构示意图(2)
 是检验
是检验 的特征试剂,
的特征试剂, 中心离子配位数是
中心离子配位数是 中含有
中含有 键,能够证明
键,能够证明 不能电离的试剂是
不能电离的试剂是(3)
 可形成配合物
可形成配合物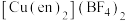 ,其中
,其中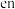 代表
代表 分子。该配合物
分子。该配合物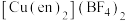 中配位离子所带电荷数为
中配位离子所带电荷数为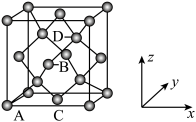
 单晶的晶胞,其中原子坐标参数A为
单晶的晶胞,其中原子坐标参数A为 ;B为
;B为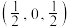 ;C为
;C为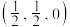 。则D原子的坐标参数为
。则D原子的坐标参数为
您最近半年使用:0次
名校
解题方法
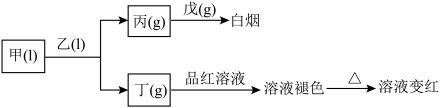
3 . X、Y、Z、W、Q为短周期主族元素,原子序数依次增大且原子序数总和等于49.它们的化合物在常温下有如图所示的转化关系: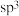 杂化,乙中共价键的键角小于戊中共价键的键角。丙易溶于水,0.1mol/L丙的水溶液中,
杂化,乙中共价键的键角小于戊中共价键的键角。丙易溶于水,0.1mol/L丙的水溶液中, 。甲为三种元素组成的化合物,其他化合物均为两种元素组成的化合物。试回答下列问题:
。甲为三种元素组成的化合物,其他化合物均为两种元素组成的化合物。试回答下列问题:
(1)Q元素原子的简化电子排布式为___________ 。
(2)甲、乙、丙、丁、戊五种分子中,中心原子杂化方式为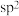 的是
的是___________ (填分子的化学式);乙中共价键的键角小于戊中共价键的键角的原因是___________ 。
(3)戊分子为___________ 分子(填“极性”或“非极性”),甲分子的VSEPR模型为___________ 。
(4)写出甲与乙反应的化学方程式:___________ 。
(5)下列说法正确的是___________ (填序号)。
A.简单阴离子半径:W>Q
B.常温下,0.1 简单氢化物水溶液的pH:Q>W>Z>Y
简单氢化物水溶液的pH:Q>W>Z>Y
C.最高价氧化物对应水化物的酸性:Q>W
D.化合物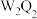 中含极性键、非极性键和离子键
中含极性键、非极性键和离子键
E.甲与乙的化学反应中,甲作氧化剂
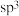 杂化,乙中共价键的键角小于戊中共价键的键角。丙易溶于水,0.1mol/L丙的水溶液中,
杂化,乙中共价键的键角小于戊中共价键的键角。丙易溶于水,0.1mol/L丙的水溶液中, 。甲为三种元素组成的化合物,其他化合物均为两种元素组成的化合物。试回答下列问题:
。甲为三种元素组成的化合物,其他化合物均为两种元素组成的化合物。试回答下列问题:(1)Q元素原子的简化电子排布式为
(2)甲、乙、丙、丁、戊五种分子中,中心原子杂化方式为
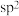 的是
的是(3)戊分子为
(4)写出甲与乙反应的化学方程式:
(5)下列说法正确的是
A.简单阴离子半径:W>Q
B.常温下,0.1
 简单氢化物水溶液的pH:Q>W>Z>Y
简单氢化物水溶液的pH:Q>W>Z>YC.最高价氧化物对应水化物的酸性:Q>W
D.化合物
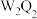 中含极性键、非极性键和离子键
中含极性键、非极性键和离子键E.甲与乙的化学反应中,甲作氧化剂
您最近半年使用:0次
解题方法
4 . 偏磷酸钡Ba(PO3)2具有耐高温、透光性良好等性能,是制备磷酸盐光学玻璃的基础物质。利用湿法磷酸(主要成分为H3PO4,含有少量Mg2+、Fe3+、 、
、 等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示: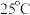 时:①
时:①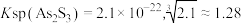 ;
;
②将NH3通入H3PO4溶液中,当pH=3.8~4.5时生成NH4H2PO4,pH=8.0~8.2时生成(NH4)2HPO4。
回答下列问题:
(1)“滤渣1”中含硫化合物的化学式为___________ 。
(2)“滤渣2”的主要成分有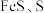 及
及 ,其中生成
,其中生成 的离子方程式为
的离子方程式为___________ ;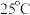 下,当
下,当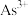 沉淀完全时,
沉淀完全时, 至少为
至少为___________  [当
[当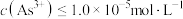 时认为沉淀完全]。
时认为沉淀完全]。
(3)“氨化”的目的之一是通入NH3调节溶液的pH,当溶液pH为4.3时H3PO4转化为___________ (填化学式)。
(4)“脱镁”的目的是生成MgF2沉淀除去Mg2+。若将流程中“氨化”与“脱镁”交换,Mg2+沉淀不完全,原因是___________ 。
(5)“结晶”后得到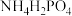 晶体,“煅烧”时生成
晶体,“煅烧”时生成 和
和 等物质,其反应的化学方程式为
等物质,其反应的化学方程式为___________ ;比较 键角:
键角: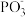
_________  (选填“
(选填“ ”“
”“ ”或“
”或“ ”),其原因是
”),其原因是___________ 。
 、
、 等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
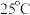 时:①
时:①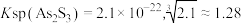 ;
;②将NH3通入H3PO4溶液中,当pH=3.8~4.5时生成NH4H2PO4,pH=8.0~8.2时生成(NH4)2HPO4。
回答下列问题:
(1)“滤渣1”中含硫化合物的化学式为
(2)“滤渣2”的主要成分有
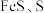 及
及 ,其中生成
,其中生成 的离子方程式为
的离子方程式为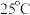 下,当
下,当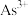 沉淀完全时,
沉淀完全时, 至少为
至少为 [当
[当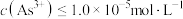 时认为沉淀完全]。
时认为沉淀完全]。(3)“氨化”的目的之一是通入NH3调节溶液的pH,当溶液pH为4.3时H3PO4转化为
(4)“脱镁”的目的是生成MgF2沉淀除去Mg2+。若将流程中“氨化”与“脱镁”交换,Mg2+沉淀不完全,原因是
(5)“结晶”后得到
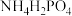 晶体,“煅烧”时生成
晶体,“煅烧”时生成 和
和 等物质,其反应的化学方程式为
等物质,其反应的化学方程式为 键角:
键角: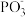
 (选填“
(选填“ ”“
”“ ”或“
”或“ ”),其原因是
”),其原因是
您最近半年使用:0次
2024-04-24更新
|
134次组卷
|
2卷引用:2024届贵州省高三下学期二模化学试题
5 . 某固体混合物A由FeSO4、ZnCl2和Cu(NO3)2组成,3种物质的物质的量之比为1∶1∶1。进行如下实验:
②一些阳离子的开始沉淀至完全沉淀的范围:Fe2+(6.3~8.3)、Fe3+(1.5~2.8)、Zn2+(5.4~8.0)、Cu2+(4.7~6.2)。
③Ag2SO4微溶于硝酸。
请回答:
(1)气体B的主要成分为_____________ ,2mol气体B与1mol Cl2化合生成2mol C,C的空间构型为_____________ 。
(2)溶液F中除OH-、Cl-外的阴离子还有_____________ 。
(3)下列说法正确的是 。
(4)请设计实验检验A中的氯离子_______________ 。
(5)新制蓝色沉淀的悬浊液中通入SO2,产生紫红色固体,写出该反应离子方程式:_____________ 。
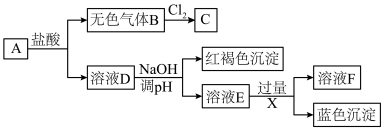
②一些阳离子的开始沉淀至完全沉淀的范围:Fe2+(6.3~8.3)、Fe3+(1.5~2.8)、Zn2+(5.4~8.0)、Cu2+(4.7~6.2)。
③Ag2SO4微溶于硝酸。
请回答:
(1)气体B的主要成分为
(2)溶液F中除OH-、Cl-外的阴离子还有
(3)下列说法正确的是 。
A.根据实验中的转化关系可得: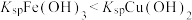 |
| B.调pH范围应控制在2.8~5.4 |
| C.X可以使用氨水或NaOH |
| D.气体B是形成光化学烟雾的罪魁祸首之一 |
(4)请设计实验检验A中的氯离子
(5)新制蓝色沉淀的悬浊液中通入SO2,产生紫红色固体,写出该反应离子方程式:
您最近半年使用:0次
名校
解题方法
6 . 请回答下列问题:
(1)第VIII族元素Fe、Co、Ni性质相似,称为铁系元素,主要用于制造合金。基态Ni原子有_____ 种运动状态的电子,核外能量最高的电子位于_____ 能级;Ni属于_____ 区(填“s”或“p”或“d”或“f”)。
(2)Fe3+与酚类物质的显色反应常用于离子检验,已知Fe3+遇邻苯二酚(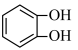 )和对苯二酚(
)和对苯二酚(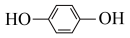 )均显绿色。邻苯二酚的熔、沸点比对苯二酚
)均显绿色。邻苯二酚的熔、沸点比对苯二酚______ (填“高”或“低”),原因是_______ 。
(3)结合VSEPR理论模型及杂化轨道理论分析以下问题:
①Bi(NO3)3中阴离子的立体构型为_______ ,N原子的杂化方式为_____ 。
②NaN3中 的空间结构为
的空间结构为_______ ,其中心原子的杂化类型为______ 。分析微粒空间结构的方法______ 。
(4)60g SiO2中含有的Si−O键数目为____ (用NA表示);1 mol冰中含有___ mol氢键。
(1)第VIII族元素Fe、Co、Ni性质相似,称为铁系元素,主要用于制造合金。基态Ni原子有
(2)Fe3+与酚类物质的显色反应常用于离子检验,已知Fe3+遇邻苯二酚(
 )和对苯二酚(
)和对苯二酚( )均显绿色。邻苯二酚的熔、沸点比对苯二酚
)均显绿色。邻苯二酚的熔、沸点比对苯二酚(3)结合VSEPR理论模型及杂化轨道理论分析以下问题:
①Bi(NO3)3中阴离子的立体构型为
②NaN3中
 的空间结构为
的空间结构为(4)60g SiO2中含有的Si−O键数目为
您最近半年使用:0次
名校
7 . 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
(1)写出基态时J的价层电子排布式_____ ,L的原子序数为____ ,K的+2离子的价层电子的轨道表示式_____ 。
(2)下列关于元素在元素周期表中的位置的叙述正确的是_____。
(3)G元素最高价氧化物的水化物与E元素最高价氧化物的水化物的溶液反应的离子方程式是______ 。
(4)根据对角线规则及已知元素性质,推测A元素的单质与氧气在点燃时反应生成的物质为_______ (填化学式)。
(5)D的简单气态氢化物的 构型为
构型为______ ,它极易溶于水,原因是_______ 。
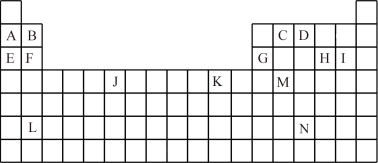
(1)写出基态时J的价层电子排布式
(2)下列关于元素在元素周期表中的位置的叙述正确的是_____。
| A.M位于元素周期表中第四周期ⅥA族,属于p区元素 |
| B.J位于元素周期表中第四周期ⅣB族,属于d区元素 |
| C.F位于元素周期表中第三周期ⅡA族,属于s区元素 |
| D.I位于元素周期表中第三周期ⅦA族,属于ds区元素 |
(3)G元素最高价氧化物的水化物与E元素最高价氧化物的水化物的溶液反应的离子方程式是
(4)根据对角线规则及已知元素性质,推测A元素的单质与氧气在点燃时反应生成的物质为
(5)D的简单气态氢化物的
 构型为
构型为
您最近半年使用:0次
名校
解题方法
8 . 回答下列问题
(1)“棕色环”现象是检验溶液中 的一种方法。向含有
的一种方法。向含有 溶液的试管中加入
溶液的试管中加入 ,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为
,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为 。
。
① 中N元素采取
中N元素采取________ 杂化,其立体构型为________ (填名称);
② 中一种配体实际上是
中一种配体实际上是 ,则其中Fe元素的化合价为
,则其中Fe元素的化合价为________ ;写出 的一种等电子体的化学式
的一种等电子体的化学式________ ;
③ 中微粒间不存在的作用力有
中微粒间不存在的作用力有________ ;
a.极性键 b.非极性键 c.σ键 d.π键 c.配位键 f.离子键
④ 与
与 等金属离子形成的配合物中配位原子一般是S而不是N,其原因是
等金属离子形成的配合物中配位原子一般是S而不是N,其原因是________ 。
(2)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子轨道表示式为________ ; 可发生水解反应,机理如下。含s、p、d轨道的杂化类型有A.
可发生水解反应,机理如下。含s、p、d轨道的杂化类型有A.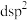 、B.
、B. 、C.
、C. ,中间体
,中间体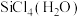 中Si采取的杂化类型为
中Si采取的杂化类型为________ (填字母)。________ ;
②分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为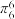 )。请问噻吩中的大π键表示为
)。请问噻吩中的大π键表示为________ 。
(4)最简单的硼烷是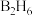 ,其分子结构如下左图,B原子的杂化方式为
,其分子结构如下左图,B原子的杂化方式为________ 。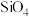 ]四面体(如右上图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,其钠盐的化学式为
]四面体(如右上图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,其钠盐的化学式为________ 。 熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。则
熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。则 熔融的电离方程式为
熔融的电离方程式为________ 。
(1)“棕色环”现象是检验溶液中
 的一种方法。向含有
的一种方法。向含有 溶液的试管中加入
溶液的试管中加入 ,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为
,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为 。
。①
 中N元素采取
中N元素采取②
 中一种配体实际上是
中一种配体实际上是 ,则其中Fe元素的化合价为
,则其中Fe元素的化合价为 的一种等电子体的化学式
的一种等电子体的化学式③
 中微粒间不存在的作用力有
中微粒间不存在的作用力有a.极性键 b.非极性键 c.σ键 d.π键 c.配位键 f.离子键
④
 与
与 等金属离子形成的配合物中配位原子一般是S而不是N,其原因是
等金属离子形成的配合物中配位原子一般是S而不是N,其原因是(2)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子轨道表示式为
 可发生水解反应,机理如下。含s、p、d轨道的杂化类型有A.
可发生水解反应,机理如下。含s、p、d轨道的杂化类型有A.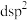 、B.
、B. 、C.
、C. ,中间体
,中间体 中Si采取的杂化类型为
中Si采取的杂化类型为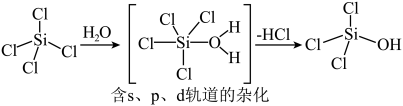
②分子中的大π键可以用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。请问噻吩中的大π键表示为
)。请问噻吩中的大π键表示为(4)最简单的硼烷是
 ,其分子结构如下左图,B原子的杂化方式为
,其分子结构如下左图,B原子的杂化方式为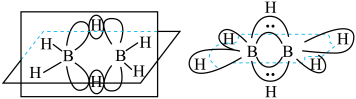
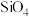 ]四面体(如右上图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,其钠盐的化学式为
]四面体(如右上图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,其钠盐的化学式为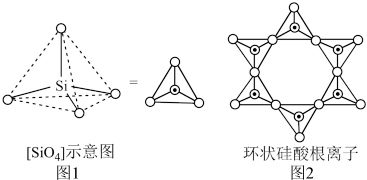
 熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。则
熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。则 熔融的电离方程式为
熔融的电离方程式为
您最近半年使用:0次
名校
解题方法
9 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请用化学用语回答下列问题。
(1)元素F简单离子的价电子排布式为___________ ;写出元素G在周期表中的位置___________ 。
(2)B与氢元素形成的简单气态氢化物的空间构型为___________ ,C与氢元素形成的简单气态氢化物的VSEPR模型为___________ 。
(3)C、D、E三种元素的简单离子半径由大到小的顺序为___________ (用元素符号表示)。
(4)已知元素A、B形成的 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为___________ 。
(5)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是___________ 化合物(填“离子”或“共价”);M的最高价氧化物对应的水化物与NaOH溶液反应的化学方程式为___________ 。
(6)FC—常用作消毒剂,单质砷(As)在碱性溶液中可被FC—氧化为AsO ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 电离能数据(单位: ):738、1451、7733、10540、13630…… ):738、1451、7733、10540、13630…… |
| E | 基态原子最外层电子排布式为: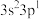 |
| F | 基态原子的最外层p轨道上2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 其中一种氧化物是有磁性的黑色固体 |
(2)B与氢元素形成的简单气态氢化物的空间构型为
(3)C、D、E三种元素的简单离子半径由大到小的顺序为
(4)已知元素A、B形成的
 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为(5)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是
(6)FC—常用作消毒剂,单质砷(As)在碱性溶液中可被FC—氧化为AsO
 ,该反应的离子方程式为
,该反应的离子方程式为
您最近半年使用:0次
解题方法
10 . 近日,科学家利用铁配合物催化氮气选择性转化成肼。铁配合物结构如图所示(Et为乙基:-CH2CH3)。

回答下列问题:
(1)基态 的价层电子排布式
的价层电子排布式___________ ,微粒半径Fe___________  。(填“大于”、“小于”或“等于”)
。(填“大于”、“小于”或“等于”)
(2) 所含元素中,电负性最大的元素是
所含元素中,电负性最大的元素是___________ 。P原子的杂化类型是___________ 。
(3) 和
和 的相对分子质量相同,但是常温常压下,
的相对分子质量相同,但是常温常压下, 呈液态,而
呈液态,而 呈气态,其主要原因是
呈气态,其主要原因是___________ 。
(4) 的VSEPR模型为
的VSEPR模型为___________ 。写出N2的一种等电子体___________ 。
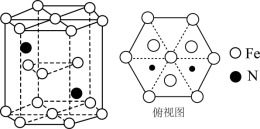
(5)某种磁性氮化铁的晶胞结构如图所示。已知: 为阿伏加德罗常数的值,六棱柱底边的边长为
为阿伏加德罗常数的值,六棱柱底边的边长为 ,高为
,高为 ,该晶体中Fe、N原子个数最简比为
,该晶体中Fe、N原子个数最简比为___________ 。该晶体的密度为___________  (只列计算式)。
(只列计算式)。

回答下列问题:
(1)基态
 的价层电子排布式
的价层电子排布式 。(填“大于”、“小于”或“等于”)
。(填“大于”、“小于”或“等于”)(2)
 所含元素中,电负性最大的元素是
所含元素中,电负性最大的元素是(3)
 和
和 的相对分子质量相同,但是常温常压下,
的相对分子质量相同,但是常温常压下, 呈液态,而
呈液态,而 呈气态,其主要原因是
呈气态,其主要原因是(4)
 的VSEPR模型为
的VSEPR模型为(5)某种磁性氮化铁的晶胞结构如图所示。已知:
 为阿伏加德罗常数的值,六棱柱底边的边长为
为阿伏加德罗常数的值,六棱柱底边的边长为 ,高为
,高为 ,该晶体中Fe、N原子个数最简比为
,该晶体中Fe、N原子个数最简比为 (只列计算式)。
(只列计算式)。
您最近半年使用:0次



