名校
解题方法
1 . 磷及其化合物在工业生产中起着重要的作用。
(1)磷在元素周期表中的位置是___________ ;基态磷原子核外电子排布式___________ 。
(2)氢化物PH3、CH4、NH3的沸点最高的是___________ ,原因是___________ 。
(3)磷元素有白磷、黑磷等常见的单质。
①白磷( )是分子晶体,易溶于
)是分子晶体,易溶于 ,难溶于水,可能原因是
,难溶于水,可能原因是___________ 。
②黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体是与石墨类似的层状结构,如下图所示。下列有关黑磷晶体的说法正确的是___________ (填字母序号)。
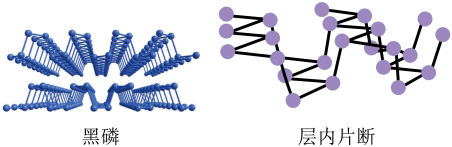
a.黑磷与白磷互为同分异构体 b.黑磷中磷原子采取 杂化 c.黑磷能导电
杂化 c.黑磷能导电
(4) 与水会形成黄色的配离子
与水会形成黄色的配离子 ,为避免颜色干扰,常在
,为避免颜色干扰,常在 溶液中加入
溶液中加入 形成无色的
形成无色的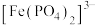 ,此配离子中
,此配离子中___________ (填写化学式)是中心离子, 空间构型是
空间构型是___________ 。
(5)Cu催化烯烃硝化反应过程中会产生 ,键角:
,键角:
___________  (填“> ”或“<"),判断依据是
(填“> ”或“<"),判断依据是___________ 。
(1)磷在元素周期表中的位置是
(2)氢化物PH3、CH4、NH3的沸点最高的是
(3)磷元素有白磷、黑磷等常见的单质。
①白磷(
 )是分子晶体,易溶于
)是分子晶体,易溶于 ,难溶于水,可能原因是
,难溶于水,可能原因是②黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体是与石墨类似的层状结构,如下图所示。下列有关黑磷晶体的说法正确的是

a.黑磷与白磷互为同分异构体 b.黑磷中磷原子采取
 杂化 c.黑磷能导电
杂化 c.黑磷能导电(4)
 与水会形成黄色的配离子
与水会形成黄色的配离子 ,为避免颜色干扰,常在
,为避免颜色干扰,常在 溶液中加入
溶液中加入 形成无色的
形成无色的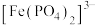 ,此配离子中
,此配离子中 空间构型是
空间构型是(5)Cu催化烯烃硝化反应过程中会产生
 ,键角:
,键角:
 (填“> ”或“<"),判断依据是
(填“> ”或“<"),判断依据是
您最近一年使用:0次
解题方法
2 . 黄铜矿(主要成分为CuFeS2)可用于冶炼Cu2O,主要物质转化过程如下:

(1)Cu2S与O2共热制备Cu2O的反应中,化合价升高的元素是___________ 。
(2)为减少SO2对环境的污染,在高温时可以用CaO将其转化为CaSO4,反应的化学方程式为___________ 。
(3) SO2中心原子的杂化方式是___________ ,用价层电子对互斥理论解释SO2的空间结构不同于CO2的原因:___________ 。
(4)下图中,表示Cu2O晶胞的是___________ (填“图1”或“图2”)。

(5)Cu2O与Cu2S都可视为离子晶体,且结构相似,但Cu2O的熔点比Cu2S的高约100℃,原因是___________ 。
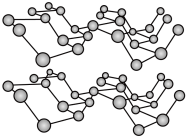
(6) CuFeS2的晶胞如图3所示。
①图4所示结构单元不能 作为CuFeS2晶胞的原因是___________ 。
②从图3可以看出,每个CuFeS2晶胞中含有的Cu原子个数为___________ 。
③已知:CuFeS2晶体的密度是4.30g/cm3,阿伏伽德罗常数的值为NA。CuFeS2晶胞中底边边长a=___________ pm(用计算式表示;1cm=1010pm;CuFeS2的摩尔质量为184g/mol)。

(1)Cu2S与O2共热制备Cu2O的反应中,化合价升高的元素是
(2)为减少SO2对环境的污染,在高温时可以用CaO将其转化为CaSO4,反应的化学方程式为
(3) SO2中心原子的杂化方式是
(4)下图中,表示Cu2O晶胞的是

(5)Cu2O与Cu2S都可视为离子晶体,且结构相似,但Cu2O的熔点比Cu2S的高约100℃,原因是
(6) CuFeS2的晶胞如图3所示。

①图4所示结构单元
②从图3可以看出,每个CuFeS2晶胞中含有的Cu原子个数为
③已知:CuFeS2晶体的密度是4.30g/cm3,阿伏伽德罗常数的值为NA。CuFeS2晶胞中底边边长a=
您最近一年使用:0次
名校
解题方法
3 . NaClO2在工业生产中常用作漂白剂、脱色剂、消毒剂、拔染剂等。实验室中可用H2O2和NaOH混合溶液吸收ClO2的方法制取NaClO2,现利用如下装置及试剂制备NaClO2晶体:
已知:①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2气体浓度较大时易发生爆炸。
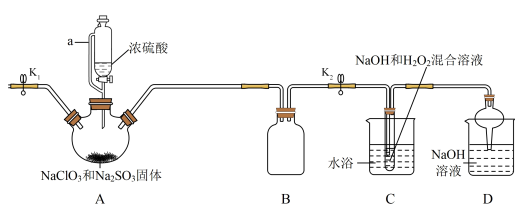
(1)A装置中仪器a的名称为______ 。装置D中NaOH溶液的作用是______ 。
(2)装置A中生成ClO2的化学方程式为______ 。
(3)关于装置C及后续操作的下列说法中,错误的是______ 。
(4)仪器A中NaClO3需稍微过量,原因是______ 。
(5)实验过程中,常需要打开K1,鼓入一定量空气。该操作的目的是______ 。
(6)Cl和O可形成另一种化合物Cl2O,中心原子为O,Cl2O的VSEPR模型是______ ;Cl2O键角比F2O键角______ (填“大”“小”或“相等”)。
(7)NaClO2纯度的测定:用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品1.810g配制成250mL溶液,从中取出25.00mL;加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O =S4O
=S4O +2I-)。样品中NaClO2的纯度为
+2I-)。样品中NaClO2的纯度为______ %(用含c、V的代数式表示)。
已知:①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2气体浓度较大时易发生爆炸。

(1)A装置中仪器a的名称为
(2)装置A中生成ClO2的化学方程式为
(3)关于装置C及后续操作的下列说法中,错误的是
| A.装置C中H2O2作氧化剂 |
| B.为获得NaClO2晶体,可将C试管中的溶液在55℃蒸发浓缩结晶并趁热过滤 |
| C.用50℃左右温水洗涤所得晶体 |
| D.高温烘干过滤后所得滤渣即可得到产物 |
(4)仪器A中NaClO3需稍微过量,原因是
(5)实验过程中,常需要打开K1,鼓入一定量空气。该操作的目的是
(6)Cl和O可形成另一种化合物Cl2O,中心原子为O,Cl2O的VSEPR模型是
(7)NaClO2纯度的测定:用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品1.810g配制成250mL溶液,从中取出25.00mL;加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol•L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为VmL(已知:I2+2S2O =S4O
=S4O +2I-)。样品中NaClO2的纯度为
+2I-)。样品中NaClO2的纯度为
您最近一年使用:0次
2023-10-27更新
|
1096次组卷
|
5卷引用:广西部分高中2024届高三第一次摸底测试化学试题
广西部分高中2024届高三第一次摸底测试化学试题广西南宁市2024届高三上学期毕业班摸底测试化学试题江西省赣州市全南中学2023-2024学年高三上学期11月期中考试化学试题河北省衡水市武邑中学2023-2024学年高三上学期12月期中考试化学试题(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
解题方法
4 . 硫及其化合物种类繁多,应用广泛。请回答:
(1)基态硫原子的价层电子排布图是_______ 。
(2)下列有关说法正确的是_______。
(3) 中的O-O比H2O2中的更
中的O-O比H2O2中的更_______ (填“难”或“易”)断裂。其原因是_______ 。
(4)锌与硫形成的化合物晶体的晶胞如图所示。_______ 。
②设 为阿伏加德罗常数的值,晶胞参数为anm,则该晶体的密度
为阿伏加德罗常数的值,晶胞参数为anm,则该晶体的密度_______ 。
(1)基态硫原子的价层电子排布图是
(2)下列有关说法正确的是_______。
| A.同周期元素中,第一电离能大于硫元素的有3种 |
| B.SO2的VSEPR模型和空间结构均为V形 |
C.甲基磺酸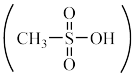 中S原子采取sp杂化 中S原子采取sp杂化 |
D. 的发射光谱不止1条谱线 的发射光谱不止1条谱线 |
(3)
 中的O-O比H2O2中的更
中的O-O比H2O2中的更(4)锌与硫形成的化合物晶体的晶胞如图所示。
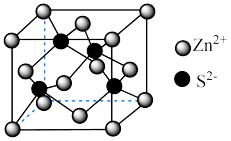
②设
 为阿伏加德罗常数的值,晶胞参数为anm,则该晶体的密度
为阿伏加德罗常数的值,晶胞参数为anm,则该晶体的密度
您最近一年使用:0次
名校
解题方法
5 . 锰酸锂(LiMn2O4) 可作为某锂离子电池的正极材料,工业上利用软锰矿浆(主要成分为 MnO2,含少量 Fe2O3、FeO、Al2O3、SiO2。等杂质)吸收含硫烟气(主要成分 SO2) 制备锰酸锂,生产流程如图所示:

已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强;
②在此流程中部分金属阳离子生成氢氧化物沉淀的 pH 如下表:
(1)含硫烟气中 SO2的VSEPR模型为___________ 。
(2)含硫烟气在通入软锰矿浆前需要先冷却,冷却的原因是___________ 。
(3)请写出含硫烟气在通入软锰矿浆后与 MnO2发生反应的化学方程式:___________ 。
(4)滤液1中所含金属阳离子除 以外还有
以外还有___________ (填离子符号)。
(5)由“滤液1”得到“滤液2”同时回收 Al(OH)3的实验方案如下:边搅拌边向滤液1中加入___________ ,再加入NaOH溶液调节pH范围为___________ ,过滤得到滤液 2 和滤渣,请设计实验方案由滤渣制得纯净 Al(OH)3[Al(OH)3在 pH≥12时溶解]的实验方案:___________ 。
(6)在实际生产中, Li2CO3与 MnO2按物质的量之比1:4混合均匀在 600℃~750℃制取 LiMn2O4,请写出该反应的化学方程式:___________ 。
(7)为测定锰酸锂的纯度, 取2.00g产品置于锥形瓶中, 向其中加入2.68g Na2C2O4和足量硫酸,充分反应后,用0.100mol/L KMnO4标准溶液滴定未反应完的 H2C2O4,到达滴定终点时消耗标准 KMnO4溶液20.00mL,已知:
 则该产品中锰酸锂的质量分数为
则该产品中锰酸锂的质量分数为___________ 。

已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强;
②在此流程中部分金属阳离子生成氢氧化物沉淀的 pH 如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)含硫烟气中 SO2的VSEPR模型为
(2)含硫烟气在通入软锰矿浆前需要先冷却,冷却的原因是
(3)请写出含硫烟气在通入软锰矿浆后与 MnO2发生反应的化学方程式:
(4)滤液1中所含金属阳离子除
 以外还有
以外还有(5)由“滤液1”得到“滤液2”同时回收 Al(OH)3的实验方案如下:边搅拌边向滤液1中加入
(6)在实际生产中, Li2CO3与 MnO2按物质的量之比1:4混合均匀在 600℃~750℃制取 LiMn2O4,请写出该反应的化学方程式:
(7)为测定锰酸锂的纯度, 取2.00g产品置于锥形瓶中, 向其中加入2.68g Na2C2O4和足量硫酸,充分反应后,用0.100mol/L KMnO4标准溶液滴定未反应完的 H2C2O4,到达滴定终点时消耗标准 KMnO4溶液20.00mL,已知:

 则该产品中锰酸锂的质量分数为
则该产品中锰酸锂的质量分数为
您最近一年使用:0次
解题方法
6 . 近日,科学家开发一种氮掺杂氢化镥(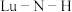 )材料和一种掺杂铜的铅磷灰石晶体结构,表现出超导特性。回答下列问题:
)材料和一种掺杂铜的铅磷灰石晶体结构,表现出超导特性。回答下列问题:
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为___________ ,它位于元素周期表___________ 区,最外层电子云轮廓图为___________ (填名称)。
(2)氮族元素的简单氢化物中最稳定的是___________ (填化学式,下同),沸点最低的是___________ 。
(3)近日,某新药上市,其活性成分的结构简式如图所示。
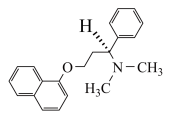
该分子中N原子的杂化轨道类型为___________ ,分子含___________ 个手性碳原子。
(4)含N的分子或离子是常见的配体。如雷氏盐的化学式为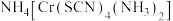 ,常作分析试剂。
,常作分析试剂。
① 的沸点比
的沸点比 高的主要原因是
高的主要原因是___________ , 分子易与
分子易与 形成配离子,而
形成配离子,而 不易形成配离子的原因是
不易形成配离子的原因是___________ 。
②雷氏盐中阳离子的空间结构为___________ (填字母,下同),阴离子的空间结构最可能的是___________ 。
A.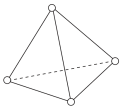 B.
B.
C.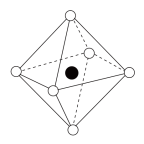 D.
D.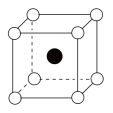
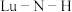 )材料和一种掺杂铜的铅磷灰石晶体结构,表现出超导特性。回答下列问题:
)材料和一种掺杂铜的铅磷灰石晶体结构,表现出超导特性。回答下列问题:(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为(2)氮族元素的简单氢化物中最稳定的是
(3)近日,某新药上市,其活性成分的结构简式如图所示。

该分子中N原子的杂化轨道类型为
(4)含N的分子或离子是常见的配体。如雷氏盐的化学式为
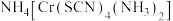 ,常作分析试剂。
,常作分析试剂。①
 的沸点比
的沸点比 高的主要原因是
高的主要原因是 分子易与
分子易与 形成配离子,而
形成配离子,而 不易形成配离子的原因是
不易形成配离子的原因是②雷氏盐中阳离子的空间结构为
A.
 B.
B.
C.
 D.
D.
您最近一年使用:0次
名校
解题方法
7 . 磷及其化合物在工业生产中起着重要的作用。
(1)基态磷原子的价层电子排布图为
___________ 。
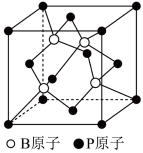
(2)磷元素有白磷、黑磷等常见的单质。黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体具有与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是
___________ (填字母序号)。
a.黑磷与白磷互为同素异形体 b.层与层之间的作用力是共价键
c.黑磷晶体属于混合型晶体 d.分子中磷原子杂化类型为 杂化
杂化
(3) 与水会形成黄色的配离子
与水会形成黄色的配离子
 ,为避免颜色干扰,常在
,为避免颜色干扰,常在
 溶液中加入
溶液中加入
 形成无色的
形成无色的
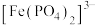 。由此推测,与
。由此推测,与
 能形成更稳定配离子的配体是
能形成更稳定配离子的配体是
___________ ,其空间结构是
___________ 。
(4)第IIIA族磷化物均为共价化合物,被广泛用于高温技术、新型电子产品等领域。
①实验测定磷化铝和磷化铟(InP)的熔点分别为2000、1070℃,二者属于___________ 晶体,其熔点差异的主要原因是___________ 。
②磷化硼是一种半导体材料,其晶胞结构如图所示。已知晶胞边长apm,阿伏加德罗常数为 ,则磷化硼晶体的密度是
,则磷化硼晶体的密度是___________  (列出表达式)。
(列出表达式)。
(1)基态磷原子的价层电子排布图为
(2)磷元素有白磷、黑磷等常见的单质。黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体具有与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是

a.黑磷与白磷互为同素异形体 b.层与层之间的作用力是共价键
c.黑磷晶体属于混合型晶体 d.分子中磷原子杂化类型为
 杂化
杂化(3)
 与水会形成黄色的配离子
与水会形成黄色的配离子 ,为避免颜色干扰,常在
,为避免颜色干扰,常在 溶液中加入
溶液中加入 形成无色的
形成无色的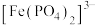 。由此推测,与
。由此推测,与 能形成更稳定配离子的配体是
能形成更稳定配离子的配体是(4)第IIIA族磷化物均为共价化合物,被广泛用于高温技术、新型电子产品等领域。
①实验测定磷化铝和磷化铟(InP)的熔点分别为2000、1070℃,二者属于
②磷化硼是一种半导体材料,其晶胞结构如图所示。已知晶胞边长apm,阿伏加德罗常数为
 ,则磷化硼晶体的密度是
,则磷化硼晶体的密度是 (列出表达式)。
(列出表达式)。
您最近一年使用:0次
22-23高二下·浙江·期中
解题方法
8 . 卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
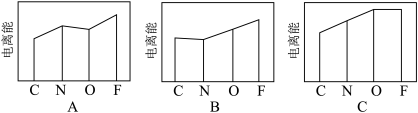
(1)图A、B、C分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同),第一电离能I1的变化图是_______ 。
(2)NE是微电子工业中一种优良的等离子蚀刻气体,NF3分子空间构型为_______ ,NH3的键角约为107°,推测NF3的键角______ 107°(填“>”,“<”或“=”)。
(3)X射线衍射测定等发现,I3AsF6中存在I 离子。I
离子。I 中心原子的杂化方式为
中心原子的杂化方式为_________ 。
(4)萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图所示。若该立方晶胞参数为apm,NA为阿伏加德罗常数:计算品体的密度为_______ g•cm-3(列出表达式)。[注:1皮米(pm)=1.0×10-12米(m)]

(1)图A、B、C分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同),第一电离能I1的变化图是

(2)NE是微电子工业中一种优良的等离子蚀刻气体,NF3分子空间构型为
(3)X射线衍射测定等发现,I3AsF6中存在I
 离子。I
离子。I 中心原子的杂化方式为
中心原子的杂化方式为(4)萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图所示。若该立方晶胞参数为apm,NA为阿伏加德罗常数:计算品体的密度为

您最近一年使用:0次
名校
解题方法
9 . A、B、C、D为原子序数依次增大的四种短周期元素,A2-和B+具有相同的电子层结构,C、D为同周期元素,C元素原子核外电子总数是最外层电子数的3倍;D元素同周期中原子半径最小的元素。回答下列问题:
(1)四种元素中电负性最大的是_______ (填元素符号),其中C原子的核外电子排布式为_______ 。
(2)A的两种单质互为同素异形体,其中沸点高的是_______ (填分子式),原因是_______ ;A和B的氢化物所属的晶体类型分别为_______ 和_______ 。
(3)C和D可按原子个数比为1∶3形成化合物E,E的空间结构为_______ ,中心原子的杂化轨道类型为_______ 。
(4)化合物D2A的空间结构为_______ ,中心原子的价层电子对数为_______ ;
(5)面心立方ZnS晶胞与金刚石的晶胞结构类似,阴、阳离子各占晶胞所含粒子数的一半。
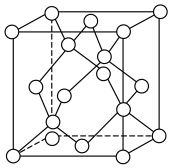
若该ZnS晶胞的晶胞参数为a pm,阿伏加德罗常数的值为NA,则晶体的密度为_______ g·cm-3。
(1)四种元素中电负性最大的是
(2)A的两种单质互为同素异形体,其中沸点高的是
(3)C和D可按原子个数比为1∶3形成化合物E,E的空间结构为
(4)化合物D2A的空间结构为
(5)面心立方ZnS晶胞与金刚石的晶胞结构类似,阴、阳离子各占晶胞所含粒子数的一半。

若该ZnS晶胞的晶胞参数为a pm,阿伏加德罗常数的值为NA,则晶体的密度为
您最近一年使用:0次
名校
解题方法
10 . 元素A、B、C、D、E、F、G在元素周期表中的位置如图所示,回答下列问题:

(1) 的基态原子核外电子排布式为
的基态原子核外电子排布式为___________ 。原子的第一电离能:D___________ E(填“>”或“<”)。
(2)根据价层电子对互斥理论,价层电子对之间的斥力大小有如下顺序: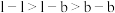 (l为孤电子对,
(l为孤电子对, 为键合电子对),则关于
为键合电子对),则关于 中的
中的 键角可得出的结论是___________。
键角可得出的结论是___________。
(3)化合物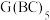 中存在的化学键类型有
中存在的化学键类型有___________ ,它在空气中燃烧生成红棕色氧化物,反应的化学方程式为___________ 。
(4)化合物 的立体构型为
的立体构型为___________ ,其中B原子的杂化轨道类型是___________ ,写出两个与 具有相同立体构型的含氧酸根离子
具有相同立体构型的含氧酸根离子___________ 。

(1)
 的基态原子核外电子排布式为
的基态原子核外电子排布式为(2)根据价层电子对互斥理论,价层电子对之间的斥力大小有如下顺序:
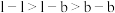 (l为孤电子对,
(l为孤电子对, 为键合电子对),则关于
为键合电子对),则关于 中的
中的 键角可得出的结论是___________。
键角可得出的结论是___________。A. | B.接近 ,但小于 ,但小于 |
C.接近 ,但大于 ,但大于 | D.接近 ,但小于 ,但小于 |
(3)化合物
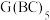 中存在的化学键类型有
中存在的化学键类型有(4)化合物
 的立体构型为
的立体构型为 具有相同立体构型的含氧酸根离子
具有相同立体构型的含氧酸根离子
您最近一年使用:0次



