名校
1 . 卤素单质及其化合物在工农业生产中有着广泛的应用。回答下列问题:
(1)类卤素 对应的酸有两种,硫氰酸(
对应的酸有两种,硫氰酸( )和异硫氰酸(
)和异硫氰酸( ):
):
①硫氰酸和异硫氰酸分子中 键和
键和 键个数之比
键个数之比___________ (填“相等”或“不相等”)。
②异硫氰酸中N的杂化轨道类型是___________ 。
③硫氰酸的电子式为___________ 。
(2) 的VSEPR模型是
的VSEPR模型是___________ , 的中心原子的价层电子对数是
的中心原子的价层电子对数是___________ 。
(3)键角:
___________ (填“>”“<”或“=”) ,判断的理由为
,判断的理由为___________ 。
(4)酸性:三氟乙酸( )
)___________ (填“>”或“<”) ,判断的理由为
,判断的理由为___________ 。
(5) 与水反应的化学方程式为
与水反应的化学方程式为___________ (该反应为非氧化还原反应)。
(1)类卤素
 对应的酸有两种,硫氰酸(
对应的酸有两种,硫氰酸( )和异硫氰酸(
)和异硫氰酸( ):
):①硫氰酸和异硫氰酸分子中
 键和
键和 键个数之比
键个数之比②异硫氰酸中N的杂化轨道类型是
③硫氰酸的电子式为
(2)
 的VSEPR模型是
的VSEPR模型是 的中心原子的价层电子对数是
的中心原子的价层电子对数是(3)键角:

 ,判断的理由为
,判断的理由为(4)酸性:三氟乙酸(
 )
) ,判断的理由为
,判断的理由为(5)
 与水反应的化学方程式为
与水反应的化学方程式为
您最近半年使用:0次
解题方法
2 . 回答下列问题。
(1) 中的化学键属于
中的化学键属于___________ (填“σ”或“π”)键。
(2) 分子中,中心原子上的σ键电子对数为
分子中,中心原子上的σ键电子对数为___________ ,孤电子对数为___________ ,价层电子对数为___________ ,中心原子的杂化方式为___________ ,VSEPR模型为___________ ,分子的空间结构为___________ 。
(3)下列分子中若有手性分子,请用“*”标出其手性碳原子;若无手性分子,此小题不必作答。
(1)
 中的化学键属于
中的化学键属于(2)
 分子中,中心原子上的σ键电子对数为
分子中,中心原子上的σ键电子对数为(3)下列分子中若有手性分子,请用“*”标出其手性碳原子;若无手性分子,此小题不必作答。

您最近半年使用:0次
名校
解题方法
3 .  (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度( 350℃)而成为颇具潜力的化学储氢材料之一,它可通过环硼氨烷、
350℃)而成为颇具潜力的化学储氢材料之一,它可通过环硼氨烷、 与
与 进行合成。
进行合成。
1.上述涉及的元素H、B、C、N、O原子半径最大的是___________ ,电负性最大的是___________ 。
2.键角:
___________  (填“
(填“ ”“
”“ ”或“
”或“ ”),原因是
”),原因是___________ 。
 (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度( 350℃)而成为颇具潜力的化学储氢材料之一,它可通过环硼氨烷、
350℃)而成为颇具潜力的化学储氢材料之一,它可通过环硼氨烷、 与
与 进行合成。
进行合成。1.上述涉及的元素H、B、C、N、O原子半径最大的是
2.键角:

 (填“
(填“ ”“
”“ ”或“
”或“ ”),原因是
”),原因是
您最近半年使用:0次
名校
解题方法
4 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
(1)表中元素,电负性最强的是___________ (填元素符号);J的元素名称为___________ ;N基态原子价电子层上有___________ 个未成对电子。
(2)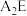 的稳定性比
的稳定性比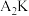
___________ (填写“大”或“小”):原因是___________ 。
(3)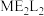 常温下为深红色液体,能与
常温下为深红色液体,能与 、
、 等互溶,据此可判断
等互溶,据此可判断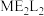 是
是___________ (填“极性”或“非极性”)分子。
(4)① ②
② ③
③ ④
④ ,这四种物质中碳原子采取
,这四种物质中碳原子采取 杂化的是
杂化的是___________ (填序号);乳酸分子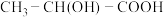 中有
中有___________ 个手性碳原子。
(5)J、K、L元素的电负性由大到小的顺序为___________ (用元素符号表示);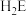 的键角比
的键角比
___________ (填写“大”或“小”):原因是___________ 。

(1)表中元素,电负性最强的是
(2)
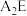 的稳定性比
的稳定性比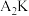
(3)
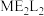 常温下为深红色液体,能与
常温下为深红色液体,能与 、
、 等互溶,据此可判断
等互溶,据此可判断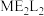 是
是(4)①
 ②
② ③
③ ④
④ ,这四种物质中碳原子采取
,这四种物质中碳原子采取 杂化的是
杂化的是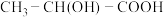 中有
中有(5)J、K、L元素的电负性由大到小的顺序为
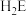 的键角比
的键角比
您最近半年使用:0次
名校
解题方法
5 . 回答下列问题:
(1)甲为石墨晶体,甲说明晶体具有______ ;乙说明晶体具有各向异性而非晶体具有______ ;丙说明晶体的内部微粒排列______ 而非晶体内部微粒排列无序。 中,阴离子空间结构为
中,阴离子空间结构为______ ,C原子的杂化形式为______ 。
(1)甲为石墨晶体,甲说明晶体具有

 中,阴离子空间结构为
中,阴离子空间结构为
您最近半年使用:0次
解题方法
6 . 高氯酸三碳酰肼合镍化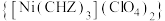 是一种新型的起爆药,回答下列问题:
是一种新型的起爆药,回答下列问题:
(1)基态铜原子的价电子的轨道表示式为________ 。
(2)基态碳原子核外电子有________ 种不同运动状态。
(3) 的中心原子的价层电子对数为
的中心原子的价层电子对数为________ , 的VSEPR模型是
的VSEPR模型是________ 。
(4)化学式中的CHZ为碳酰肼,其结构为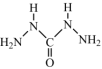 ,是一种新型的环保锅炉水除氧剂:
,是一种新型的环保锅炉水除氧剂:
①CHZ中氮原子的杂化轨道类型为________ 。
②1molCHZ中含有的 键数目为
键数目为________  。
。
③键角:
________ (填“>”“<”或“=”) 。
。
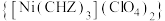 是一种新型的起爆药,回答下列问题:
是一种新型的起爆药,回答下列问题:(1)基态铜原子的价电子的轨道表示式为
(2)基态碳原子核外电子有
(3)
 的中心原子的价层电子对数为
的中心原子的价层电子对数为 的VSEPR模型是
的VSEPR模型是(4)化学式中的CHZ为碳酰肼,其结构为
 ,是一种新型的环保锅炉水除氧剂:
,是一种新型的环保锅炉水除氧剂:①CHZ中氮原子的杂化轨道类型为
②1molCHZ中含有的
 键数目为
键数目为 。
。③键角:

 。
。
您最近半年使用:0次
名校
7 . 前四周期元素X、Y、Z、W原子序数依次增大,X和Z同主族,基态Y原子核外电子的运动状态有9种,基态Z原子4p能级上有三个单电子,常温下W2是一种深红棕色液体。回答下列问题:
(1)基态W原子的价电子排布式为_______ ,基态X、Z原子核外电子的空间运动状态数之比为_______ 。
(2)同周期第一电离能小于X的元素有_______ 种。
(3)键角大小:XY3_______ ZY3(填“>”“=”或“<”,下同),原子半径大小:W_______ Z。
(4)ZY5中Z的价层电子对数为_______ 。
(1)基态W原子的价电子排布式为
(2)同周期第一电离能小于X的元素有
(3)键角大小:XY3
(4)ZY5中Z的价层电子对数为
您最近半年使用:0次
解题方法
8 . 按要求回答下列问题:
(1)前三周期元素中,基态原子核外有7组成对电子的原子,其价层电子的轨道表示式为___________ 。
(2)已知H2O2的沸点为152℃,H2S的沸点-60.4℃。请解释两者沸点差异的原因___________ 。
(3)BF3和NaBF4是硼的重要化合物,微粒中F-B-F键角:BF3___________  (填“>”、“<”或“=” )。理由是
(填“>”、“<”或“=” )。理由是___________ 。
(4)将CH3COOH、FCH2COOH、CH3CH2COOH的酸性由强到弱排序___________ ,并解释原因___________ 。
(1)前三周期元素中,基态原子核外有7组成对电子的原子,其价层电子的轨道表示式为
(2)已知H2O2的沸点为152℃,H2S的沸点-60.4℃。请解释两者沸点差异的原因
(3)BF3和NaBF4是硼的重要化合物,微粒中F-B-F键角:BF3
 (填“>”、“<”或“=” )。理由是
(填“>”、“<”或“=” )。理由是(4)将CH3COOH、FCH2COOH、CH3CH2COOH的酸性由强到弱排序
您最近半年使用:0次
名校
9 . 结合VSEPR理论和杂化轨道理论,判断下列分子的中心原子杂化方式、空间构型。
| 分子 | 中心原子,写元素符号 | 价层电子对数 | 杂化轨道数 | 轨道杂化方式 | 孤电子对数 | 分子的空间构型 |
 | C | 4 | 4 |  | 0 | 正四面体 |
 | ||||||
 | ||||||
 |
您最近半年使用:0次
2024-03-31更新
|
315次组卷
|
2卷引用:北京市十一学校2023-2024学年高一下学期开学考化学试题
解题方法
10 . Cu2O溶于浓氨水中形成无色的[Cu(NH3)2]+,该无色溶液接触空气会很快变成深蓝色。
(1)[Cu(NH3)2]+中NH3的N原子提供___________,与中心离子形成___________。
| A.空轨道、离子键 | B.孤电子对、离子键 |
| C.空轨道、配位键 | D.孤电子对、配位键 |
| A.大于107° | B.小于107° | C.等于107° | D.等于120° |
完成并配平上述离子方程式。
您最近半年使用:0次



