解题方法
1 . 一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为__________ 。
②NO3-的空间构型是____________________________________________ (用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O。
①根据等电子原理,CO分子的结构式为________ 。
②1 mol CO2中含有的σ键数目为____________ 。
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为______________ 。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为
②NO3-的空间构型是
(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O。
①根据等电子原理,CO分子的结构式为
②1 mol CO2中含有的σ键数目为
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为
您最近一年使用:0次
2 . 用价层电子对互斥理论预测下列粒子的立体结构。
(1)H2Se____________ ;
(2)BCl3____________ ;
(3)PCl3____________ ;
(4)CO2____________ ;
(5)SO2____________ ;
(6)SO42-________________ 。
(1)H2Se
(2)BCl3
(3)PCl3
(4)CO2
(5)SO2
(6)SO42-
您最近一年使用:0次
名校
3 . 下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。

根据信息回答下列问题:
(1)周期表中基态Ga原子的最外层电子排布式为____________ 。
(2)Fe元素位于周期表的________ 区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为__________ ;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为________ 和________ (填化学式)。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有________________ 。
(4)根据VSEPR模型预测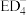 的立体构型为
的立体构型为____________________ 。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子式为_______________ (写2种)。

根据信息回答下列问题:
(1)周期表中基态Ga原子的最外层电子排布式为
(2)Fe元素位于周期表的
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有
(4)根据VSEPR模型预测
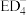 的立体构型为
的立体构型为
您最近一年使用:0次
4 . 碳族元素包括:C、Si、 Ge、 Sn、Pb。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过____ 杂化与周围碳原子成键,多层碳纳米管的层与层之间靠____ 结合在一起。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为____ 。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角___ 120°(填“>”“<”或“=”)。
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为_______ ,每个Ba2+与____ 个O2-配位。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为
您最近一年使用:0次
2019-01-30更新
|
932次组卷
|
7卷引用:云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题
5 . (1)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是__ ,画出配合物离子[Cu(NH3)4]2+中的配位键__ .
(2)根据VSEPR模型,H3O+的立体结构为__ ,BCl3的立体结构为__ .
(3)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式(各写一种)正四面体分子__ ,三角锥形分子__ ,V形分子__
(2)根据VSEPR模型,H3O+的立体结构为
(3)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式(各写一种)正四面体分子
您最近一年使用:0次
6 . 如图是甲醛分子的模型,根据该图和所学化学知识回答下列问题:
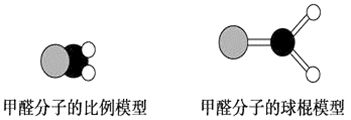
(1)甲醛分子中碳原子的杂化方式是__________ ,作出该判断的主要理由是__________________________ 。
(2)下列是对甲醛分子中碳氧键的判断,其中正确的是________ (填序号)。
①单键 ②双键 ③σ键 ④π键 ⑤σ键和π键
(3)甲醛分子中C—H键与C—H键间的夹角________ (填“=”、“>”或“<”)120°,出现该现象的主要原因是____________________________________________ 。

(1)甲醛分子中碳原子的杂化方式是
(2)下列是对甲醛分子中碳氧键的判断,其中正确的是
①单键 ②双键 ③σ键 ④π键 ⑤σ键和π键
(3)甲醛分子中C—H键与C—H键间的夹角
您最近一年使用:0次
2018-12-15更新
|
1555次组卷
|
8卷引用:云南省河口县一中2018-2019学年高二上学期期中考试化学试题
云南省河口县一中2018-2019学年高二上学期期中考试化学试题云南省昭通市彝良县第一中学2018-2019学年高二上学期12月考试化学试题贵州省从江县第一民族中学2018-2019学年高二上学期期末考试化学试题(已下线)专题11.2 分子结构与性质(练)-《2020年高考一轮复习讲练测》(人教版2019)选择性必修2 阶段性综合评估测试卷(一)鲁科版2019选择性必修2阶段性综合评估测试卷(一)高二选择性必修2(人教版2019)第二章 分子结构与性质 第二节综合训练(已下线)2.2.2 杂化轨道理论简介-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)
名校
7 . 氮(N)、磷(P)、砷(As)等都是VA族元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)As原子的价电子排布式为____________ 。
(2)P和S是同一周期的两种元素,P的第一电离能比S大,原因是________________ 。
(3)NH4+中H—N—H的键角比NH3分子中的键角________ (填“大”或“小”),原因是____________ 。
(4)NaAsO4中含有的化学键类型包括__________ ;AsO43-的空间构型为_____________ ;As4O6的分子结构如下图所示,则在该化合物中As原子的杂化方式是____________ 。
(5)2017年1月27日,我国科学家在《Science》杂质上发表论文,在全氮阴离子盐合成上取得重大进展,首次制得试问下稳定,含有N5-离子的盐(具有超高能量密度的化合物),N5-离子中氮元素的平均化合价为_____ 。
(6)白磷(P)的晶体属于分子晶体,其晶胞结构如下图(小圆圈表示白磷分子)。该晶胞中含有的P原子数为_______ ;已知该晶胞的边长为a cm,阿伏伽德罗常数为NAmol-1,则该晶体的密度为_____ g·cm-3(用含有NA的式子表示)
(1)As原子的价电子排布式为
(2)P和S是同一周期的两种元素,P的第一电离能比S大,原因是
(3)NH4+中H—N—H的键角比NH3分子中的键角
(4)NaAsO4中含有的化学键类型包括

(5)2017年1月27日,我国科学家在《Science》杂质上发表论文,在全氮阴离子盐合成上取得重大进展,首次制得试问下稳定,含有N5-离子的盐(具有超高能量密度的化合物),N5-离子中氮元素的平均化合价为
(6)白磷(P)的晶体属于分子晶体,其晶胞结构如下图(小圆圈表示白磷分子)。该晶胞中含有的P原子数为

您最近一年使用:0次



