名校
解题方法
1 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
(1)表中元素,电负性最强的是___________ (填元素符号);J的元素名称为___________ ;N基态原子价电子层上有___________ 个未成对电子。
(2)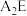 的稳定性比
的稳定性比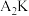
___________ (填写“大”或“小”):原因是___________ 。
(3)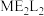 常温下为深红色液体,能与
常温下为深红色液体,能与 、
、 等互溶,据此可判断
等互溶,据此可判断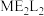 是
是___________ (填“极性”或“非极性”)分子。
(4)① ②
② ③
③ ④
④ ,这四种物质中碳原子采取
,这四种物质中碳原子采取 杂化的是
杂化的是___________ (填序号);乳酸分子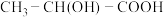 中有
中有___________ 个手性碳原子。
(5)J、K、L元素的电负性由大到小的顺序为___________ (用元素符号表示);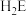 的键角比
的键角比
___________ (填写“大”或“小”):原因是___________ 。

(1)表中元素,电负性最强的是
(2)
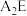 的稳定性比
的稳定性比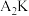
(3)
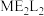 常温下为深红色液体,能与
常温下为深红色液体,能与 、
、 等互溶,据此可判断
等互溶,据此可判断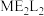 是
是(4)①
 ②
② ③
③ ④
④ ,这四种物质中碳原子采取
,这四种物质中碳原子采取 杂化的是
杂化的是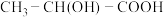 中有
中有(5)J、K、L元素的电负性由大到小的顺序为
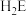 的键角比
的键角比
您最近一年使用:0次
2 . I.铁(26Fe)、镍(28Ni)的单质及其化合物在医药、材料等领域有广泛的应用。回答下列问题:
(1)基态Fe原子核外电子排布式为______ ,Ni位于元素周期表的_______ 区。
(2)乳酸亚铁口服液是缺铁人群补铁保健品,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度分析,Fe2+易被氧化成Fe3+的原因是______ 。
II.回答下列问题:
(3)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为______ ,中心原子的杂化方式为_______ ,COCl2中心原子的VSEPR模型为_______ ,COCl2分子的空间构型为______ 。
(4)As4O6的分子结构如图所示,其中As原子的杂化方式为______ 。

(5)AlH 中,Al原子的轨道杂化方式为
中,Al原子的轨道杂化方式为_____ ;列举与AlH 空间构型相同的一种离子和一种分子:
空间构型相同的一种离子和一种分子:______ 、______ (填化学式)。
(6)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为_______ ,SnBr2分子中Br-Sn-Br的键角_______ 120°(填“>”“<”或“=”)。
(1)基态Fe原子核外电子排布式为
(2)乳酸亚铁口服液是缺铁人群补铁保健品,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度分析,Fe2+易被氧化成Fe3+的原因是
II.回答下列问题:
(3)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为
(4)As4O6的分子结构如图所示,其中As原子的杂化方式为

(5)AlH
 中,Al原子的轨道杂化方式为
中,Al原子的轨道杂化方式为 空间构型相同的一种离子和一种分子:
空间构型相同的一种离子和一种分子:(6)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为
您最近一年使用:0次
名校
解题方法
3 . 叠氮化钠(NaN3)是一种无色结晶,广泛用于汽车安全气囊及化工合成等.常见的两种制备方法为:2NaNH2+N2O=NaN3+NaOH+NH3、3NaNH2+NaNO3=NaN3+3NaOH+NH3↑
(1)下列说法正确的是________ .
A. N3-与N2O互为等电子体
B. NaN3、NaNH2、NaOH、NaNO3均为离子化合物
C. NaNH2熔点(210℃)比NaOH 熔点(318.4℃)低,是因为前者相对分子质量小
(2)NH3沸点(﹣33.34℃)比N2O沸点(﹣88.49℃)高,其主要原因:________
(3)依据价层电子对互斥理论,NO3-空间构型呈________ 形。
(1)下列说法正确的是
A. N3-与N2O互为等电子体
B. NaN3、NaNH2、NaOH、NaNO3均为离子化合物
C. NaNH2熔点(210℃)比NaOH 熔点(318.4℃)低,是因为前者相对分子质量小
(2)NH3沸点(﹣33.34℃)比N2O沸点(﹣88.49℃)高,其主要原因:
(3)依据价层电子对互斥理论,NO3-空间构型呈
您最近一年使用:0次
名校
解题方法
4 . 甲醛分子(CH2O)的中心原子(碳原子)的价层电子对数为________ ,其孤电子对数为________ ,则该分子呈________ 形。甲醛分子的中心原子的杂化类型为________ ,分子中共有________ 个σ键,有________ 个π键,其中C﹣H的σ键的类型为________ ,C﹣O的σ键的类型为________
您最近一年使用:0次
名校
5 . 根据已学《物质结构与性质》的有关知识,回答下列问题:
(1)如图所示是元素周期表中第一、第二周期10种元素的某些性质的一组数据(所列数据的单位相同),除带“…”的四种元素外,其余元素都给出了该种元素的全部该类数据。
有些元素的逐级电离能中个别地方增大的比例(倍数)特别大,形成“突跃”,由此可以证明原子结构中_______________________ 的结论。根据这个规律,你认为氧元素8个电离能数据中出现“突跃”的数据应该是第________ 个。
(2)在①苯 ②CH3OH ③HCHO ④CS2 ⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有_____ (填序号),易溶于水的有_____ (填序号),理由是:____________ 。
(3)N≡N键的键能为946kJ·mol-1,N—N键的键能为193kJ·mol-1,则一个π键的平均键能为__________ ,说明N2中________ 键更稳定(填“σ”或“π”)。
(4)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关化学反应的离子方程式___________ 、____________ 。
(1)如图所示是元素周期表中第一、第二周期10种元素的某些性质的一组数据(所列数据的单位相同),除带“…”的四种元素外,其余元素都给出了该种元素的全部该类数据。
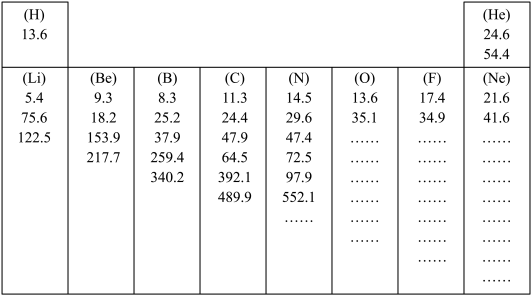
有些元素的逐级电离能中个别地方增大的比例(倍数)特别大,形成“突跃”,由此可以证明原子结构中
(2)在①苯 ②CH3OH ③HCHO ④CS2 ⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有
(3)N≡N键的键能为946kJ·mol-1,N—N键的键能为193kJ·mol-1,则一个π键的平均键能为
(4)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关化学反应的离子方程式
您最近一年使用:0次
2010·山东·高考真题
6 . 碳族元素包括:C、Si、 Ge、 Sn、Pb。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过____ 杂化与周围碳原子成键,多层碳纳米管的层与层之间靠____ 结合在一起。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为____ 。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角___ 120°(填“>”“<”或“=”)。
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为_______ ,每个Ba2+与____ 个O2-配位。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为
您最近一年使用:0次
2019-01-30更新
|
932次组卷
|
7卷引用:09~10年银川一中高二下学期期末考试化学卷
名校
7 . 在HF、H2O、NH3、CS2、CH4、N2、BF3分子中:
(1)以非极性键结合的非极性分子是________ ;
(2)以极性键结合的具有直线形结构的非极性分子是________ ;
(3)以极性键结合的具有正四面体形结构的非极性分子是________ ;
(4)以极性键结合的具有三角锥形结构的极性分子是________ ;
(5)以极性键结合的具有sp3杂化轨道结构的分子是________ ;
(6)以极性键结合的具有sp2杂化轨道结构的分子是________ 。
(1)以非极性键结合的非极性分子是
(2)以极性键结合的具有直线形结构的非极性分子是
(3)以极性键结合的具有正四面体形结构的非极性分子是
(4)以极性键结合的具有三角锥形结构的极性分子是
(5)以极性键结合的具有sp3杂化轨道结构的分子是
(6)以极性键结合的具有sp2杂化轨道结构的分子是
您最近一年使用:0次
2018-04-24更新
|
513次组卷
|
6卷引用:宁夏银川市唐徕回民中学2017-2018学年高二4月月考化学试题
宁夏银川市唐徕回民中学2017-2018学年高二4月月考化学试题四川省南充高级中学2020-2021学年高二上学期第二次月考化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 学科素养提升鲁科版2019选择性必修2第2章 微粒间相互作用与物质性质 第2章学科素养提升(已下线)2.3.1 共价键的极性 范德华力-2021-2022学年高二化学同步课时跟踪训练(人教版2019选择性必修2)(已下线)第二章 分子结构与性质(A卷)
名校
8 . 指出下列分子的空间构型;
(1)OF2____________ ;(2)BeF2_____________ ;
(3)PF3____________ ;(4)BrO3-______________ 。
(1)OF2
(3)PF3
您最近一年使用:0次



