名校
1 . 回答下列问题
(1)按要求填空:
①CO2的电子式为:____________________
②基态N原子的轨道表示为________________________________________ ;
③基态Ga原子价电子层的电子排布式为_____________________________ ;
(2)对于A.MgO B.He C.NH3 D.CaO E.干冰 F.Ar五种物质:
①熔沸点最低的是________ ;液态时能导电的是________ (填字母编号)。
②上述物质所含的元素中,基态原子含单电子最多的元素是______ (填元素符号)。
③上述物质的晶体中,属于离子晶体且熔点最高的是____________ (填字母编号)。
④上述物质的晶体熔化时,所克服的微粒间的作用力与冰熔化时所克服的作用力类型完全相同的是______ (填字母编号)。
(3)已知熔融的BeCl2不导电,则BeCl2属于_______ 晶体,中心原子的杂化类型为______ 。
(1)按要求填空:
①CO2的电子式为:
②基态N原子的轨道表示为
③基态Ga原子价电子层的电子排布式为
(2)对于A.MgO B.He C.NH3 D.CaO E.干冰 F.Ar五种物质:
①熔沸点最低的是
②上述物质所含的元素中,基态原子含单电子最多的元素是
③上述物质的晶体中,属于离子晶体且熔点最高的是
④上述物质的晶体熔化时,所克服的微粒间的作用力与冰熔化时所克服的作用力类型完全相同的是
(3)已知熔融的BeCl2不导电,则BeCl2属于
您最近一年使用:0次
2022-12-20更新
|
286次组卷
|
2卷引用:广东省梅州市大埔县实验中学2021-2022学年高二下学期第一次段考(4月)化学试题
名校
解题方法
2 . 工业上可以用NaCl溶液制取重要的化工原料纯碱,此化工流程还需要一定量的CO2和NH3。
(1)NH3的分子构型是_______ ,用电子式表示NH3分子的形成过程_______ 。
(2)工业上合成氨气需要使用氮气,氮原子的结构示意图是_______ ,氮气分子的结构式是_______ 。
(3)羰基硫COS的分子构型与CO2分子相似,可以看作CO2分子中的1个氧原子被硫原子取代。COS的电子式是_______ ,它是_______ (填“极性”或“非极性”)分子。
(1)NH3的分子构型是
(2)工业上合成氨气需要使用氮气,氮原子的结构示意图是
(3)羰基硫COS的分子构型与CO2分子相似,可以看作CO2分子中的1个氧原子被硫原子取代。COS的电子式是
您最近一年使用:0次
名校
解题方法
3 . 请根据所学知识点,完成以下填空。
(1)基态P原子的价电子轨道表示式_______ 。
(2)基态K原子的简化电子排布式为_______ ,其能量最高的电子所在的能级是_______ ,该能级的原子轨道呈_______ 形。
(3)基态Ni原子核外电子的运动状态有_______ 种,基态 中未成对的电子数与成对电子数之比为
中未成对的电子数与成对电子数之比为_______ 。
(4) 的VSEPR模型和空间构型分别为
的VSEPR模型和空间构型分别为_______ 、_______ 。
(5)一氯乙烷( )和四氟乙烯(
)和四氟乙烯( )分子中C的杂化轨道类型分别为
)分子中C的杂化轨道类型分别为_______ 和_______ 。
(6) 分子中各原子都满足最外层8电子结构,分子中σ键与π键数目之比为
分子中各原子都满足最外层8电子结构,分子中σ键与π键数目之比为_______ , 分子为
分子为_______ (填“极性分子”或“非极性分子”)。
(1)基态P原子的价电子轨道表示式
(2)基态K原子的简化电子排布式为
(3)基态Ni原子核外电子的运动状态有
 中未成对的电子数与成对电子数之比为
中未成对的电子数与成对电子数之比为(4)
 的VSEPR模型和空间构型分别为
的VSEPR模型和空间构型分别为(5)一氯乙烷(
 )和四氟乙烯(
)和四氟乙烯( )分子中C的杂化轨道类型分别为
)分子中C的杂化轨道类型分别为(6)
 分子中各原子都满足最外层8电子结构,分子中σ键与π键数目之比为
分子中各原子都满足最外层8电子结构,分子中σ键与π键数目之比为 分子为
分子为
您最近一年使用:0次
2022-12-15更新
|
396次组卷
|
2卷引用:重庆市第八中学校2022-2023学年高二上学期第二次月考化学试题
4 . 回答下列问题:
(1)两种有机物的相关数据如表:
HCON(CH3)2的相对分子质量比HCONH2的大,但其沸点反而比HCONH2的低,主要原因是_______ 。
(2)四种晶体的熔点数据如表:
CF4和SiF4熔点相差较小,BF3和AlF3熔点相差较大,原因是_______ 。
(3)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_______ 。
(4)气态三氧化硫以单分子形式存在,其分子的空间结构为_______ 形,其中共价键的类型有_______ 种;固体三氧化硫中存在如图所示的三聚分子,该分子中S原子的杂化轨道类型为_______ 。

(1)两种有机物的相关数据如表:
| 物质 | HCON(CH3)2 | HCONH2 |
| 相对分子质量 | 73 | 45 |
| 沸点/℃ | 153 | 220 |
HCON(CH3)2的相对分子质量比HCONH2的大,但其沸点反而比HCONH2的低,主要原因是
(2)四种晶体的熔点数据如表:
| 物质 | CF4 | SiF4 | BF3 | AlF3 |
| 熔点/℃ | -183 | -90 | -127 | >1000 |
CF4和SiF4熔点相差较小,BF3和AlF3熔点相差较大,原因是
(3)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是
(4)气态三氧化硫以单分子形式存在,其分子的空间结构为

您最近一年使用:0次
名校
5 . 回答下列问题:
(1)根据价层电子对互斥模型, 分子中心原子孤电子对数是
分子中心原子孤电子对数是_______ , 分子的空间构型是
分子的空间构型是_______ 。
(2)气态三氧化硫以单分子形式存在,属于_______ 分子(填“极性”、“非极性”),固体三氧化硫中存在如图所示的三聚分子,该分子中S原子的杂化轨道类型为_______ 。
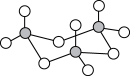
(3) 中心原子的价层电子对数为
中心原子的价层电子对数为_______ ,写出一个与 VEEPR模型相同的离子
VEEPR模型相同的离子_______ 。
(4)下列表述中,不能证明氯的非金属性比硫强的是_______ 。
A.气态氢化物的稳定性:
B.两元素的电负性: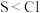
C.高价含氧酸的酸性: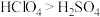
D.常温时,硫单质为固态,氯单质为气态
E.两者间可发生反应: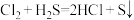
(1)根据价层电子对互斥模型,
 分子中心原子孤电子对数是
分子中心原子孤电子对数是 分子的空间构型是
分子的空间构型是(2)气态三氧化硫以单分子形式存在,属于

(3)
 中心原子的价层电子对数为
中心原子的价层电子对数为 VEEPR模型相同的离子
VEEPR模型相同的离子(4)下列表述中,不能证明氯的非金属性比硫强的是
A.气态氢化物的稳定性:

B.两元素的电负性:
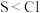
C.高价含氧酸的酸性:
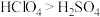
D.常温时,硫单质为固态,氯单质为气态
E.两者间可发生反应:
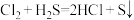
您最近一年使用:0次
解题方法
6 .  (直线形分子)、
(直线形分子)、 (平面三角形分子)、
(平面三角形分子)、 (正四面体型分子)都是非极性分子,
(正四面体型分子)都是非极性分子, (三角锥型分子)、
(三角锥型分子)、 (V形分子)、
(V形分子)、 (V形分子)都是极性分子。请分析什么样的
(V形分子)都是极性分子。请分析什么样的 型分子为非极性分子
型分子为非极性分子_______ 。
 (直线形分子)、
(直线形分子)、 (平面三角形分子)、
(平面三角形分子)、 (正四面体型分子)都是非极性分子,
(正四面体型分子)都是非极性分子, (三角锥型分子)、
(三角锥型分子)、 (V形分子)、
(V形分子)、 (V形分子)都是极性分子。请分析什么样的
(V形分子)都是极性分子。请分析什么样的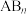 型分子为非极性分子
型分子为非极性分子
您最近一年使用:0次
2022-11-25更新
|
64次组卷
|
2卷引用:苏教2020版选择性必修2专题4第一单元 分子的空间结构课后习题
名校
解题方法
7 . A~H元素在周期表中的位置如图所示,回答下列问题:

(1)G是地壳中含量第5的元素,在地壳中全部以化合态存在,其化合物的焰色反应为砖红色,这与G原子核外电子发生跃迁______ (填“吸收”或“释放”)能量有关。
(2)第一电离能介于C、D之间的第二周期元素有_______ 种。
(3)H被称为“人类的第三金属”,与H同周期且其基态原子的未成对电子数与H原子相同的元素另有_______ 种。
(4)D的某种氢化物(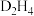 )可用作火箭燃料,燃烧时发生的反应是:
)可用作火箭燃料,燃烧时发生的反应是: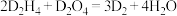 ,若该反应中有
,若该反应中有 电子转移,则形成的
电子转移,则形成的 键有
键有_______  。
。
(5) 是有机合成中常用的还原剂,
是有机合成中常用的还原剂,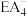 中E元素基态原子的价层电子轨道表示式为
中E元素基态原子的价层电子轨道表示式为______ ;离子半径:
______  (填“
(填“ ”或“
”或“ ”);
”); 中不存在
中不存在______ (填字母)。
A.离子键 B.共价键 C. 键 D.
键 D. 键 E.氢键
键 E.氢键
(6)F元素能形成多种含氧酸及盐,其中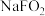 是常用的消毒剂,其酸根离子
是常用的消毒剂,其酸根离子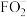 的价层电子对数为
的价层电子对数为______ ,空间构型为______ 。

(1)G是地壳中含量第5的元素,在地壳中全部以化合态存在,其化合物的焰色反应为砖红色,这与G原子核外电子发生跃迁
(2)第一电离能介于C、D之间的第二周期元素有
(3)H被称为“人类的第三金属”,与H同周期且其基态原子的未成对电子数与H原子相同的元素另有
(4)D的某种氢化物(
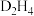 )可用作火箭燃料,燃烧时发生的反应是:
)可用作火箭燃料,燃烧时发生的反应是: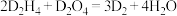 ,若该反应中有
,若该反应中有 电子转移,则形成的
电子转移,则形成的 键有
键有 。
。(5)
 是有机合成中常用的还原剂,
是有机合成中常用的还原剂,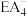 中E元素基态原子的价层电子轨道表示式为
中E元素基态原子的价层电子轨道表示式为
 (填“
(填“ ”或“
”或“ ”);
”); 中不存在
中不存在A.离子键 B.共价键 C.
 键 D.
键 D. 键 E.氢键
键 E.氢键(6)F元素能形成多种含氧酸及盐,其中
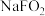 是常用的消毒剂,其酸根离子
是常用的消毒剂,其酸根离子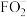 的价层电子对数为
的价层电子对数为
您最近一年使用:0次
8 . 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)B的基态原子中能量最高的电子,其电子云在空间有___ 个方向,原子轨道呈____ 形。
(2)某同学根据上述信息,推断C基态原子的核外电子排布图为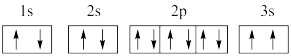 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了_____________________ 。
(3)G位于______ 族______ 区。
(4)检验F元素的实验方法是_________________ 。
(5)BA3中心原子杂化轨道类型为___________ ;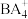 VSEPR模型为
VSEPR模型为___________ ;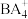 空间结构为
空间结构为_______________ 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1个 |
| C元素原子的第一至第四电离能分别是: I1=738 kJ·mol-1;I2=1 451 kJ·mol-1;I3=7 733 kJ·mol-1;I4=10 540 kJ·mol-1 |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(1)B的基态原子中能量最高的电子,其电子云在空间有
(2)某同学根据上述信息,推断C基态原子的核外电子排布图为
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了(3)G位于
(4)检验F元素的实验方法是
(5)BA3中心原子杂化轨道类型为
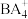 VSEPR模型为
VSEPR模型为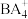 空间结构为
空间结构为
您最近一年使用:0次
2022高三·全国·专题练习
解题方法
9 . 芦笋中的天冬酰胺(结构如下图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。
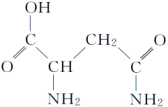
(1)天冬酰胺所含元素中,_______ (填元素名称)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型有_______ 种。
(3)H2S和H2Se的参数对比见下表。
①H2Se的晶体类型为_______ ,含有的共价键类型为_______ 。
②H2S的键角大于H2Se的原因可能为_______ 。
(4)常温常压下,SeF6为无色气体,常用作氟化剂。SeF6中心原子的价层电子对数为_______ 。含s、p、d轨道的杂化类型有:①dsp2;②sp3d;③d2sp3.下列对SeF6中心原子杂化方式推断合理的是_______ (填标号)。

(1)天冬酰胺所含元素中,
(2)天冬酰胺中碳原子的杂化轨道类型有
(3)H2S和H2Se的参数对比见下表。
| 化学式 | 键长/nm | 键角 | 沸点/℃ |
| H2S | 1.34 | 92.3° | -60.75 |
| H2Se | 1.47 | 91.0° | -41.50 |
②H2S的键角大于H2Se的原因可能为
(4)常温常压下,SeF6为无色气体,常用作氟化剂。SeF6中心原子的价层电子对数为
您最近一年使用:0次
2022高三·全国·专题练习
10 . 完成下列问题。
(1)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为_______ ,下列对XeF2中心原子杂化方式推断合理的是_______ (填标号)。
A.sp B.sp2 C.sp3 D.sp3d
(2)SiCl4可发生水解反应,机理如下:

含s、p、d轨道的杂化类型有:①dsp2;②sp3d;③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为_______ (填标号)。
(1)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为
A.sp B.sp2 C.sp3 D.sp3d
(2)SiCl4可发生水解反应,机理如下:

含s、p、d轨道的杂化类型有:①dsp2;②sp3d;③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为
您最近一年使用:0次



