解题方法
1 . W、R、X、Y、Z是原子序数依次增大的前四周期元素,其元素性质或原子结构如下表:
请按要求填空:
(1)Y的基态原子有_______ 种不同的运动状态的电子,Z的价电子排布图为______ 。
(2)W、R、X的简单氢化物中,键角由大到小排列的是___________ (用对应的分子式表示),原因是___________ 。
(3)已知:羧酸的酸性可用pKa(pKa=−lgKa)的大小来衡量,pKa越小,酸性越强。
由表可见,酸性:三氯乙酸___________ 三氟乙酸(填“大于”“小于”或“等于”),从键的极性角度解释原因:___________ 。
| 元素 | 元素性质或原子结构 |
| W | 基态原子L能层所有能级上电子数相同 |
| R | 第二周期元素基态原子中未成对电子最多 |
| X | 基态原子核外s能级上电子总数与p能级上电子总数相等,且第一电离能低于同周期相邻元素 |
| Y | 次外层电子数是最外层电子数的2倍 |
| Z | 最外层只有1个电子,其他内层各能级所有轨道电子均成对 |
(1)Y的基态原子有
(2)W、R、X的简单氢化物中,键角由大到小排列的是
(3)已知:羧酸的酸性可用pKa(pKa=−lgKa)的大小来衡量,pKa越小,酸性越强。
| 羧酸 | pKa |
| 三氯乙酸(CCl3COOH) | 0.65 |
| 三氟乙酸(CF3COOH) | 0.23 |
您最近一年使用:0次
21-22高二下·全国·单元测试
解题方法
2 . 回答下列问题:
(1)在BBr3分子中,Br-B-Br的键角是_____ 。
(2)羰基硫(COS)与CO2的结构相似,羰基硫(COS)分子的结构式为______ ;光气(COCl2)各原子最外层都满足8电子稳定结构,则光气分子的空间构型为______ (用文字描述)。
(3)NO 的立体构型是
的立体构型是_____ 。
(4)KNO3中NO 的空间构型为
的空间构型为______ ,写出与NO 结构相同的一种阴离子的化学式
结构相同的一种阴离子的化学式_____ 。
(5)用价层电子对互斥模型推断SnBr2分子中Sn-Br键的键角_____ 120°(填“>”“<”或“=”)。
(1)在BBr3分子中,Br-B-Br的键角是
(2)羰基硫(COS)与CO2的结构相似,羰基硫(COS)分子的结构式为
(3)NO
 的立体构型是
的立体构型是(4)KNO3中NO
 的空间构型为
的空间构型为 结构相同的一种阴离子的化学式
结构相同的一种阴离子的化学式(5)用价层电子对互斥模型推断SnBr2分子中Sn-Br键的键角
您最近一年使用:0次
2020·湖南衡阳·一模
解题方法
3 . 钛酸锌(ZnTiO3)是一种抗菌涂料,应用于人造骨骼等生物移植技术。回答下列问题:
(1)基态Zn原子的电子占据能量最高的能层符号为_____________ ,与Zn同周期的所有副族元素的基态原子中,最外层电子数与Zn相同的元素有___________ 种
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C____ B(选填“>或“<”);第一电离能N>O,原因是__________________________________________ 。
(3)ZnTiO3与80%H2SO4反应可生成TiOSO4。
① 的空间构型为
的空间构型为_____________ ,其中硫原子采用____________ 杂化。
②与 互为等电子体的分子的化学式为
互为等电子体的分子的化学式为_________________ (任写一种即可)
(4)Zn与S所形成化合物晶体的晶胞如图所示。

①与Zn原子距离最近的Zn原子有___________ 个。
②该化合物的化学式为_________________________________ 。
③已知该晶体的晶胞参数为a×10-12m,阿伏加 德罗常数为NA。则该晶体的密度为__________________ g/cm3(列式即可)
(1)基态Zn原子的电子占据能量最高的能层符号为
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C
(3)ZnTiO3与80%H2SO4反应可生成TiOSO4。
①
 的空间构型为
的空间构型为②与
 互为等电子体的分子的化学式为
互为等电子体的分子的化学式为(4)Zn与S所形成化合物晶体的晶胞如图所示。

①与Zn原子距离最近的Zn原子有
②该化合物的化学式为
③已知该晶体的晶胞参数为a×10-12m,阿伏加 德罗常数为NA。则该晶体的密度为
您最近一年使用:0次
4 . (1)①LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是_________ 、中心原子的杂化形式为________ 。LiAlH4中,存在_________ (填标号)。
a.离子键 b. 键 c.
键 c. 键 d.氢键
键 d.氢键
②Li2O是离子晶体,其晶格能可通过如图的Born— Haber循环计算得到。
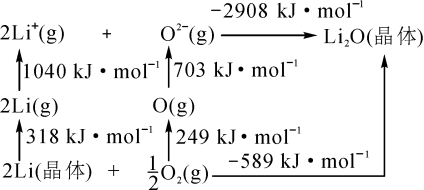
可知,Li原子的第一电离能为_________ kJ·mol-1,O=O键键能为__________ kJ·mol-1,Li2O晶格能为_________ kJ·mol-1
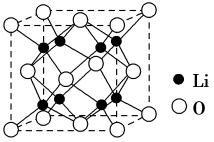
③Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.465 nm,阿伏加 德罗常数的值为NA,则Li2O的密度为___________ g·cm-3(列出计算式)。
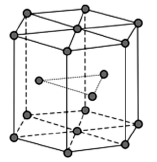
(2)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______ 。六棱柱底边边长为a cm,高为c cm,阿伏加 德罗常数的值为NA,Zn的密度为______ g·cm-3(列出计算式)。
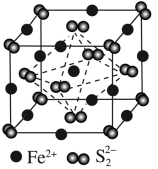
(3)FeS2晶体的晶胞如图所示。晶胞边长为a nm,FeS2相对式量为M,阿伏加 德罗常数的值为NA,其晶体密度的计算表达式为____________ g·cm-3;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为____________ nm。
a.离子键 b.
 键 c.
键 c. 键 d.氢键
键 d.氢键②Li2O是离子晶体,其晶格能可通过如图的Born— Haber循环计算得到。
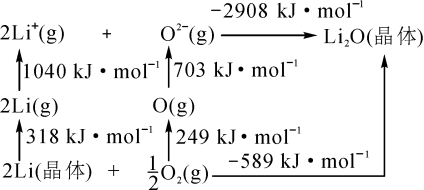
可知,Li原子的第一电离能为
③Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.465 nm,阿伏加 德罗常数的值为NA,则Li2O的密度为

(2)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为

(3)FeS2晶体的晶胞如图所示。晶胞边长为a nm,FeS2相对式量为M,阿伏加 德罗常数的值为NA,其晶体密度的计算表达式为

您最近一年使用:0次
解题方法
5 . X、Y、Z、J、Q、W为前四周期元素,原子序数依次增大。元素Y在地壳中含量最高,W的一种常见高价氧化物是红棕色粉末,常用于油漆、涂料、油墨的红色染料,25℃X、Z、J、Q的最高价氧化物对应水化物溶液(浓度均为0.01mol·L-1)的pH与原子序数的关系如图所示。

根据上述信息进行判断,并回答下列问题:
(1)W在周期表中的位置__ 。比较X、Y、Z的简单离子半径大小为__ <____ <__ (用离子符号表示);
(2)元素的非金属性Y__ J(填“>”或“<”)。下列各项中,不能说明这一结论的有__ (填序号)。
A.J的氢化物的水溶液放置在空气中会变浑浊
B.Y与J之间形成的化合物中元素的化合价。
C.Y和J的单质的状态
D.Y和J在周期表中的位置
(3)X、J、Q这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是_____ (填化学式);酸根呈三角锥结构的酸是___ (填化学式)。
(4)Y和Q形成的化合物Q2Y的立体构型为__ ,Q的单质与湿润的Na2CO3反应可制备Q2Y,其化学方程式为___ 。

根据上述信息进行判断,并回答下列问题:
(1)W在周期表中的位置
(2)元素的非金属性Y
A.J的氢化物的水溶液放置在空气中会变浑浊
B.Y与J之间形成的化合物中元素的化合价。
C.Y和J的单质的状态
D.Y和J在周期表中的位置
(3)X、J、Q这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是
(4)Y和Q形成的化合物Q2Y的立体构型为
您最近一年使用:0次
2019-11-28更新
|
306次组卷
|
2卷引用:人教版高中化学选修3第二章《分子结构与性质》测试题2
6 . 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两种元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D四种元素电负性由大到小排列顺序为_____________________ 。
(2)B的氢化物的结构式_____________ ,其空间构型为_________________________ 。
(3)E核外电子排布式是_________ ,E的某种化合物的结构如下图所示。
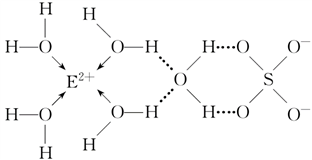
微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有___________ 。
(4)A与B的气态氢化物的沸点______ 更高,A与D的气态氢化物的沸点________ 更高。
(5)A的稳定氧化物中,中心原子的杂化类型为______ ,空间构型为______ 。
(1)A、B、C、D四种元素电负性由大到小排列顺序为
(2)B的氢化物的结构式
(3)E核外电子排布式是

微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有
(4)A与B的气态氢化物的沸点
(5)A的稳定氧化物中,中心原子的杂化类型为
您最近一年使用:0次
2018-02-10更新
|
1015次组卷
|
6卷引用:人教版2017-2018学年高二化学选修三同步训练:第二章 分子结构与性质
人教版2017-2018学年高二化学选修三同步训练:第二章 分子结构与性质(已下线)模块同步卷07 第二章综合检测-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)(人教版2019)选择性必修2 模块综合测评山西省怀仁市大地学校2020-2021学年高二下学期第三次月考化学试题四川省安岳县兴隆中学高2021-2022学年 高二上学期10月月考化学试题 贵州省凯里学院附属中学2021-2022学年高二下学期3月月考化学试题
7 . M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为______ ,晶体中原子间通过_____ 作用形成面心立方密堆积,其中M原子的配位数为______ 。
(2)元素Y基态原子的核外电子排布式为________ ,其同周期元素中,第一电离能最大的是______ (写元素符号)。元素Y的含氧酸中,酸性最强的是________ (写化学式),该酸根离子的立体构型为________ 。
(3)M与Y形成的一种化合物的立方晶胞如图所示。
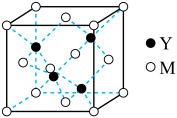
①该化合物的化学式为_______ ,已知晶胞参数a=0.542 nm,此晶体的密度为_______ g·cm–3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是________ 。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______ 。
(1)单质M的晶体类型为
(2)元素Y基态原子的核外电子排布式为
(3)M与Y形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为
②该化合物难溶于水但易溶于氨水,其原因是
您最近一年使用:0次
2016-12-09更新
|
1230次组卷
|
8卷引用:第3章 物质的聚集状态与物质性质——C挑战区 模拟高考(鲁科版选修3)



