名校
解题方法
1 . 硅烷广泛应用在现代高科技领域。
制备硅烷的反应为 。
。
(1)①基态硅原子的价层电子轨道表示式为___________ 。
② 中,硅的化合价为+4价。硅显正化合价的原因是
中,硅的化合价为+4价。硅显正化合价的原因是___________ 。
③下列说法正确的是___________ (填字母)。
a. 的稳定性比
的稳定性比 的差
的差
b. 中4个
中4个 的键长相同,
的键长相同, 的键角为
的键角为
c. 中硅原子以4个
中硅原子以4个 杂化轨道分别与4个氢原子的
杂化轨道分别与4个氢原子的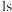 轨道重叠,形成4个
轨道重叠,形成4个 键
键
④ 的沸点(-86℃)高于
的沸点(-86℃)高于 的沸点(-112℃),原因是
的沸点(-112℃),原因是___________ 。
(2) 的晶胞结构如图所示,晶胞的体积为
的晶胞结构如图所示,晶胞的体积为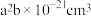 。
。 的
的 模型名称为
模型名称为___________ 。
②用 表示阿伏伽德罗常数的值。
表示阿伏伽德罗常数的值。 晶体密度为
晶体密度为___________  (用含
(用含 、
、 、
、 的代数式表示)。
的代数式表示)。
制备硅烷的反应为
 。
。(1)①基态硅原子的价层电子轨道表示式为
②
 中,硅的化合价为+4价。硅显正化合价的原因是
中,硅的化合价为+4价。硅显正化合价的原因是③下列说法正确的是
a.
 的稳定性比
的稳定性比 的差
的差b.
 中4个
中4个 的键长相同,
的键长相同, 的键角为
的键角为
c.
 中硅原子以4个
中硅原子以4个 杂化轨道分别与4个氢原子的
杂化轨道分别与4个氢原子的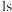 轨道重叠,形成4个
轨道重叠,形成4个 键
键④
 的沸点(-86℃)高于
的沸点(-86℃)高于 的沸点(-112℃),原因是
的沸点(-112℃),原因是(2)
 的晶胞结构如图所示,晶胞的体积为
的晶胞结构如图所示,晶胞的体积为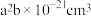 。
。
 的
的 模型名称为
模型名称为②用
 表示阿伏伽德罗常数的值。
表示阿伏伽德罗常数的值。 晶体密度为
晶体密度为 (用含
(用含 、
、 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
2 . 卤族元素的化合物在科研和生产中有着重要的作用。请回答下列问题:
(1) (键角为180º)的中心Ⅰ原子价层电子对数为
(键角为180º)的中心Ⅰ原子价层电子对数为______ ;
______ (填“是”或“否”)具有极性;基态碘原子价电子排布式为______ 。
(2)物质磁性大小以磁矩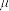 表示,
表示,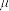 与未成对电子数之间的关系为:
与未成对电子数之间的关系为: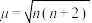 (n为未成对电子数)。配合物
(n为未成对电子数)。配合物 中配离子
中配离子 的
的 B.M(B.M磁矩单位),
B.M(B.M磁矩单位), 的杂化类型为
的杂化类型为______ 。
a. b.
b. c.
c.
配合物 中配离子
中配离子 的
的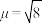 B.M,则配离子的空间构型为
B.M,则配离子的空间构型为______ 。
(3)在极高压强下,氯化钠可以和氯气化合生成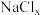 。
。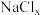 是立方系晶胞,结构如图所示,其中两个氯原子的坐标为
是立方系晶胞,结构如图所示,其中两个氯原子的坐标为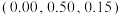 、
、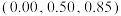 ,晶体的化学式为
,晶体的化学式为______ ;与Na距离最近的且相等的Cl有______ 个; 在晶体中键长为0.20nm,晶胞棱长为
在晶体中键长为0.20nm,晶胞棱长为______ nm(保留2位有效数字)。
(1)
 (键角为180º)的中心Ⅰ原子价层电子对数为
(键角为180º)的中心Ⅰ原子价层电子对数为
(2)物质磁性大小以磁矩
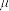 表示,
表示,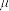 与未成对电子数之间的关系为:
与未成对电子数之间的关系为: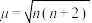 (n为未成对电子数)。配合物
(n为未成对电子数)。配合物 中配离子
中配离子 的
的 B.M(B.M磁矩单位),
B.M(B.M磁矩单位), 的杂化类型为
的杂化类型为a.
 b.
b. c.
c.
配合物
 中配离子
中配离子 的
的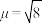 B.M,则配离子的空间构型为
B.M,则配离子的空间构型为(3)在极高压强下,氯化钠可以和氯气化合生成
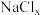 。
。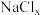 是立方系晶胞,结构如图所示,其中两个氯原子的坐标为
是立方系晶胞,结构如图所示,其中两个氯原子的坐标为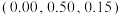 、
、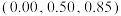 ,晶体的化学式为
,晶体的化学式为 在晶体中键长为0.20nm,晶胞棱长为
在晶体中键长为0.20nm,晶胞棱长为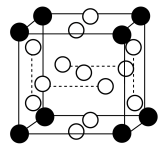
您最近一年使用:0次
名校
解题方法
3 . 铁及其化合物在生产、生活中应用广泛。回答下列问题:
(1)基态Fe原子核外电子排布式为___________ 。
(2) 可与
可与 形成配离子
形成配离子 ,
, 可与NO形成配离子
可与NO形成配离子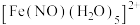 。
。
①S、N、O三种元素第一电离能由大到小的顺序为___________ 。
②每个 中含有σ键的数目是
中含有σ键的数目是___________ 。
(3) 的结构如图1所示。
的结构如图1所示。___________
②H2O中H-O-H键角___________ (填“>”“<”或“=”) 中O-S-O键角。
中O-S-O键角。
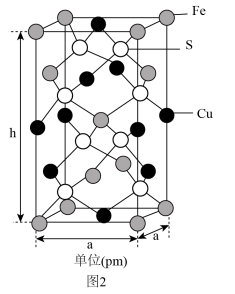
(4)由铁铜硫形成的某化合物的晶胞结构如图2所示。___________ 。
②若该晶体的密度为ρ g⋅cm ,则该晶胞的底面边长a=
,则该晶胞的底面边长a=___________ pm( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)基态Fe原子核外电子排布式为
(2)
 可与
可与 形成配离子
形成配离子 ,
, 可与NO形成配离子
可与NO形成配离子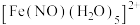 。
。①S、N、O三种元素第一电离能由大到小的顺序为
②每个
 中含有σ键的数目是
中含有σ键的数目是(3)
 的结构如图1所示。
的结构如图1所示。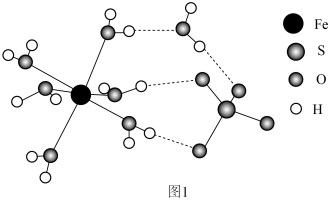
②H2O中H-O-H键角
 中O-S-O键角。
中O-S-O键角。(4)由铁铜硫形成的某化合物的晶胞结构如图2所示。
②若该晶体的密度为ρ g⋅cm
 ,则该晶胞的底面边长a=
,则该晶胞的底面边长a= 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解题方法
4 . 某大学教授课题研究组首次合成了石墨二炔—氧化铟(GDY—IO)纳米复合材料,并将其应用于气相光催化还原 制得
制得 碳氢化合物。
碳氢化合物。______ 。
(2)石墨二炔可以被看作是石墨烯中三分之一的C—C中插入两个 (二炔或乙炔)键,石墨二炔(GDY)中C原子的杂化轨道类型有
(二炔或乙炔)键,石墨二炔(GDY)中C原子的杂化轨道类型有______ 。
(3)石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层原子中。较常见的石墨间隙化合物是青铜色的化合物,其化学式可写为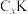 ,其平面图形如图1所示,x的值为
,其平面图形如图1所示,x的值为______ ;在石墨片层结构中,碳原子、C—C键、六元环的个数之比为______ 。 易与铁触媒作用导致其失去催化活性:
易与铁触媒作用导致其失去催化活性: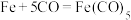 ,
, 又名羟基铁,常温下为黄色油状液体,则
又名羟基铁,常温下为黄色油状液体,则 的晶体类型是
的晶体类型是______ 。
(5)乙烯分子中碳碳双键与碳氢键间的键角大于碳氢键之间的键角,原因是____________ 。
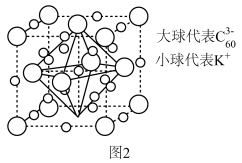
(6)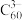 与
与 能形成图2中的超分子加合物,已知晶胞参数为
能形成图2中的超分子加合物,已知晶胞参数为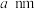 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶胞的密度为
,则该晶胞的密度为______  (列出计算表达式)。
(列出计算表达式)。
 制得
制得 碳氢化合物。
碳氢化合物。
(2)石墨二炔可以被看作是石墨烯中三分之一的C—C中插入两个
 (二炔或乙炔)键,石墨二炔(GDY)中C原子的杂化轨道类型有
(二炔或乙炔)键,石墨二炔(GDY)中C原子的杂化轨道类型有(3)石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层原子中。较常见的石墨间隙化合物是青铜色的化合物,其化学式可写为
 ,其平面图形如图1所示,x的值为
,其平面图形如图1所示,x的值为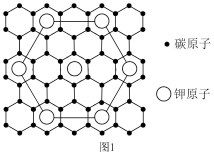
 易与铁触媒作用导致其失去催化活性:
易与铁触媒作用导致其失去催化活性: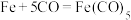 ,
, 又名羟基铁,常温下为黄色油状液体,则
又名羟基铁,常温下为黄色油状液体,则 的晶体类型是
的晶体类型是(5)乙烯分子中碳碳双键与碳氢键间的键角大于碳氢键之间的键角,原因是
(6)
 与
与 能形成图2中的超分子加合物,已知晶胞参数为
能形成图2中的超分子加合物,已知晶胞参数为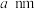 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶胞的密度为
,则该晶胞的密度为 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次
名校
解题方法
5 . 按要求填空:
(1)元素O与Se同主族,电负性O___________ Se(选填“>”、“<”、“=”),基态Se原子价层电子空间运动状态有___________ 种。
(2) 离子的VSEPR模型为
离子的VSEPR模型为___________ ,离子空间构型为___________ 。
(3)6-氨基青霉烷酸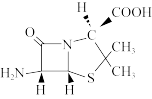 结构中S原子的杂化方式是
结构中S原子的杂化方式是___________ ,组成中C、N、O三种元素的第一电离能由大到小的顺序是___________ 。
(4)1mol环戊二烯(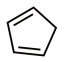 )中含有σ键的数目是
)中含有σ键的数目是___________ ,π键的数目为___________ 。
(5)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。SiCl4可发生水解反应,机理如下:___________ (填标号)。
(6)已知H2O、NH3、CH4三种分子中,键角由大到小的顺序是___________ ,原因为___________ 。
(7)在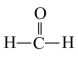 分子中,键角∠HCO
分子中,键角∠HCO___________ (填“>”“<”或“=”)∠HCH,理由是___________ 。
(1)元素O与Se同主族,电负性O
(2)
 离子的VSEPR模型为
离子的VSEPR模型为(3)6-氨基青霉烷酸
 结构中S原子的杂化方式是
结构中S原子的杂化方式是(4)1mol环戊二烯(
 )中含有σ键的数目是
)中含有σ键的数目是(5)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为

(6)已知H2O、NH3、CH4三种分子中,键角由大到小的顺序是
(7)在
 分子中,键角∠HCO
分子中,键角∠HCO
您最近一年使用:0次
名校
6 . 随着科学的发展,氟及其化合物的用途日益广泛。
I.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如图。 是制备此离子液体的原料。
是制备此离子液体的原料。
(1)微粒中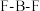 键角:
键角:
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2) 可以与
可以与 反应生成
反应生成 的原因是
的原因是___________ 。
Ⅱ.氟化镁钾( )是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。
)是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。 晶体中,每个
晶体中,每个 周围有
周围有___________ 个距离最近的F。
(4) 半径与
半径与 接近,将
接近,将 部分由
部分由 取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
①基态 价电子的轨道表示式为
价电子的轨道表示式为___________ 。
②某实验室合成新型催化剂材料 (
( 是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为
是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为 。若要合成厚度为
。若要合成厚度为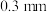 、面积为
、面积为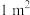 的催化剂材料,理论上需要掺杂的
的催化剂材料,理论上需要掺杂的 约为
约为___________  (
(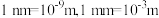 ,阿伏加德罗常数约为
,阿伏加德罗常数约为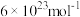 )。
)。
(5)我国科研工作者以 晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的
晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的 晶体。其框架中的
晶体。其框架中的 由
由 取代,
取代, 位置嵌入有机阳离子
位置嵌入有机阳离子 ,
, 位置沿棱方向嵌入直线型
位置沿棱方向嵌入直线型 。已知
。已知 与
与 的结构简式如下:
的结构简式如下: 中N原子的杂化方式为
中N原子的杂化方式为___________ , 中心N原子的杂化方式为
中心N原子的杂化方式为___________ 。
② 的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的
的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的 与
与 还存在着
还存在着___________ ,上述相互作用不会随 的转动改变。
的转动改变。
I.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如图。
 是制备此离子液体的原料。
是制备此离子液体的原料。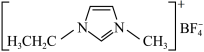
(1)微粒中
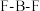 键角:
键角:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)
 可以与
可以与 反应生成
反应生成 的原因是
的原因是Ⅱ.氟化镁钾(
 )是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。
)是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。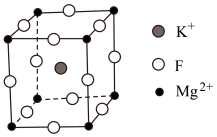
 晶体中,每个
晶体中,每个 周围有
周围有(4)
 半径与
半径与 接近,将
接近,将 部分由
部分由 取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。①基态
 价电子的轨道表示式为
价电子的轨道表示式为②某实验室合成新型催化剂材料
 (
( 是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为
是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为 。若要合成厚度为
。若要合成厚度为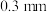 、面积为
、面积为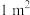 的催化剂材料,理论上需要掺杂的
的催化剂材料,理论上需要掺杂的 约为
约为 (
(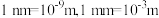 ,阿伏加德罗常数约为
,阿伏加德罗常数约为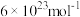 )。
)。(5)我国科研工作者以
 晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的
晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的 晶体。其框架中的
晶体。其框架中的 由
由 取代,
取代, 位置嵌入有机阳离子
位置嵌入有机阳离子 ,
, 位置沿棱方向嵌入直线型
位置沿棱方向嵌入直线型 。已知
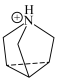
。已知 与
与 的结构简式如下:
的结构简式如下: :
:
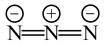
 :
:
 中N原子的杂化方式为
中N原子的杂化方式为 中心N原子的杂化方式为
中心N原子的杂化方式为②
 的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的
的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的 与
与 还存在着
还存在着 的转动改变。
的转动改变。
您最近一年使用:0次
名校
7 . 光伏材料又称太阳能材料,是指能将太阳能直接转换成电能的材料。可作太阳能电池材料的有单晶硅、多晶硅、非晶硅、GaAlAs、InP、CdS 等。回答下列问题:
(1)基态Cr原子的价电子排布式为___________ 。
(2)原子中电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数,则基态S原子中电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态S原子中电子自旋磁量子数的代数和为___________ 。
(3)基态P原子中电子占据的最高能层符号为___________ ; 的空间结构为
的空间结构为___________ 。
(4)砷化镓薄膜太阳能电池被用来为“天宫”空间站的核心舱供电。已知砷化镓的熔点为1238℃,其晶胞结构如下图所示。___________ 。
②该晶体的类型为___________ ;若晶胞密度为d  ,摩尔质量为M
,摩尔质量为M  ,阿伏加德罗常数的值用NA表示,则晶胞中最近的As和Ga原子核间距为
,阿伏加德罗常数的值用NA表示,则晶胞中最近的As和Ga原子核间距为___________ nm(只列计算式)。
(1)基态Cr原子的价电子排布式为
(2)原子中电子有两种相反的自旋状态,分别用
 和
和 表示,称为电子的自旋磁量子数,则基态S原子中电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态S原子中电子自旋磁量子数的代数和为(3)基态P原子中电子占据的最高能层符号为
 的空间结构为
的空间结构为(4)砷化镓薄膜太阳能电池被用来为“天宫”空间站的核心舱供电。已知砷化镓的熔点为1238℃,其晶胞结构如下图所示。
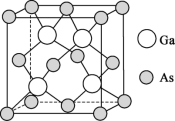
②该晶体的类型为
 ,摩尔质量为M
,摩尔质量为M  ,阿伏加德罗常数的值用NA表示,则晶胞中最近的As和Ga原子核间距为
,阿伏加德罗常数的值用NA表示,则晶胞中最近的As和Ga原子核间距为
您最近一年使用:0次
名校
解题方法
8 . 铁及其化合物广泛地应用到各个领域。回答下列问题:
(1)铁元素位于元素周期表的___________ 区。
(2)我国菱铁矿 储量较为丰富,
储量较为丰富, 中
中 的空间结构为
的空间结构为___________ 。
(3)草酸亚铁可作为电池正极材料磷酸铁锂的原料,其结构简式如下,碳原子的杂化方式是___________ 。 溶于汽油、苯、丙酮等有机溶剂。CO与Fe之间从电子对给予来看形成
溶于汽油、苯、丙酮等有机溶剂。CO与Fe之间从电子对给予来看形成___________ 键。
(5)以 、
、 合成
合成 ,Fe是常用的催化剂。实际生产中采用铁的氧化物
,Fe是常用的催化剂。实际生产中采用铁的氧化物 、FeO,使用前用
、FeO,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为立方体)结构示意如下,两种晶胞所含铁原子个数比为
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为立方体)结构示意如下,两种晶胞所含铁原子个数比为___________ 。___________ 。若该晶体的密度是d g⋅cm ,则两个最近的Fe原子间的距离为
,则两个最近的Fe原子间的距离为___________ nm(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)铁元素位于元素周期表的
(2)我国菱铁矿
 储量较为丰富,
储量较为丰富, 中
中 的空间结构为
的空间结构为(3)草酸亚铁可作为电池正极材料磷酸铁锂的原料,其结构简式如下,碳原子的杂化方式是
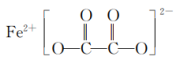
 溶于汽油、苯、丙酮等有机溶剂。CO与Fe之间从电子对给予来看形成
溶于汽油、苯、丙酮等有机溶剂。CO与Fe之间从电子对给予来看形成(5)以
 、
、 合成
合成 ,Fe是常用的催化剂。实际生产中采用铁的氧化物
,Fe是常用的催化剂。实际生产中采用铁的氧化物 、FeO,使用前用
、FeO,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为立方体)结构示意如下,两种晶胞所含铁原子个数比为
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为立方体)结构示意如下,两种晶胞所含铁原子个数比为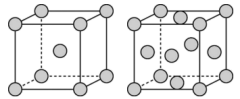
 ,则两个最近的Fe原子间的距离为
,则两个最近的Fe原子间的距离为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。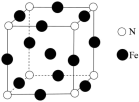
您最近一年使用:0次
名校
解题方法
9 . 铁、铜及其化合物在生产生活中有着广泛应用。回答下列问题:
(1)基态 原子核外电子的运动状态有
原子核外电子的运动状态有___________ 种;
 易被氧化为
易被氧化为 ,画出
,画出 的结构示意图
的结构示意图___________ 。
(2) 是检验
是检验 的特征试剂,
的特征试剂, 中心离子配位数是
中心离子配位数是___________ ;1mol 中含有
中含有___________ mol 键,能够证明
键,能够证明 不能电离的试剂是
不能电离的试剂是___________ (填化学式)。
(3) 可形成配合物
可形成配合物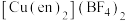 ,其中
,其中 代表
代表 分子。该配合物
分子。该配合物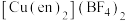 中配位离子所带电荷数为
中配位离子所带电荷数为___________ ,VSEPR模型为四面体的非金属原子共有___________ 个。 单晶的晶胞,其中原子坐标参数A为
单晶的晶胞,其中原子坐标参数A为 ;B为
;B为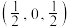 ;C为
;C为 。则D原子的坐标参数为
。则D原子的坐标参数为___________ 。
(1)基态
 原子核外电子的运动状态有
原子核外电子的运动状态有 易被氧化为
易被氧化为 ,画出
,画出 的结构示意图
的结构示意图(2)
 是检验
是检验 的特征试剂,
的特征试剂, 中心离子配位数是
中心离子配位数是 中含有
中含有 键,能够证明
键,能够证明 不能电离的试剂是
不能电离的试剂是(3)
 可形成配合物
可形成配合物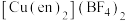 ,其中
,其中 代表
代表 分子。该配合物
分子。该配合物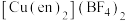 中配位离子所带电荷数为
中配位离子所带电荷数为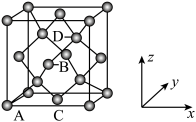
 单晶的晶胞,其中原子坐标参数A为
单晶的晶胞,其中原子坐标参数A为 ;B为
;B为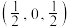 ;C为
;C为 。则D原子的坐标参数为
。则D原子的坐标参数为
您最近一年使用:0次
名校
解题方法
10 . 请回答下列问题:
(1)第VIII族元素Fe、Co、Ni性质相似,称为铁系元素,主要用于制造合金。基态Ni原子有_____ 种运动状态的电子,核外能量最高的电子位于_____ 能级;Ni属于_____ 区(填“s”或“p”或“d”或“f”)。
(2)Fe3+与酚类物质的显色反应常用于离子检验,已知Fe3+遇邻苯二酚(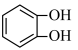 )和对苯二酚(
)和对苯二酚(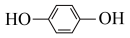 )均显绿色。邻苯二酚的熔、沸点比对苯二酚
)均显绿色。邻苯二酚的熔、沸点比对苯二酚______ (填“高”或“低”),原因是_______ 。
(3)结合VSEPR理论模型及杂化轨道理论分析以下问题:
①Bi(NO3)3中阴离子的立体构型为_______ ,N原子的杂化方式为_____ 。
②NaN3中 的空间结构为
的空间结构为_______ ,其中心原子的杂化类型为______ 。分析微粒空间结构的方法______ 。
(4)60g SiO2中含有的Si−O键数目为____ (用NA表示);1 mol冰中含有___ mol氢键。
(1)第VIII族元素Fe、Co、Ni性质相似,称为铁系元素,主要用于制造合金。基态Ni原子有
(2)Fe3+与酚类物质的显色反应常用于离子检验,已知Fe3+遇邻苯二酚(
 )和对苯二酚(
)和对苯二酚( )均显绿色。邻苯二酚的熔、沸点比对苯二酚
)均显绿色。邻苯二酚的熔、沸点比对苯二酚(3)结合VSEPR理论模型及杂化轨道理论分析以下问题:
①Bi(NO3)3中阴离子的立体构型为
②NaN3中
 的空间结构为
的空间结构为(4)60g SiO2中含有的Si−O键数目为
您最近一年使用:0次



