解题方法
1 . 铁元素在地壳中含量丰富,应用广泛。回答下列问题:
(1)原子核外运动的电子有两种相反的自旋状态,若有一种自旋状态用 ,则与之相反的用
,则与之相反的用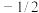 ,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为
,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为___________ 。
(2) 水溶液中
水溶液中 可水解生成双核阳离子
可水解生成双核阳离子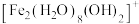 ,结构如图所示。该双核阳离子中
,结构如图所示。该双核阳离子中 键角
键角___________ (填“大于”、“小于”或“等于”) 中的
中的 键角;若对
键角;若对 水溶液进行加热,该双核阳离子内部首先断开的是
水溶液进行加热,该双核阳离子内部首先断开的是___________ 键(填“a”或“b”)。 】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为
】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为___________ , 的空间构型是
的空间构型是___________ ;尿素晶体的熔点为132.7℃,比相同摩尔质量的乙酸熔点(16.7℃)高116℃,主要原因是___________ 。
(4) 有良好的磁性和光学性能,广泛应用于电子工业和材料工业。
有良好的磁性和光学性能,广泛应用于电子工业和材料工业。 晶体中,
晶体中, 围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成),
围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成), 中有一半的
中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为
填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为___________ , 晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为
晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为___________  (写出含
(写出含 和
和 的计算表达式)。
的计算表达式)。
(1)原子核外运动的电子有两种相反的自旋状态,若有一种自旋状态用
 ,则与之相反的用
,则与之相反的用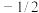 ,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为
,称为电子的自旋磁量子数,基态Fe原子核外电子自旋磁量子数的代数和为(2)
 水溶液中
水溶液中 可水解生成双核阳离子
可水解生成双核阳离子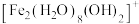 ,结构如图所示。该双核阳离子中
,结构如图所示。该双核阳离子中 键角
键角 中的
中的 键角;若对
键角;若对 水溶液进行加热,该双核阳离子内部首先断开的是
水溶液进行加热,该双核阳离子内部首先断开的是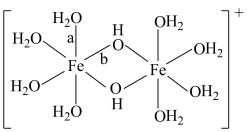
 】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为
】是一种重要的配合物,用作有机铁肥,简称铁氮肥。该配合物中所含非金属元素的第一电离能从大到小的顺序为 的空间构型是
的空间构型是(4)
 有良好的磁性和光学性能,广泛应用于电子工业和材料工业。
有良好的磁性和光学性能,广泛应用于电子工业和材料工业。 晶体中,
晶体中, 围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成),
围成正四面体空隙(如:1、3、6、7围成)和正八面体空隙(如:3、6、7、8、9、12围成), 中有一半的
中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为
填充在正八面体空隙中(如图所示)。则正四面体空隙填充率与正八面体空隙填充率之比为 晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为
晶胞中有8个图示结构单元,该晶胞参数为apm,则晶体密度为 (写出含
(写出含 和
和 的计算表达式)。
的计算表达式)。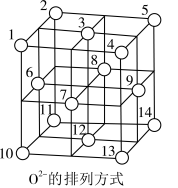
您最近一年使用:0次
名校
解题方法
2 . A、B、C、D、E、F为原子序数依次增大的前四周期元素,A元素原子最外层电子数是其内层电子数的2.5倍,B元素是地壳中含量最高的元素,C元素的最高化合价和最低化合价的代数和等于0,D元素的单质可用于自来水消毒杀菌,E元素位于周期表的VIB族,F元素的基态原子中有4个未成对电子。
(1)A元素单质的结构式为_______ ,基态E元素原子价层电子排布图为_______ 。
(2)A的氢化物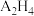 分子属于
分子属于_______ 分子(填“极性或非极性”),A与B形成的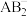 的空间构型为
的空间构型为_______ 。
(3)火箭推动剂由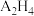 和
和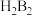 组成,加热反应时有
组成,加热反应时有 元素的单质生成,写出该化学反应方程式:
元素的单质生成,写出该化学反应方程式:_______ 。基态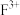 未成对电子数为
未成对电子数为_______ 个。
(4)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。若晶胞参数(边长)为apm, 为阿伏加德罗常数的值,则该晶胞的密度为
为阿伏加德罗常数的值,则该晶胞的密度为_______  。
。
(1)A元素单质的结构式为
(2)A的氢化物
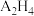 分子属于
分子属于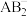 的空间构型为
的空间构型为(3)火箭推动剂由
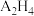 和
和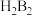 组成,加热反应时有
组成,加热反应时有 元素的单质生成,写出该化学反应方程式:
元素的单质生成,写出该化学反应方程式: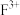 未成对电子数为
未成对电子数为(4)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。若晶胞参数(边长)为apm,
 为阿伏加德罗常数的值,则该晶胞的密度为
为阿伏加德罗常数的值,则该晶胞的密度为 。
。
您最近一年使用:0次
解题方法
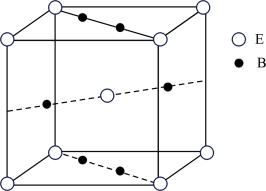
3 . 硼化合物及其材料在化工、医疗、材料等领域都起着举足轻重的作用。氨硼烷在催化剂作用下水解生成氢气的离子反应为 。回答下列问题:
。回答下列问题:
(1) 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性 ,则H、B、N三种元素的电负性大小顺序是
,则H、B、N三种元素的电负性大小顺序是___________ 。基态N原于的价层电子排布图为___________ 。B原于核外有___________ 种不同运动状态的电子。 分子中
分子中 键角
键角___________ (填“>”“<”或“=”) 分子中
分子中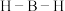 键角。
键角。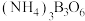 的熔点比
的熔点比 高的原因是
高的原因是___________ 。
(2)硼化镁晶体在39K时呈超导性。在硼化镁晶体中,镁原子和硼原子是分层排布的,如图所示是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上,则硼化镁的化学式为___________ 。___________ 。___________ ,该结构中有一个配位键,提供空轨道的原子是___________ 。若其晶胞参数为bpm,则该晶体的密度为___________  (列出表达式,设
(列出表达式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 。回答下列问题:
。回答下列问题:(1)
 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性 ,则H、B、N三种元素的电负性大小顺序是
,则H、B、N三种元素的电负性大小顺序是 分子中
分子中 键角
键角 分子中
分子中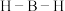 键角。
键角。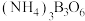 的熔点比
的熔点比 高的原因是
高的原因是(2)硼化镁晶体在39K时呈超导性。在硼化镁晶体中,镁原子和硼原子是分层排布的,如图所示是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上,则硼化镁的化学式为


 (列出表达式,设
(列出表达式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解题方法
4 . 硅、硫元素是重要的非金属元素,在生产、生活中占有重要地位。如很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物 可与氧化汞生成化合物
可与氧化汞生成化合物 。
。___________ 。
(2)①硫单质的一种结构为 ,该晶体中存在的作用力
,该晶体中存在的作用力___________ 、___________ 。
② 、
、 、
、 键角由大到小的顺序是
键角由大到小的顺序是___________ (填离子符号)。
(3) 、
、 、
、 的沸点由高到低顺序为
的沸点由高到低顺序为___________ 。
(4) 分子的空间结构(以Si为中心)为
分子的空间结构(以Si为中心)为___________ ,分子中氮原子的杂化轨道类型是___________ 。
(5)化合物 也是一种汞解毒剂。化合物
也是一种汞解毒剂。化合物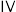 是一种强酸。下列说法正确的有___________。
是一种强酸。下列说法正确的有___________。
(6)化合物 的结构与甘油(
的结构与甘油( )相似,但是甘油在水中的溶解度更大,其原因可能是
)相似,但是甘油在水中的溶解度更大,其原因可能是___________ 。
 可与氧化汞生成化合物
可与氧化汞生成化合物 。
。
(2)①硫单质的一种结构为
 ,该晶体中存在的作用力
,该晶体中存在的作用力②
 、
、 、
、 键角由大到小的顺序是
键角由大到小的顺序是(3)
 、
、 、
、 的沸点由高到低顺序为
的沸点由高到低顺序为(4)
 分子的空间结构(以Si为中心)为
分子的空间结构(以Si为中心)为(5)化合物
 也是一种汞解毒剂。化合物
也是一种汞解毒剂。化合物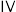 是一种强酸。下列说法正确的有___________。
是一种强酸。下列说法正确的有___________。A.在 中S原子采取 中S原子采取 杂化 杂化 | B.在Ⅱ中S元素的电负性最大 |
C.在 中C-C-C键角是180° 中C-C-C键角是180° | D.在Ⅲ中存在离子键与共价键 |
(6)化合物
 的结构与甘油(
的结构与甘油( )相似,但是甘油在水中的溶解度更大,其原因可能是
)相似,但是甘油在水中的溶解度更大,其原因可能是
您最近一年使用:0次
名校
解题方法
5 . 硅烷广泛应用在现代高科技领域。
制备硅烷的反应为 。
。
(1)①基态硅原子的价层电子轨道表示式为___________ 。
② 中,硅的化合价为+4价。硅显正化合价的原因是
中,硅的化合价为+4价。硅显正化合价的原因是___________ 。
③下列说法正确的是___________ (填字母)。
a. 的稳定性比
的稳定性比 的差
的差
b. 中4个
中4个 的键长相同,
的键长相同,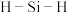 的键角为
的键角为
c. 中硅原子以4个
中硅原子以4个 杂化轨道分别与4个氢原子的
杂化轨道分别与4个氢原子的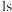 轨道重叠,形成4个
轨道重叠,形成4个 键
键
④ 的沸点(-86℃)高于
的沸点(-86℃)高于 的沸点(-112℃),原因是
的沸点(-112℃),原因是___________ 。
(2) 的晶胞结构如图所示,晶胞的体积为
的晶胞结构如图所示,晶胞的体积为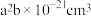 。
。 的
的 模型名称为
模型名称为___________ 。
②用 表示阿伏伽德罗常数的值。
表示阿伏伽德罗常数的值。 晶体密度为
晶体密度为___________  (用含
(用含 、
、 、
、 的代数式表示)。
的代数式表示)。
制备硅烷的反应为
 。
。(1)①基态硅原子的价层电子轨道表示式为
②
 中,硅的化合价为+4价。硅显正化合价的原因是
中,硅的化合价为+4价。硅显正化合价的原因是③下列说法正确的是
a.
 的稳定性比
的稳定性比 的差
的差b.
 中4个
中4个 的键长相同,
的键长相同,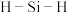 的键角为
的键角为
c.
 中硅原子以4个
中硅原子以4个 杂化轨道分别与4个氢原子的
杂化轨道分别与4个氢原子的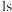 轨道重叠,形成4个
轨道重叠,形成4个 键
键④
 的沸点(-86℃)高于
的沸点(-86℃)高于 的沸点(-112℃),原因是
的沸点(-112℃),原因是(2)
 的晶胞结构如图所示,晶胞的体积为
的晶胞结构如图所示,晶胞的体积为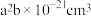 。
。
 的
的 模型名称为
模型名称为②用
 表示阿伏伽德罗常数的值。
表示阿伏伽德罗常数的值。 晶体密度为
晶体密度为 (用含
(用含 、
、 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
6 . 卤族元素的化合物在科研和生产中有着重要的作用。请回答下列问题:
(1) (键角为180º)的中心Ⅰ原子价层电子对数为
(键角为180º)的中心Ⅰ原子价层电子对数为______ ;
______ (填“是”或“否”)具有极性;基态碘原子价电子排布式为______ 。
(2)物质磁性大小以磁矩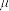 表示,
表示,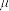 与未成对电子数之间的关系为:
与未成对电子数之间的关系为: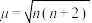 (n为未成对电子数)。配合物
(n为未成对电子数)。配合物 中配离子
中配离子 的
的 B.M(B.M磁矩单位),
B.M(B.M磁矩单位), 的杂化类型为
的杂化类型为______ 。
a. b.
b.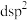 c.
c.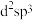
配合物 中配离子
中配离子 的
的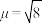 B.M,则配离子的空间构型为
B.M,则配离子的空间构型为______ 。
(3)在极高压强下,氯化钠可以和氯气化合生成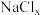 。
。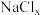 是立方系晶胞,结构如图所示,其中两个氯原子的坐标为
是立方系晶胞,结构如图所示,其中两个氯原子的坐标为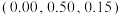 、
、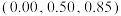 ,晶体的化学式为
,晶体的化学式为______ ;与Na距离最近的且相等的Cl有______ 个; 在晶体中键长为0.20nm,晶胞棱长为
在晶体中键长为0.20nm,晶胞棱长为______ nm(保留2位有效数字)。
(1)
 (键角为180º)的中心Ⅰ原子价层电子对数为
(键角为180º)的中心Ⅰ原子价层电子对数为
(2)物质磁性大小以磁矩
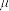 表示,
表示,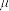 与未成对电子数之间的关系为:
与未成对电子数之间的关系为: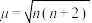 (n为未成对电子数)。配合物
(n为未成对电子数)。配合物 中配离子
中配离子 的
的 B.M(B.M磁矩单位),
B.M(B.M磁矩单位), 的杂化类型为
的杂化类型为a.
 b.
b.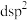 c.
c.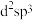
配合物
 中配离子
中配离子 的
的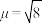 B.M,则配离子的空间构型为
B.M,则配离子的空间构型为(3)在极高压强下,氯化钠可以和氯气化合生成
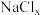 。
。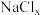 是立方系晶胞,结构如图所示,其中两个氯原子的坐标为
是立方系晶胞,结构如图所示,其中两个氯原子的坐标为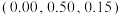 、
、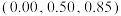 ,晶体的化学式为
,晶体的化学式为 在晶体中键长为0.20nm,晶胞棱长为
在晶体中键长为0.20nm,晶胞棱长为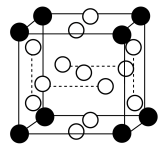
您最近一年使用:0次
名校
解题方法
7 . 铁及其化合物在生产、生活中应用广泛。回答下列问题:
(1)基态Fe原子核外电子排布式为___________ 。
(2) 可与
可与 形成配离子
形成配离子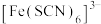 ,
,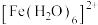 可与NO形成配离子
可与NO形成配离子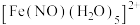 。
。
①S、N、O三种元素第一电离能由大到小的顺序为___________ 。
②每个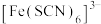 中含有σ键的数目是
中含有σ键的数目是___________ 。
(3) 的结构如图1所示。
的结构如图1所示。___________
②H2O中H-O-H键角___________ (填“>”“<”或“=”) 中O-S-O键角。
中O-S-O键角。
(4)由铁铜硫形成的某化合物的晶胞结构如图2所示。___________ 。
②若该晶体的密度为ρ g⋅cm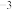 ,则该晶胞的底面边长a=
,则该晶胞的底面边长a=___________ pm( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)基态Fe原子核外电子排布式为
(2)
 可与
可与 形成配离子
形成配离子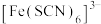 ,
,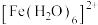 可与NO形成配离子
可与NO形成配离子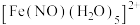 。
。①S、N、O三种元素第一电离能由大到小的顺序为
②每个
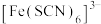 中含有σ键的数目是
中含有σ键的数目是(3)
 的结构如图1所示。
的结构如图1所示。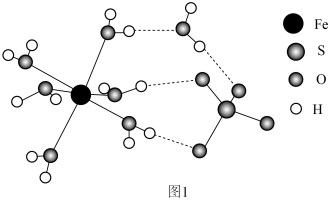
②H2O中H-O-H键角
 中O-S-O键角。
中O-S-O键角。(4)由铁铜硫形成的某化合物的晶胞结构如图2所示。
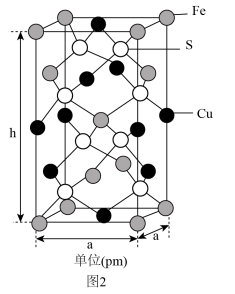
②若该晶体的密度为ρ g⋅cm
 ,则该晶胞的底面边长a=
,则该晶胞的底面边长a= 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解题方法
8 . 某大学教授课题研究组首次合成了石墨二炔—氧化铟(GDY—IO)纳米复合材料,并将其应用于气相光催化还原 制得
制得 碳氢化合物。
碳氢化合物。______ 。
(2)石墨二炔可以被看作是石墨烯中三分之一的C—C中插入两个 (二炔或乙炔)键,石墨二炔(GDY)中C原子的杂化轨道类型有
(二炔或乙炔)键,石墨二炔(GDY)中C原子的杂化轨道类型有______ 。
(3)石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层原子中。较常见的石墨间隙化合物是青铜色的化合物,其化学式可写为 ,其平面图形如图1所示,x的值为
,其平面图形如图1所示,x的值为______ ;在石墨片层结构中,碳原子、C—C键、六元环的个数之比为______ 。 易与铁触媒作用导致其失去催化活性:
易与铁触媒作用导致其失去催化活性: ,
, 又名羟基铁,常温下为黄色油状液体,则
又名羟基铁,常温下为黄色油状液体,则 的晶体类型是
的晶体类型是______ 。
(5)乙烯分子中碳碳双键与碳氢键间的键角大于碳氢键之间的键角,原因是____________ 。
(6)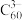 与
与 能形成图2中的超分子加合物,已知晶胞参数为
能形成图2中的超分子加合物,已知晶胞参数为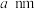 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶胞的密度为
,则该晶胞的密度为______  (列出计算表达式)。
(列出计算表达式)。
 制得
制得 碳氢化合物。
碳氢化合物。
(2)石墨二炔可以被看作是石墨烯中三分之一的C—C中插入两个
 (二炔或乙炔)键,石墨二炔(GDY)中C原子的杂化轨道类型有
(二炔或乙炔)键,石墨二炔(GDY)中C原子的杂化轨道类型有(3)石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层原子中。较常见的石墨间隙化合物是青铜色的化合物,其化学式可写为
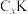 ,其平面图形如图1所示,x的值为
,其平面图形如图1所示,x的值为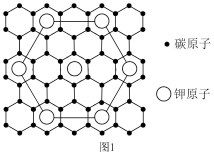
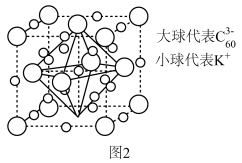
 易与铁触媒作用导致其失去催化活性:
易与铁触媒作用导致其失去催化活性: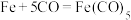 ,
, 又名羟基铁,常温下为黄色油状液体,则
又名羟基铁,常温下为黄色油状液体,则 的晶体类型是
的晶体类型是(5)乙烯分子中碳碳双键与碳氢键间的键角大于碳氢键之间的键角,原因是
(6)
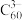 与
与 能形成图2中的超分子加合物,已知晶胞参数为
能形成图2中的超分子加合物,已知晶胞参数为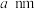 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶胞的密度为
,则该晶胞的密度为 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次
名校
解题方法
9 . 按要求填空:
(1)元素O与Se同主族,电负性O___________ Se(选填“>”、“<”、“=”),基态Se原子价层电子空间运动状态有___________ 种。
(2) 离子的VSEPR模型为
离子的VSEPR模型为___________ ,离子空间构型为___________ 。
(3)6-氨基青霉烷酸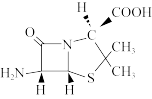 结构中S原子的杂化方式是
结构中S原子的杂化方式是___________ ,组成中C、N、O三种元素的第一电离能由大到小的顺序是___________ 。
(4)1mol环戊二烯(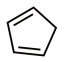 )中含有σ键的数目是
)中含有σ键的数目是___________ ,π键的数目为___________ 。
(5)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为___________ 。SiCl4可发生水解反应,机理如下:___________ (填标号)。
(6)已知H2O、NH3、CH4三种分子中,键角由大到小的顺序是___________ ,原因为___________ 。
(7)在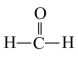 分子中,键角∠HCO
分子中,键角∠HCO___________ (填“>”“<”或“=”)∠HCH,理由是___________ 。
(1)元素O与Se同主族,电负性O
(2)
 离子的VSEPR模型为
离子的VSEPR模型为(3)6-氨基青霉烷酸
 结构中S原子的杂化方式是
结构中S原子的杂化方式是(4)1mol环戊二烯(
 )中含有σ键的数目是
)中含有σ键的数目是(5)SiCl4是生产高纯硅的前驱体,其中Si采取的杂化类型为

(6)已知H2O、NH3、CH4三种分子中,键角由大到小的顺序是
(7)在
 分子中,键角∠HCO
分子中,键角∠HCO
您最近一年使用:0次
名校
10 . 随着科学的发展,氟及其化合物的用途日益广泛。
I.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如图。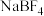 是制备此离子液体的原料。
是制备此离子液体的原料。
(1)微粒中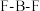 键角:
键角:
___________ 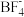 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2) 可以与
可以与 反应生成
反应生成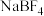 的原因是
的原因是___________ 。
Ⅱ.氟化镁钾( )是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。
)是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。 晶体中,每个
晶体中,每个 周围有
周围有___________ 个距离最近的F。
(4) 半径与
半径与 接近,将
接近,将 部分由
部分由 取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
①基态 价电子的轨道表示式为
价电子的轨道表示式为___________ 。
②某实验室合成新型催化剂材料 (
(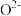 是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为
是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为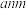 。若要合成厚度为
。若要合成厚度为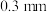 、面积为
、面积为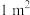 的催化剂材料,理论上需要掺杂的
的催化剂材料,理论上需要掺杂的 约为
约为___________  (
(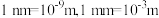 ,阿伏加德罗常数约为
,阿伏加德罗常数约为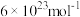 )。
)。
(5)我国科研工作者以 晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的
晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的 晶体。其框架中的
晶体。其框架中的 由
由 取代,
取代, 位置嵌入有机阳离子
位置嵌入有机阳离子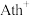 ,
, 位置沿棱方向嵌入直线型
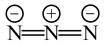
位置沿棱方向嵌入直线型 。已知
。已知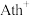 与
与 的结构简式如下:
的结构简式如下: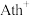 中N原子的杂化方式为
中N原子的杂化方式为___________ , 中心N原子的杂化方式为
中心N原子的杂化方式为___________ 。
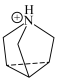
②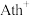 的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的
的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的 与
与 还存在着
还存在着___________ ,上述相互作用不会随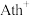 的转动改变。
的转动改变。
I.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如图。
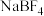 是制备此离子液体的原料。
是制备此离子液体的原料。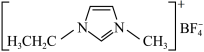
(1)微粒中
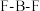 键角:
键角:
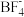 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)
 可以与
可以与 反应生成
反应生成 的原因是
的原因是Ⅱ.氟化镁钾(
 )是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。
)是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。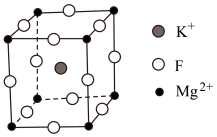
 晶体中,每个
晶体中,每个 周围有
周围有(4)
 半径与
半径与 接近,将
接近,将 部分由
部分由 取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。①基态
 价电子的轨道表示式为
价电子的轨道表示式为②某实验室合成新型催化剂材料
 (
(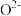 是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为
是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为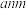 。若要合成厚度为
。若要合成厚度为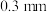 、面积为
、面积为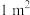 的催化剂材料,理论上需要掺杂的
的催化剂材料,理论上需要掺杂的 约为
约为 (
(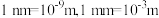 ,阿伏加德罗常数约为
,阿伏加德罗常数约为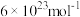 )。
)。(5)我国科研工作者以
 晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的
晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的 晶体。其框架中的
晶体。其框架中的 由
由 取代,
取代, 位置嵌入有机阳离子
位置嵌入有机阳离子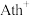 ,
, 位置沿棱方向嵌入直线型
位置沿棱方向嵌入直线型 。已知
。已知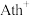 与
与 的结构简式如下:
的结构简式如下: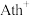 :
:
 :
:
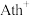 中N原子的杂化方式为
中N原子的杂化方式为 中心N原子的杂化方式为
中心N原子的杂化方式为②
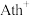 的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的
的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的 与
与 还存在着
还存在着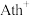 的转动改变。
的转动改变。
您最近一年使用:0次



