名校
解题方法
1 . 回答下列问题
(1)“棕色环”现象是检验溶液中 的一种方法。向含有
的一种方法。向含有 溶液的试管中加入
溶液的试管中加入 ,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为
,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为 。
。
① 中N元素采取
中N元素采取________ 杂化,其立体构型为________ (填名称);
② 中一种配体实际上是
中一种配体实际上是 ,则其中Fe元素的化合价为
,则其中Fe元素的化合价为________ ;写出 的一种等电子体的化学式
的一种等电子体的化学式________ ;
③ 中微粒间不存在的作用力有
中微粒间不存在的作用力有________ ;
a.极性键 b.非极性键 c.σ键 d.π键 c.配位键 f.离子键
④ 与
与 等金属离子形成的配合物中配位原子一般是S而不是N,其原因是
等金属离子形成的配合物中配位原子一般是S而不是N,其原因是________ 。
(2)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子轨道表示式为________ ; 可发生水解反应,机理如下。含s、p、d轨道的杂化类型有A.
可发生水解反应,机理如下。含s、p、d轨道的杂化类型有A. 、B.
、B. 、C.
、C. ,中间体
,中间体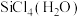 中Si采取的杂化类型为
中Si采取的杂化类型为________ (填字母)。________ ;
②分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。请问噻吩中的大π键表示为
)。请问噻吩中的大π键表示为________ 。
(4)最简单的硼烷是 ,其分子结构如下左图,B原子的杂化方式为
,其分子结构如下左图,B原子的杂化方式为________ 。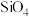 ]四面体(如右上图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,其钠盐的化学式为
]四面体(如右上图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,其钠盐的化学式为________ 。 熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。则
熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。则 熔融的电离方程式为
熔融的电离方程式为________ 。
(1)“棕色环”现象是检验溶液中
 的一种方法。向含有
的一种方法。向含有 溶液的试管中加入
溶液的试管中加入 ,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为
,随后沿管壁加入浓硫酸,在溶液界面上出现“棕色环”,研究发现棕色物质化学式为 。
。①
 中N元素采取
中N元素采取②
 中一种配体实际上是
中一种配体实际上是 ,则其中Fe元素的化合价为
,则其中Fe元素的化合价为 的一种等电子体的化学式
的一种等电子体的化学式③
 中微粒间不存在的作用力有
中微粒间不存在的作用力有a.极性键 b.非极性键 c.σ键 d.π键 c.配位键 f.离子键
④
 与
与 等金属离子形成的配合物中配位原子一般是S而不是N,其原因是
等金属离子形成的配合物中配位原子一般是S而不是N,其原因是(2)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子轨道表示式为
 可发生水解反应,机理如下。含s、p、d轨道的杂化类型有A.
可发生水解反应,机理如下。含s、p、d轨道的杂化类型有A. 、B.
、B. 、C.
、C. ,中间体
,中间体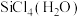 中Si采取的杂化类型为
中Si采取的杂化类型为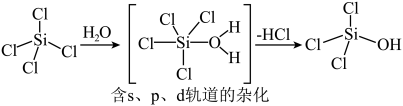
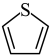
②分子中的大π键可以用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。请问噻吩中的大π键表示为
)。请问噻吩中的大π键表示为(4)最简单的硼烷是
 ,其分子结构如下左图,B原子的杂化方式为
,其分子结构如下左图,B原子的杂化方式为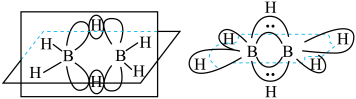
 ]四面体(如右上图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,其钠盐的化学式为
]四面体(如右上图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,其钠盐的化学式为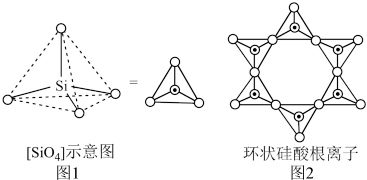
 熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。则
熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子。则 熔融的电离方程式为
熔融的电离方程式为
您最近一年使用:0次
名校
解题方法
2 . 氮及其化合物应用广泛。回答下列问题:
(1)基态N原子处于最高能级的电子云轮廓图为__________ 形。
(2)胍(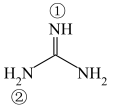 )为平面形分子,存在大π键
)为平面形分子,存在大π键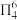 。胍属于
。胍属于__________ 分子(填“极性”或“非极性”),①号N原子H-N-C键角__________ ②号N原子H-N-C键角(填“>”“<”或“=”),胍易吸收空气中H2O和CO2,其原因是____________________________________ 。
(3)氮化钴属于立方晶系,经Cu掺杂得催化剂X,经Li掺杂得催化剂Y。
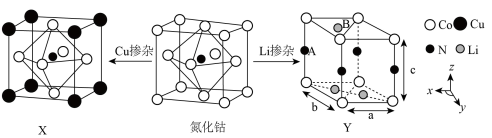
X属于立方晶系,晶胞参数为dpm,距离最近Co原子的核间距为__________ pm,Y属于六方晶系,晶胞参数为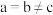 ,
, ,
,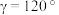 ,如A点原子的分数坐标为
,如A点原子的分数坐标为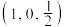 ,则B点Li原子的分数坐标为
,则B点Li原子的分数坐标为____________ ,1个N原子周围距离相等且最近的Li原子数目为_____________ 。
(1)基态N原子处于最高能级的电子云轮廓图为
(2)胍(
 )为平面形分子,存在大π键
)为平面形分子,存在大π键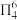 。胍属于
。胍属于(3)氮化钴属于立方晶系,经Cu掺杂得催化剂X,经Li掺杂得催化剂Y。

X属于立方晶系,晶胞参数为dpm,距离最近Co原子的核间距为
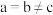 ,
, ,
,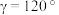 ,如A点原子的分数坐标为
,如A点原子的分数坐标为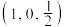 ,则B点Li原子的分数坐标为
,则B点Li原子的分数坐标为
您最近一年使用:0次
解题方法
3 . Ⅰ.MnS纳米粒子被广泛应用于除去重金属离子中的铬离子。
(1)锰的价层电子排布式为______ 。
(2)磁性氧化铁纳米粒子除铬效率不如MnS纳米粒子,试比较两种纳米材料中的阴离子的半径大小O2-______ S2-(填“>”“<”或“=”)。H3O+中H—O—H的键角比H2O中的______ (填“大”或“小”)
(3)Mn可以形成多种配合物,[Mn(CO)(H2O)2(NH3)3]Cl2·H2O中第二周期元素第一电离能由大到小关系为______ ,Mn与CO的C原子形成配位键,该配合物的配位数为______ ,配体NH3的空间结构为______ (用文字描述)。
Ⅱ.
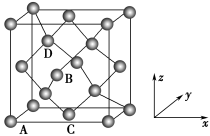
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为______ 。

(5)图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为______ 。已知金刚石的晶胞参数为apm,则其密度为______ g·cm-3(列出计算式)。
(1)锰的价层电子排布式为
(2)磁性氧化铁纳米粒子除铬效率不如MnS纳米粒子,试比较两种纳米材料中的阴离子的半径大小O2-
(3)Mn可以形成多种配合物,[Mn(CO)(H2O)2(NH3)3]Cl2·H2O中第二周期元素第一电离能由大到小关系为
Ⅱ.
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为

(5)图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为
您最近一年使用:0次
4 . 我国在商代或更早就掌握了冶炼铜的技术。以黄铜矿为原料冶炼铜涉及多个反应,其中一个反应为 。
。
(1)基态 的电子排布式为
的电子排布式为___________ ,从原子结构角度上解释,高温下 能转化为
能转化为 的原因是
的原因是___________ 。铜、铁两类原子核外电子运动状态相差___________ 种。
(2) 四种含硫微粒中,中心原子为
四种含硫微粒中,中心原子为 杂化的是
杂化的是___________
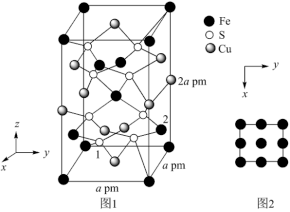
(3) 晶胞结构如图1所示。晶胞中
晶胞结构如图1所示。晶胞中 的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1的坐标分数为(
的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1的坐标分数为( ),则原子2的分数坐标为
),则原子2的分数坐标为___________ ;
 。
。(1)基态
 的电子排布式为
的电子排布式为 能转化为
能转化为 的原因是
的原因是(2)
 四种含硫微粒中,中心原子为
四种含硫微粒中,中心原子为 杂化的是
杂化的是(3)
 晶胞结构如图1所示。晶胞中
晶胞结构如图1所示。晶胞中 的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1的坐标分数为(
的投影位置如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图1中原子1的坐标分数为( ),则原子2的分数坐标为
),则原子2的分数坐标为
您最近一年使用:0次
名校
解题方法
5 . 前四周期原子序数依次增大的六种元素A、B、C、D、E、F 中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D原子的价电子排布式为3d64s2,E原子与D原子的原子序数相差为2。
(1)黄血盐是由A、B、C、D四种元素形成的配合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式___________ ,黄血盐晶体中各种微粒间的作用力不涉及___________ (填序号)。
A.氢键 B.分子间的作用力 C.金属键
D.配位键 E.离子键 F.共价键
(2)A的简单氢化物的键角比B的简单氢化物键角大,原因是___________ 。
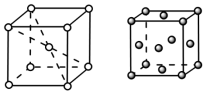
(3)金属C、F晶体的晶胞如图所示(金属C采取体心立方堆积),C、F两种晶体晶胞中金属原子的配位数之比为___________ 。金属F的晶胞中,若设其原子半径为r,晶胞的边长为a,则 r =___________ (用含a的字母表示)。
(1)黄血盐是由A、B、C、D四种元素形成的配合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式
A.氢键 B.分子间的作用力 C.金属键
D.配位键 E.离子键 F.共价键
(2)A的简单氢化物的键角比B的简单氢化物键角大,原因是
(3)金属C、F晶体的晶胞如图所示(金属C采取体心立方堆积),C、F两种晶体晶胞中金属原子的配位数之比为

您最近一年使用:0次
解题方法
6 . 硼单质及其化合物在生产生活中应用广泛。
(1)离子液体是指室温或接近室温时呈液态,而本身由阴、阳离子构成的化合物,被认为是21世纪理想的绿色溶剂。氯代1-丁基-3-甲基咪唑离子液([bmim]Cl)可以与NH4BF4发生离子交换反应合成离子液体([bmim]BF4),如图所示:

①第二周期中第一电离能介于B与N之间的元素有______ 种;NH4BF4中N原子的杂化方式为______ ,BF 的立体构型为
的立体构型为______ 。
②已知分子或离子中的大π键可以用π 表示,其中m表示参与形成大π键的原子数,n表示大π键中的电子数,则[bmim]+中的大π键可以表示为
表示,其中m表示参与形成大π键的原子数,n表示大π键中的电子数,则[bmim]+中的大π键可以表示为_______ 。
(2)硼酸(H3BO3)是极弱的一元酸,如图为H3BO3晶体的片层结构,同一层内硼酸分子间通过_____ 相结合,层与层之间通过______ 相结合。H3BO3在热水中比冷水中溶解度显著增大的主要原因是______ 。

(3)一种新型轻质储氢材料的晶胞结构如图所示:
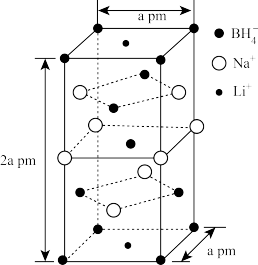
①该化合物的化学式为______ 。
②设阿伏加德罗常数的值为NA,则晶胞的密度为ρ=______ g•cm-3(用含a、NA的代数式表示)。
(1)离子液体是指室温或接近室温时呈液态,而本身由阴、阳离子构成的化合物,被认为是21世纪理想的绿色溶剂。氯代1-丁基-3-甲基咪唑离子液([bmim]Cl)可以与NH4BF4发生离子交换反应合成离子液体([bmim]BF4),如图所示:

①第二周期中第一电离能介于B与N之间的元素有
 的立体构型为
的立体构型为②已知分子或离子中的大π键可以用π
 表示,其中m表示参与形成大π键的原子数,n表示大π键中的电子数,则[bmim]+中的大π键可以表示为
表示,其中m表示参与形成大π键的原子数,n表示大π键中的电子数,则[bmim]+中的大π键可以表示为(2)硼酸(H3BO3)是极弱的一元酸,如图为H3BO3晶体的片层结构,同一层内硼酸分子间通过

(3)一种新型轻质储氢材料的晶胞结构如图所示:

①该化合物的化学式为
②设阿伏加德罗常数的值为NA,则晶胞的密度为ρ=
您最近一年使用:0次
名校
解题方法
7 . 回答下列问题
(1)对于基态Cr原子,下列叙述正确的是_______ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2) 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应键角如图所示。
的空间结构和相应键角如图所示。

 的VSEPR模型为
的VSEPR模型为_______ ; 的沸点比
的沸点比 的
的_______ (填写“高”或“低”),原因是_______ ; 的键角小于
的键角小于 的键角,原因是
的键角,原因是_______ 。
(3) 和NaClO均可作化工生产的氧化剂或氯化剂。制备
和NaClO均可作化工生产的氧化剂或氯化剂。制备 的反应为
的反应为 。
。
①上述方程式中涉及的非金属元素电负性由大到小的顺序是_______ (用元素符号表示)。
②常温时 是一种易溶于
是一种易溶于 的液体,则
的液体,则 分子属于
分子属于_______ 分子(填“极性”或“非极性”)。
③配合物 中心离子
中心离子 的配位数为6,向含
的配位数为6,向含 的溶液中滴加
的溶液中滴加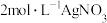 溶液,反应完全后共消耗
溶液,反应完全后共消耗 溶液
溶液 ,则该配合物的化学式为
,则该配合物的化学式为_______ 。
(1)对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为

B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)
 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应键角如图所示。
的空间结构和相应键角如图所示。
 的VSEPR模型为
的VSEPR模型为 的沸点比
的沸点比 的
的 的键角小于
的键角小于 的键角,原因是
的键角,原因是(3)
 和NaClO均可作化工生产的氧化剂或氯化剂。制备
和NaClO均可作化工生产的氧化剂或氯化剂。制备 的反应为
的反应为 。
。①上述方程式中涉及的非金属元素电负性由大到小的顺序是
②常温时
 是一种易溶于
是一种易溶于 的液体,则
的液体,则 分子属于
分子属于③配合物
 中心离子
中心离子 的配位数为6,向含
的配位数为6,向含 的溶液中滴加
的溶液中滴加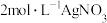 溶液,反应完全后共消耗
溶液,反应完全后共消耗 溶液
溶液 ,则该配合物的化学式为
,则该配合物的化学式为
您最近一年使用:0次
名校
解题方法
8 . 回答下列问题
(1)写出CO 的VSEPR模型名称
的VSEPR模型名称___________ ;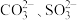 的中心原子上的孤电子对数分别是
的中心原子上的孤电子对数分别是___________ 、___________ 。
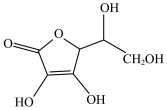
(2)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为___________ ;1mol该分子中π键数为___________ 。
(3)富马酸亚铁(FeC4H2O4)是一种补铁剂。富马酸分子的结构模型如图所示,富马酸分子中 键与
键与 键的数目比为
键的数目比为___________ 。

(4)已知,可用异氰酸苯酯与2—氯—4—氨基吡啶反应生成氯吡苯脲:

反应过程中,每生成 氯吡苯脲,断裂
氯吡苯脲,断裂___________  键,断裂
键,断裂___________  键;已知该2—氯—4—氨基分子中六元环结构与苯环相似,也存在大π键,可表示为
键;已知该2—氯—4—氨基分子中六元环结构与苯环相似,也存在大π键,可表示为___________ (写成π 的形式)
的形式)
(5)N2H 的电子式为
的电子式为___________ ,CH3NH 中N原子的
中N原子的___________ 杂化轨道与H的1s轨道形成σ键;CH3NH 中H-N-H键角比NH3中H-N-H键角
中H-N-H键角比NH3中H-N-H键角___________ (填“大”或“小”),理由是___________ 。
(1)写出CO
 的VSEPR模型名称
的VSEPR模型名称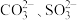 的中心原子上的孤电子对数分别是
的中心原子上的孤电子对数分别是(2)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为

(3)富马酸亚铁(FeC4H2O4)是一种补铁剂。富马酸分子的结构模型如图所示,富马酸分子中
 键与
键与 键的数目比为
键的数目比为
(4)已知,可用异氰酸苯酯与2—氯—4—氨基吡啶反应生成氯吡苯脲:

反应过程中,每生成
 氯吡苯脲,断裂
氯吡苯脲,断裂 键,断裂
键,断裂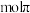 键;已知该2—氯—4—氨基分子中六元环结构与苯环相似,也存在大π键,可表示为
键;已知该2—氯—4—氨基分子中六元环结构与苯环相似,也存在大π键,可表示为 的形式)
的形式)(5)N2H
 的电子式为
的电子式为 中N原子的
中N原子的 中H-N-H键角比NH3中H-N-H键角
中H-N-H键角比NH3中H-N-H键角
您最近一年使用:0次
解题方法
9 . 磷化硼是一种典型的超硬无机材料,常以BCl3,PH3为原料制备。
回答下列问题:
(1)基态P原子与B原子中未成对电子数之比为______ 。P在周期表中的位置___________________
(2)PH3分子的立体结构为________ ;PH3沸点______ (填"高于"或“低于")NH3,理由是__________________ 。
(3)BCl3、PCl3和PF3三种分子中键角由大到小的顺序为_________________ 。
(4)BCl3可转化为硼酸,硼酸为一元弱酸的原因是__________________________________ 。(用电离方程式表示)。
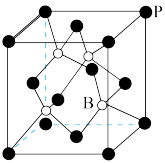
(5)磷化硼晶胞如图所示,其中黑球表示P原子,白球表示B原子,晶胞中磷原子空间堆积方式为______________ 。已知磷化硼晶体的密度为ρg·cm-3,设阿伏加德罗常数的值为NA,则晶胞中B与P间最短距离为_______________ pm。
回答下列问题:
(1)基态P原子与B原子中未成对电子数之比为
(2)PH3分子的立体结构为
(3)BCl3、PCl3和PF3三种分子中键角由大到小的顺序为
(4)BCl3可转化为硼酸,硼酸为一元弱酸的原因是
(5)磷化硼晶胞如图所示,其中黑球表示P原子,白球表示B原子,晶胞中磷原子空间堆积方式为

您最近一年使用:0次
解题方法
10 . A、B、C、D、E为原子序数依次增大的前四周期元素。A原子最外层电子数等于周期序数且原子半径最小;B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同;D原子2p轨道上成对电子数等于未成对电子数;基态E原子的价电子排布式为3d74s2。
(1)基态B原子的核外电子排布式为_______ ;其最高能级的电子云形状为_______ 。
(2)A、C形成的最简单分子的空间构型为_______ ;该分子与A、B形成最简单分子的键角相比_______ 大(填“前者”或“后者”)。
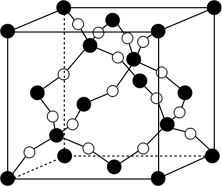
(3)BD2在高温高压下可形成的晶胞如图所示。该晶体熔点可高达1800K,其晶体的类型属于_______ 晶体;1 mol BD2晶体中含有的共价键数目为_______ (阿伏加德罗常数的值为NA)。
(4)[E(NH3)6]3+的空间构型为正八面体,则配合物[E(NH3)3Cl3]的空间结构有_______ 种,[E(NH3)3Cl3]中含有的化学键类型有_______ 。
A.极性共价键 B.离子键 C.配位键 D.金属键 E.氢键
(1)基态B原子的核外电子排布式为
(2)A、C形成的最简单分子的空间构型为
(3)BD2在高温高压下可形成的晶胞如图所示。该晶体熔点可高达1800K,其晶体的类型属于

(4)[E(NH3)6]3+的空间构型为正八面体,则配合物[E(NH3)3Cl3]的空间结构有
A.极性共价键 B.离子键 C.配位键 D.金属键 E.氢键
您最近一年使用:0次



