解题方法
1 . 有A、B、C、D、E五种原子序数增大的元素,只有一种为金属。A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满。
(1)E元素的名称为_________ ,该元素基态原子的价电子排布式为_______________ 。
(2)B与D分别与氢形成最简单氢化物沸点高低顺序为_______ (用化学式表示);原因_________ 。
(3)A、B、C三种元素分别与氢形成化合物中的M-M(M代表A、B、C)单键的键能如下:
上述三种氢化物中,A、B、C元素原子的杂化方式有_____ 种;请解释上表中三种氢化物M-M单键的键能依次下降的原因________________________ 。
(4)D与氯形成的化合物DCl5,加压条件下148℃液化,发生完全电离得到一种能够导电的熔体,测定D-Cl键长为198pm和206pm两种,该熔体中含有一种正四面体结构的阳离子,请写出该条件下DCl5电离的电离方程式_____ ;该熔体中阴离子的空间构型为_________ 。
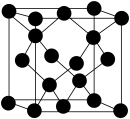
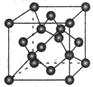
(5)E与C形成的化合物晶体结构有四种,其中一种与金刚石类似,
金刚石晶体结构如下图所示,该晶体的化学式为_____ (用元素符号表示);该晶胞的棱长为a pm则该晶体的密度为________ g·cm-3。
 .
.
(1)E元素的名称为
(2)B与D分别与氢形成最简单氢化物沸点高低顺序为
(3)A、B、C三种元素分别与氢形成化合物中的M-M(M代表A、B、C)单键的键能如下:
| 氢化物 | HxA-AHx | HmB-BHm | HnC-CHn |
| 键能(kJ·mol-1 ) | 346 | 247 | 207 |
(4)D与氯形成的化合物DCl5,加压条件下148℃液化,发生完全电离得到一种能够导电的熔体,测定D-Cl键长为198pm和206pm两种,该熔体中含有一种正四面体结构的阳离子,请写出该条件下DCl5电离的电离方程式
(5)E与C形成的化合物晶体结构有四种,其中一种与金刚石类似,
金刚石晶体结构如下图所示,该晶体的化学式为
 .
.
您最近一年使用:0次
2017-03-15更新
|
341次组卷
|
2卷引用:2017届山东省青岛市高三第一次统一质量检测理综化学试卷
解题方法
2 . 【化学一选修3:物质结构与性质】A、B、C、D、E五种元素的原子序数依次增大。A 是原子半径最小的元素;B的最外层电子数是次外层电子数的2倍; D的L能层有两对成对电子;E+的核外有三个能层,且都外于全满状态。试回答下列问题:
(1)基态E原子核外电子的排布式为___________________ 。
(2)B、C、D三种元素的电负性由大到小的顺序是____________ (填元素符号)。A、C、D三种元素形成的常见离子化合物中阳离子的空间构型为_____________ ,阴离子的中心原子轨道采用______________ 杂化。
(3)E(CA3) 离子的颜色是
离子的颜色是___________ ;含有化学键类型是_____________ ;离子中C原子杂化轨道类型是__________________ 。
(4)D、E能形成两种晶体,其晶胞分别如甲、乙两图。晶体乙中,E的配位数为_________ ;在一定条件下,甲和C2A4反应生成乙,同时生成在常温下分别为气体和液体的另外两种常见无污染物质。该化学反应方程式为______________________ 。
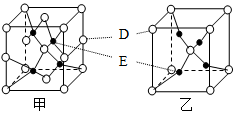
(5)若甲的密度为ρ g/cm3,NA表示阿伏伽德罗常数,则甲晶胞的边长可表示为_________ cm。
(1)基态E原子核外电子的排布式为
(2)B、C、D三种元素的电负性由大到小的顺序是
(3)E(CA3)
 离子的颜色是
离子的颜色是(4)D、E能形成两种晶体,其晶胞分别如甲、乙两图。晶体乙中,E的配位数为

(5)若甲的密度为ρ g/cm3,NA表示阿伏伽德罗常数,则甲晶胞的边长可表示为
您最近一年使用:0次
3 . M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为______ ,晶体中原子间通过_____ 作用形成面心立方密堆积,其中M原子的配位数为______ 。
(2)元素Y基态原子的核外电子排布式为________ ,其同周期元素中,第一电离能最大的是______ (写元素符号)。元素Y的含氧酸中,酸性最强的是________ (写化学式),该酸根离子的立体构型为________ 。
(3)M与Y形成的一种化合物的立方晶胞如图所示。
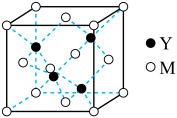
①该化合物的化学式为_______ ,已知晶胞参数a=0.542 nm,此晶体的密度为_______ g·cm–3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是________ 。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______ 。
(1)单质M的晶体类型为
(2)元素Y基态原子的核外电子排布式为
(3)M与Y形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为
②该化合物难溶于水但易溶于氨水,其原因是
您最近一年使用:0次
2016-12-09更新
|
1230次组卷
|
8卷引用:2016年全国普通高等学校招生统一考试化学(海南卷精编版)
解题方法
4 . 氮及其化合物与人类生产、生活息息相关.回答下列问题:
(1)基态N原子中电子在2p轨道上的排布遵循的原则是__________ ,前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为__________ 。
(2)C、N、O三种元素第一电离能从大到小的顺序是__________ 。
(3)N2F2分子中N原子的杂化方式是__________ ,l mol N2F2含有__________ molσ键.
(4)NF3的键角__________ NH3的键角(填“<”“>”或“=”),原因是__________ .
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.l mol NH4BF4__________ mol配位键.
(6)安全气囊的设计原理为6NaN3+FeIO3 Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑
①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质.写出两种与N3-互为等电子体的分子或离子__________ .
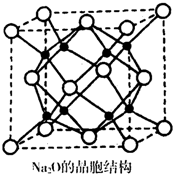
②Na2O的晶胞结构如图所示,晶胞边长为566pm,晶胞中氧原子的配位数为__________ ,Na2O晶体的密度为__________ g•cm-3(只要求列算式,不必计算出结果)。
(1)基态N原子中电子在2p轨道上的排布遵循的原则是
(2)C、N、O三种元素第一电离能从大到小的顺序是
(3)N2F2分子中N原子的杂化方式是
(4)NF3的键角
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.l mol NH4BF4
(6)安全气囊的设计原理为6NaN3+FeIO3
 Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质.写出两种与N3-互为等电子体的分子或离子
②Na2O的晶胞结构如图所示,晶胞边长为566pm,晶胞中氧原子的配位数为

您最近一年使用:0次
解题方法
5 . 【物质结构与性质】硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途。回答下列问题:
(1)写出基态镓原子的电子排布式____________ 。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),结构如图
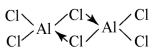
缔合双分子Al2Cl6中Al原子的轨道杂化类型是_______ 。
(3)B原子的电子有_____ 个不同的能级;晶体硼熔点为2300℃,则其为_____ 晶体。
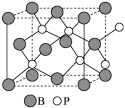
(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得。BP晶胞如图所示。
①画出三溴化硼和三溴化磷的空间结构式。
三溴化硼___________________ 三溴化磷____________________
②在BP晶胞中B的堆积方式为__________________ 。
③计算当晶胞晶格参数为a pm(即图中立方体的每条边长为 a pm)时,磷化硼中硼原子和磷原子之间的最近距离____________ 。
(1)写出基态镓原子的电子排布式
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),结构如图

缔合双分子Al2Cl6中Al原子的轨道杂化类型是
(3)B原子的电子有
(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得。BP晶胞如图所示。

①画出三溴化硼和三溴化磷的空间结构式。
三溴化硼
②在BP晶胞中B的堆积方式为
③计算当晶胞晶格参数为a pm(即图中立方体的每条边长为 a pm)时,磷化硼中硼原子和磷原子之间的最近距离
您最近一年使用:0次
2016-12-09更新
|
139次组卷
|
2卷引用:2016届陕西省西安市长安区十中高三下学期第三次月考化学试卷
解题方法
6 . 人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化、聚乙烯、二氧化硅等17种“分子”改变过人类的世界。
(1)Fe单质为体心立方晶体,晶胞中铁原子的配位数为_______________ ,基态铁原子有_______________ 个未成对电子,Fe3+的电子排布式为_______________ 。
(2)硝酸钾中NO3-的空间构型为_______________ ,写出与NO3-互为等电子体的一种非极性分子化学式_______________ 。
(3)6氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有_______________ 。

(4)下列说法正确的有_______________ (填字母序号)。
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯( )分子中有5n个σ键
)分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60g SiO2放出的能量为(2c-a-b) kJ
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图2所示,写出该反应的化学方程式 _______________ ,若两个最近的Fe原子间的距离为s cm,则该晶体的密度是____________ g•mol-1。
(1)Fe单质为体心立方晶体,晶胞中铁原子的配位数为
(2)硝酸钾中NO3-的空间构型为
(3)6氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有

(4)下列说法正确的有
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(
 )分子中有5n个σ键
)分子中有5n个σ键d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60g SiO2放出的能量为(2c-a-b) kJ
| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
您最近一年使用:0次
7 . E、G、M、Q、T是五种原子序数依次增大的前四周期元素。E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2-具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子。请回答下列问题:
(1)T元素原子的价电子排布式是__________ 。
(2)E、G、M三种元素的第一电离能由大到小的顺序为________ (用元素符号表示),其原因为________ 。
(3)E、G、M的最简单氢化物中,键角由大到小的顺序为________ (用分子式表示),其中G的最简单氢化物的分子立体构型名称为_____________________ ,M的最简单氢化物的分子中中心原子的杂化类型为 ____________ 。M和Q的最简单氢化物的沸点大小顺序为__________ (写化学式)。
(4)EM、GM+、G2互为等电子体,EM的结构式为(若有配位键,请用“→”表示)。E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:________________ 。
(5) TQ在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方TQ晶体结构如图所示,该晶体的密度为pg·cm-3。如果TQ的摩尔质量为Mg.mol-1,阿伏加德罗常数为NA mol-1,则a、b之间的距离为_______ cm。
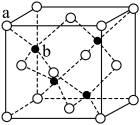
(1)T元素原子的价电子排布式是
(2)E、G、M三种元素的第一电离能由大到小的顺序为
(3)E、G、M的最简单氢化物中,键角由大到小的顺序为
(4)EM、GM+、G2互为等电子体,EM的结构式为(若有配位键,请用“→”表示)。E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:
(5) TQ在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方TQ晶体结构如图所示,该晶体的密度为pg·cm-3。如果TQ的摩尔质量为Mg.mol-1,阿伏加德罗常数为NA mol-1,则a、b之间的距离为

您最近一年使用:0次
解题方法
8 . ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
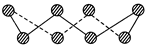
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是________ ;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为____________ ;
(3)Se原子序数为________ ,其核外M层电子的排布式为_____________ ;
(4)H2Se的酸性比H2S________ (填“强”或“弱”)。气态SeO3分子的立体构型为________ , 离子的立体构型为
离子的立体构型为________ ;
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是

(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为
(3)Se原子序数为
(4)H2Se的酸性比H2S
 离子的立体构型为
离子的立体构型为
您最近一年使用:0次
解题方法
9 . 选修原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有________ 种不同运动状态的电子,基态T原子有________ 种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为________ (用元素符号表示)
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为________ 。
(4)Z与R能形成化合物甲,1mol甲中含________ mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为________ ,________ 。
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为________ 。
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为
(7)X单质的晶胞如图所示,一个X晶胞中有________ 个X原子;若X晶体的密度为p g/cm3,阿伏加德罗常数的值为NA,则晶体中最近 的两个X原子之间的距离为________ cm(用代数式表示)。
(1)Y原子核外共有
(2)X、Y、Z的第一电离能由小到大的顺序为
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为
(4)Z与R能形成化合物甲,1mol甲中含
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为
(7)X单质的晶胞如图所示,一个X晶胞中有

您最近一年使用:0次
2016-12-09更新
|
188次组卷
|
3卷引用:2016届宁夏六盘山高级中学高三二模理综化学试卷
解题方法
10 . 【化学选修2:物质结构与性质】四种常见元素的性质或结构信息如下表,根据信息回答有关问题。
(1)A元素与其同周期相邻两种元素原子的第一电离能由大到小的顺序为______ (用元素符号表示);试解释原因_________ 。
(2)B元素的低价氧化物分子中心原子的杂化方式为______ ,B元素的最高价氧化物分子的VSEPR构型为______ ;B元素与D元素形成分子空间构型为______ ;
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点___ (填“高”或“低”),其原因是____ ;
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为_____ ;后一现象的离子方程式为:______ 。
(5)C晶体的堆积方式如图所示,设晶胞边长为a cm,阿伏加德罗常数用NA表示,则晶胞中C原子的配位数为___ ,C晶体的密度为___ g·cm-3(要求写表达式,可以不简化)。

| 元素 | A | B | C | D |
| 性质或结构信息 | 原子核外有两个电子层,最外层有3个未成对电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为:[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中一种是冶炼金属工业的常用还原剂 |
(1)A元素与其同周期相邻两种元素原子的第一电离能由大到小的顺序为
(2)B元素的低价氧化物分子中心原子的杂化方式为
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为
(5)C晶体的堆积方式如图所示,设晶胞边长为a cm,阿伏加德罗常数用NA表示,则晶胞中C原子的配位数为

您最近一年使用:0次



