2018高三·全国·专题练习
名校
解题方法
1 . 铜、硼、硅、砷等元素的化合物是制造新型激光武器和新型太阳能电池的重要材料。回答下列问题:
(1)基态硅原子电子占据的最高能层符号是_____ ,其中能量最高的电子所占据能级的原子轨道有_____ 个伸展方向,原子轨道呈_____ 形。
(2)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有____________ 。
(3)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的第一电离能从大到小的顺序为________ (用元素符号表示)。H2SeO3的酸性_______ H2SeO4(填“强于”或“弱于”),原因是___________ (从分子结构的角度回答)。
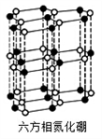
(4)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。它的晶体结构如下左图所示。六方相氮化硼______ π键(填“含有”或“不含”),其质地软的原因是_________ 。NaBH4是一种重要的储氢载体,阴离子的的立体结构为_______ 。
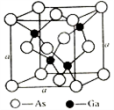
(5)砷化镓是优良的第三代半导体材料。如上图所示为GaAs的晶胞结构。
①与GaAs互为等电子体的一种原子晶体的化学式为________ 。
②已知晶胞的密度是ρ g·cm−3,阿伏伽德罗常数值为NA,棱长a=_____ pm。
(1)基态硅原子电子占据的最高能层符号是
(2)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有
(3)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的第一电离能从大到小的顺序为
(4)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。它的晶体结构如下左图所示。六方相氮化硼

(5)砷化镓是优良的第三代半导体材料。如上图所示为GaAs的晶胞结构。
①与GaAs互为等电子体的一种原子晶体的化学式为
②已知晶胞的密度是ρ g·cm−3,阿伏伽德罗常数值为NA,棱长a=
您最近一年使用:0次
2018-04-24更新
|
202次组卷
|
3卷引用:2018年高考化学原创押题预测卷01(新课标Ⅱ卷)
(已下线)2018年高考化学原创押题预测卷01(新课标Ⅱ卷)【全国百强校】黑龙江省大庆实验中学2019届高三上学期11月月考(期中)理科综合化学试题四川省成都经济技术开发区实验中学校2019届高三上学期12月月考化学试题
2018高三·全国·专题练习
解题方法
2 . 黄铜矿(CuFeS2)是炼铜的最主要矿物,火法炼铜时发生反应:2CuFeS2+O2=Cu2S+2FeS+SO2。
(1)Fe在周期表中的位置为__________ ;Fe、S、O原子的第一电离能由大到小的顺序是____________ 。
(2)CuFeS2中Cu元素有________ 个未成对电子,Cu2S中Cu元素基态时电子排布式为_____________ 。
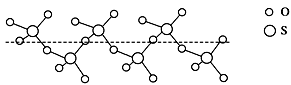
(3)SO2分子的立体构型为________ ,SO2可氧化生成SO3,SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中S原子的杂化轨道类型是________ 。
(4)已知FeO、FeS熔点分别为1369℃、1193℃,解释熔点FeO高于FeS 的原因__________________ 。
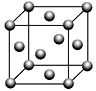
(5)Cu的晶胞如图所示,晶体密度为ρ g·cm-3。晶胞中等距最近的Cu原子有________ 个,晶胞的边长为____________________ (用含ρ和NA的式子表示)。
(1)Fe在周期表中的位置为
(2)CuFeS2中Cu元素有
(3)SO2分子的立体构型为

(4)已知FeO、FeS熔点分别为1369℃、1193℃,解释熔点FeO高于FeS 的原因

(5)Cu的晶胞如图所示,晶体密度为ρ g·cm-3。晶胞中等距最近的Cu原子有
您最近一年使用:0次
名校
解题方法
3 . 原子序数小于36的X、Y、Z、W四种元素,其中X是周期表中原子半径最小的元素,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为28。回答下列问题:
(1)化合物ZX3与化合物YX4的VSPER构型相同,均为正四面体,其分子中化学键的键角较大的是____ (用分子式表示,下同),原因是______________________________ 。
(2)与Z同主族且上下相邻的三种非金属元素与X可形成结构相似的三种物质,试推测三者的稳定性由大到小的顺序________________ ,理由是___________________ ;三者的沸点由高到低的顺序是________ ,解释原因_____________________________ 。
(3)1mol Y2X2 含有σ键的数目为________ 。
(4)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是___________ 。
(5)W元素在周期表的位置是_________。
(1)化合物ZX3与化合物YX4的VSPER构型相同,均为正四面体,其分子中化学键的键角较大的是
(2)与Z同主族且上下相邻的三种非金属元素与X可形成结构相似的三种物质,试推测三者的稳定性由大到小的顺序
(3)1mol Y2X2 含有σ键的数目为
(4)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是
(5)W元素在周期表的位置是_________。
您最近一年使用:0次
名校
4 . 铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①Cu2+的价电子排布图________________ ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为_______________________ (填元素符号)。
②SO42-的空间构型为_____________ ,SO32-离子中心原子的杂化方式为__________ 。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式:___________ 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是________
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因_____________________ .
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①Cu2+的价电子排布图
②SO42-的空间构型为
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式:
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因
您最近一年使用:0次
名校
5 . (1)计算下列分子或离子中带点“·”原子的价电子对数。
①C Cl4________ ;②B eCl2________ ;③B Cl3________ ;④P Cl3________ 。
(2)计算下列微粒中带点“·”原子的孤电子对数。
①H2S ________ ;②P Cl5________ ;③B F3________ ;④N H3________ 。
①
(2)计算下列微粒中带点“·”原子的孤电子对数。
①H2
您最近一年使用:0次
6 . 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两种元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D四种元素电负性由大到小排列顺序为_____________________ 。
(2)B的氢化物的结构式_____________ ,其空间构型为_________________________ 。
(3)E核外电子排布式是_________ ,E的某种化合物的结构如下图所示。
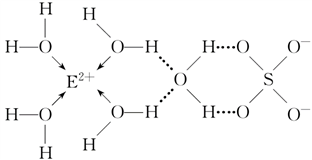
微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有___________ 。
(4)A与B的气态氢化物的沸点______ 更高,A与D的气态氢化物的沸点________ 更高。
(5)A的稳定氧化物中,中心原子的杂化类型为______ ,空间构型为______ 。
(1)A、B、C、D四种元素电负性由大到小排列顺序为
(2)B的氢化物的结构式
(3)E核外电子排布式是

微粒间的相互作用包括化学键和分子间相互作用力,此化合物中各种粒子间的相互作用力有
(4)A与B的气态氢化物的沸点
(5)A的稳定氧化物中,中心原子的杂化类型为
您最近一年使用:0次
2018-02-10更新
|
1026次组卷
|
6卷引用:人教版2017-2018学年高二化学选修三同步训练:第二章 分子结构与性质
人教版2017-2018学年高二化学选修三同步训练:第二章 分子结构与性质(人教版2019)选择性必修2 模块综合测评(已下线)模块同步卷07 第二章综合检测-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)山西省怀仁市大地学校2020-2021学年高二下学期第三次月考化学试题四川省安岳县兴隆中学高2021-2022学年 高二上学期10月月考化学试题 贵州省凯里学院附属中学2021-2022学年高二下学期3月月考化学试题
名校
7 . Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的作用。
(1)Cu+的核外电子排布式为__________ ;N元素与O元素的第一电离能比较:N____ O(填“>”、“<”或“=”)。
(2)与N3-含有相同电子数的四原子分子的空间构型为____________________ 。
(3)在Cu催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中醛其(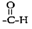 )碳原子的杂化方式为
)碳原子的杂化方式为_________ 。
(4)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被C1-取代可生成Cu(H2O)2Cl2,试画出其具有极性的分子的结构式_________ 。
(5)Cu3N 的晶胞结构如图所示,N3-的配位数为________ ;若晶胞棱长为anm,NA表示阿伏伽德罗常数的值,则Cu3N的密度p=______ g/cm3[用含a和NA 的式子表示,Mr(Cu3N)=206]
 .
.
(1)Cu+的核外电子排布式为
(2)与N3-含有相同电子数的四原子分子的空间构型为
(3)在Cu催化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中醛其(
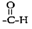 )碳原子的杂化方式为
)碳原子的杂化方式为(4)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被C1-取代可生成Cu(H2O)2Cl2,试画出其具有极性的分子的结构式
(5)Cu3N 的晶胞结构如图所示,N3-的配位数为
 .
.
您最近一年使用:0次
2018-01-30更新
|
265次组卷
|
3卷引用:四川省雅安市2017-2018学年高二上学期期末考试化学试题
四川省雅安市2017-2018学年高二上学期期末考试化学试题新疆奎屯市第一高级中学2018-2019学年高二下学期第一次月考化学试题(已下线)四川省棠湖中学2018-2019学年高二上学期期末模拟理综-化学试题
8 . 钾、氟及锌的相关化合物用途非常广泛。回答下列问题:
(1)基态锌原子的价电子排布式为___________ ;K、F、Zn的电负性从大到小的顺序为___________ 。
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是_______________ 。
(3)OF2分子的几何构型为___________ ,中心原子的杂化类型为___________ 。
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在___________ ;与O3-互为等电子体的分子为___________ (任 写一种 )。
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。
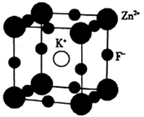
①晶胞中Zn2+的配位数为___________ 个。
②晶胞中紧邻的两个F-间的距离为_______________________ (列出算式即可)nm。
③该晶体的密度为___________ (列出算式即可,用NA表示阿伏伽德罗常数的数值)g·cm-3。
(1)基态锌原子的价电子排布式为
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是
(3)OF2分子的几何构型为
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。

①晶胞中Zn2+的配位数为
②晶胞中紧邻的两个F-间的距离为
③该晶体的密度为
您最近一年使用:0次
2018-01-07更新
|
409次组卷
|
6卷引用:甘肃省张掖市2018届高三第一次质量检测考试理综化学试题
9 . X、Y、Z、U、W是原子序数依次增大的前四周期元素。其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2;U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子。请回答下列问题:
(1)X、Y、Z的第一电离能从大到小的顺序是_____________ (用元素符号表示,下同)。
(2)写出W的价电子排布式__________________________ ,W同周期的元素中,与W原子最外层电子数相等的元素还有_____________ 。
(3)X、Y、Z的简单氢化物的键角从大到小的顺序是__________________________ (用化学式表示),原因是__________________________ 。
(4)由元素Y与U元素组成的化合物A,晶胞结构如图所示(黑球表示Y原子,白球表示U原子),请写出化合物A的化学式_____________ ,该物质硬度大,推测该物质为_____________ 晶体。其中Y元素的杂化方式是_____________ 。
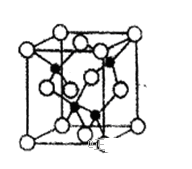
(1)X、Y、Z的第一电离能从大到小的顺序是
(2)写出W的价电子排布式
(3)X、Y、Z的简单氢化物的键角从大到小的顺序是
(4)由元素Y与U元素组成的化合物A,晶胞结构如图所示(黑球表示Y原子,白球表示U原子),请写出化合物A的化学式

您最近一年使用:0次
名校
10 . 位于前四周期的8种元素A、B、C、D、E、F、G、H的原子序数依次增大,其中A是所有原子中原子半径最小的,且与B同族,C的基态原子2P能级上只有1个电子,F可与A可按原子个数比1∶1和1∶2形成化合物;F与G同族,H的原子序数为29,根据上述信息描述,请回答下列问题:
(1)请写出上述8种元素中电负性最大的元素与B元素形成常见的化合物的化学式_______ (用具体元素符号表示的化学式),写出基态原子的第一电离能最大的元素在周期表中的位置为________ 。
(2)写出H的原子在基态时的核外电子排布式为____________ 。
(3)1mol D2A6分子(链状)中含有 键的数目为
键的数目为____________ 。
(4)已知A2F2分子结构如图a所示,则其中心原子杂化轨道类型为_________ 。
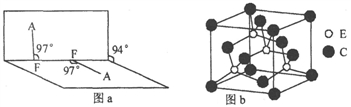
(5)判断A2F2________ (填难或易)溶于DG2,并简要说明原因___________ 。
(6)C与E形成某化合物的晶胞如图 b所示,则处于晶胞顶角上的原子的配位数为________ ,若该化合物的密度为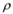 g·cm
g·cm ,阿伏伽德罗常数为NA,则两个最近E原子间的距离为
,阿伏伽德罗常数为NA,则两个最近E原子间的距离为_______ pm(用含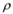 、NA的代数式表示)。
、NA的代数式表示)。
(1)请写出上述8种元素中电负性最大的元素与B元素形成常见的化合物的化学式
(2)写出H的原子在基态时的核外电子排布式为
(3)1mol D2A6分子(链状)中含有
 键的数目为
键的数目为(4)已知A2F2分子结构如图a所示,则其中心原子杂化轨道类型为

(5)判断A2F2
(6)C与E形成某化合物的晶胞如图 b所示,则处于晶胞顶角上的原子的配位数为
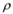 g·cm
g·cm ,阿伏伽德罗常数为NA,则两个最近E原子间的距离为
,阿伏伽德罗常数为NA,则两个最近E原子间的距离为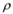 、NA的代数式表示)。
、NA的代数式表示)。
您最近一年使用:0次



