名校
解题方法
1 . Ⅰ.物质的光学性质在科研中有重要的用途,回答下列问题:
一种比率光声探针M与 配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如图所示:
配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如图所示:________  中键角F-B-F(填“>”、“<”或“=”);基态
中键角F-B-F(填“>”、“<”或“=”);基态 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为________ 。
(2)均为平面结构的吡咯( )和吡啶(
)和吡啶( )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为________ ,原因是________ 。
Ⅱ.分析如图晶胞结构特点,回答下列问题:
(3)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。已知:立方氮化硼密度为 ,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为
,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为 ,则该晶胞中原子的空间利用率(晶胞中原子的体积占晶胞体积的百分率)为
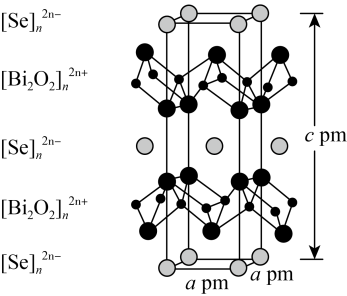
,则该晶胞中原子的空间利用率(晶胞中原子的体积占晶胞体积的百分率)为________ (列出计算式即可,不用化简)。 层与带负电的
层与带负电的 层交替堆积。据此推断硒氧化铋的化学式为
层交替堆积。据此推断硒氧化铋的化学式为________ 。晶胞棱边夹角均为90°,则晶体密度的计算式为________  。
。
一种比率光声探针M与
 配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如图所示:
配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如图所示: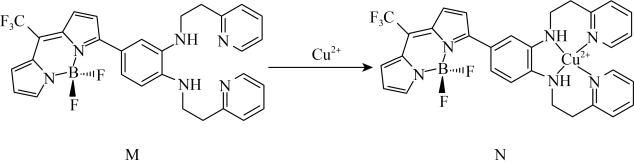
 中键角F-B-F(填“>”、“<”或“=”);基态
中键角F-B-F(填“>”、“<”或“=”);基态 的价电子中,两种自旋状态的电子数之比为
的价电子中,两种自旋状态的电子数之比为(2)均为平面结构的吡咯(
 )和吡啶(
)和吡啶( )是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为
)是合成该探针的原料,吡咯和吡啶在盐酸中溶解度较大的为Ⅱ.分析如图晶胞结构特点,回答下列问题:
(3)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。已知:立方氮化硼密度为
 ,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为
,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为 ,则该晶胞中原子的空间利用率(晶胞中原子的体积占晶胞体积的百分率)为
,则该晶胞中原子的空间利用率(晶胞中原子的体积占晶胞体积的百分率)为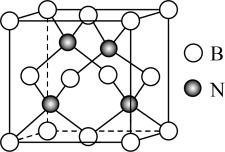
 层与带负电的
层与带负电的 层交替堆积。据此推断硒氧化铋的化学式为
层交替堆积。据此推断硒氧化铋的化学式为 。
。
您最近一年使用:0次
解题方法
2 . 钛及其化合物在生产、生活中有着广泛的用途。回答下列问题:
(1)Ti(BH4)3是一种储氢材料。BH 的空间构型为
的空间构型为_______ ;Ti 、B、H元素的电负性由大到小排列顺序为_______ 。
(2)已知Ti3+易形成多种配合物,[TiCl( H2O)5]Cl2· H2O是其中的一种。
①1 mol该配合物中含有_______ molσ键。
②中心离子杂化方式为_______ (填标号)。
a.sp2 b.sp3 c.sp3d d.sp3d2
③Ti3+具有较强还原性的原因是_______ 。
(3)研究表明,TiO2通过氮掺杂反应可生成TiO2-x Ny,能使TiO2对可见光具有活性,反应如图所示。

①上图TiO2晶胞中钛原子占据_______ 个氧原子围成的八面体空隙。
②已知所有的Ti-O键键长为rpm,B点原子的分数坐标为( ,
, ,
, ),则A点原子的分数坐标为
),则A点原子的分数坐标为_______ ;晶胞中A、B间距离为_______ pm;TiO2晶体密度为_______ g·cm-3(设NA为阿伏加德罗常数的值)。
③TiO2-x Ny晶体中x=_______ 。
(1)Ti(BH4)3是一种储氢材料。BH
 的空间构型为
的空间构型为(2)已知Ti3+易形成多种配合物,[TiCl( H2O)5]Cl2· H2O是其中的一种。
①1 mol该配合物中含有
②中心离子杂化方式为
a.sp2 b.sp3 c.sp3d d.sp3d2
③Ti3+具有较强还原性的原因是
(3)研究表明,TiO2通过氮掺杂反应可生成TiO2-x Ny,能使TiO2对可见光具有活性,反应如图所示。

①上图TiO2晶胞中钛原子占据
②已知所有的Ti-O键键长为rpm,B点原子的分数坐标为(
 ,
, ,
, ),则A点原子的分数坐标为
),则A点原子的分数坐标为③TiO2-x Ny晶体中x=
您最近一年使用:0次
名校
解题方法
3 . 钛(Ti)和锆(Zr)是同一副族的相邻元素,它们的化合物在生产、生活中有着广泛的用途。回答下列问题:
(1)钛和锆的价层电子结构相同,基态锆原子的价电子排布式为_______ ;与钛位于同一周期且基态原子单电子数与钛相同的元素,第一电离能由大到小的顺序为_______ (用元素符号填空)。
(2)Ti(BH4)2是一种储氢材料。BH 的空间构型是
的空间构型是_______ 。
(3)下列各组微粒互为等电子体的是_______(填字母标号)。
(4)ZrCl4可以与乙二胺形成配合物[ZrCl4(H2NCH2CH2NH2)]。
①1mol [ZrCl4(H2NCH2CH2NH2)]中含有σ键的物质的量为_______ mol。
②H2NCH2CH2NH2形成[ZrCl4(H2NCH2CH2NH2)]后,H-N-H键角将_______ (填“变大”、“变小”或“不变”),原因是_______ 。
(5)已知TiO2晶胞中Ti4+位于O2-所构成的正八面体的体心,ZrO2晶胞中Zr4+位于O2-所构成的立方体的体心,其晶胞结构如下图所示。

①TiO2晶胞中O2-的配位数是_______ 。
②TiO2晶胞中A、B的原子坐标为(0.69,0.69,1),(0.19,0.81,0.5),则C原子坐标为_______ 。
③已知二氧化锆晶胞的密度为ρ g·cm-3,则晶体中Zr原子和O原子之间的最短距离_______ pm(列出表达式,NA为阿伏加德罗常数的值,ZrO2的摩尔质量为M g/mol)。
(1)钛和锆的价层电子结构相同,基态锆原子的价电子排布式为
(2)Ti(BH4)2是一种储氢材料。BH
 的空间构型是
的空间构型是(3)下列各组微粒互为等电子体的是_______(填字母标号)。
| A.H2O与SO2 | B.CO2与N2O | C.CH2O与BF3 | D.C6H6与B3N3H6 |
①1mol [ZrCl4(H2NCH2CH2NH2)]中含有σ键的物质的量为
②H2NCH2CH2NH2形成[ZrCl4(H2NCH2CH2NH2)]后,H-N-H键角将
(5)已知TiO2晶胞中Ti4+位于O2-所构成的正八面体的体心,ZrO2晶胞中Zr4+位于O2-所构成的立方体的体心,其晶胞结构如下图所示。

①TiO2晶胞中O2-的配位数是
②TiO2晶胞中A、B的原子坐标为(0.69,0.69,1),(0.19,0.81,0.5),则C原子坐标为
③已知二氧化锆晶胞的密度为ρ g·cm-3,则晶体中Zr原子和O原子之间的最短距离
您最近一年使用:0次
名校
解题方法
4 . 根据所学物质结构与性质的知识回答下列问题。
(1)超分子化学已逐渐扩展到化学的各个领域。由Mo将2个C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。
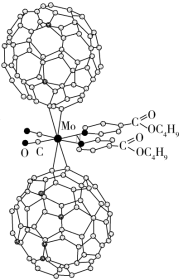
①Mo处于第五周期第VIB族,价电子排布与Cr相似,它的基态价电子排布图是___________ ,该超分子中存在的化学键类型有___________ (填选项字母)。
A.离子键B.氢键C.σ键D.π键
②该超分子中,配体CO提供孤电子对的原子是___________ (填元素符号),p-甲酸丁酯吡啶配体中C原子的杂化方式有___________ 。
(2)氟及其化合物用途非常广泛。
①聚四氟乙烯是一种准晶体,可通过___________ 方法区分晶体、准晶体和非晶体。
②AsF3、IF 、OF2,BeF2中价层电子对数不同于其它微粒的是
、OF2,BeF2中价层电子对数不同于其它微粒的是___________ (填化学式,下同),其立体构型为___________ 。
③室温氟穿梭电池的电解质为氟氢离子液体,含HF 、[(FH)2F]-、[(FH)3F]-等离子,画出[(FH)3F]-的结构式
、[(FH)2F]-、[(FH)3F]-等离子,画出[(FH)3F]-的结构式___________ 。
④基于CaF2设计的Born-Haber循环如图所示。
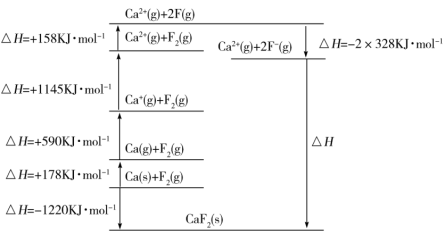
钙的第一电离能为___________ kJ·mol-1;F-F键的键能为___________ kJ·mol-1。
(1)超分子化学已逐渐扩展到化学的各个领域。由Mo将2个C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。

①Mo处于第五周期第VIB族,价电子排布与Cr相似,它的基态价电子排布图是
A.离子键B.氢键C.σ键D.π键
②该超分子中,配体CO提供孤电子对的原子是
(2)氟及其化合物用途非常广泛。
①聚四氟乙烯是一种准晶体,可通过
②AsF3、IF
 、OF2,BeF2中价层电子对数不同于其它微粒的是
、OF2,BeF2中价层电子对数不同于其它微粒的是③室温氟穿梭电池的电解质为氟氢离子液体,含HF
 、[(FH)2F]-、[(FH)3F]-等离子,画出[(FH)3F]-的结构式
、[(FH)2F]-、[(FH)3F]-等离子,画出[(FH)3F]-的结构式④基于CaF2设计的Born-Haber循环如图所示。

钙的第一电离能为
您最近一年使用:0次
2021-08-30更新
|
319次组卷
|
2卷引用:山东省济宁市2020-2021学年高二下学期期末考试化学试题



