12-13高二上·四川遂宁·期中
名校
解题方法
1 . 下列说法错误的是
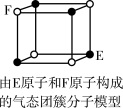
A.从CH4、 、 、 为正四面体结构,可推测PH 为正四面体结构,可推测PH 、 、 也为正四面体结构 也为正四面体结构 |
| B.1mol金刚石晶体中,平均含有2molC-C键 |
| C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键 |
| D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
您最近一年使用:0次
2022-10-31更新
|
245次组卷
|
8卷引用:山东省枣庄市第三中学2019-2020学年高二下学期3月网上测试化学试题
名校
解题方法
2 . NaH和NaAlH4都是重要的还原剂,一定条件下金属钠和H2反应生成NaH。NaH与水反应可生成H2,NaH与AlCl3反应可得到NaAlH4。下列说法错误的是
| A.NaAlH4中阴离子空间构型为正四面体 |
| B.NaH与AlCl3得到NaAlH4的反应属于氧化还原反应 |
| C.NaH在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3) |
| D.金属钠和H2反应生成NaH的反应体系需要控制无氧、无水和无酸等条件 |
您最近一年使用:0次
2020-12-06更新
|
876次组卷
|
5卷引用:山东省青岛市黄岛区2021届高三上学期期中考试化学试题
山东省青岛市黄岛区2021届高三上学期期中考试化学试题(已下线)练习14 分子的空间结构-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)河北省石家庄市第一中学2020-2021学年高二下学期学情反馈(一)化学试题
名校
解题方法
3 . 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D的第一电离能由小到大的顺序为___________ 。
(2)C的氢化物分子是_____ (填“极性”或“非极性”)分子。
(3)化合物BD3的分子空间构型是______ 。
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断E(CO)5的晶体类型为__________ ;E(CO)5中的配体CO与N2、CN-等互为等电子体,写出CO分子的结构式_______ 。
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。体心立方晶胞和面心立方晶胞中实际含有的E原子个数之比为___________ 。

(1)A、B、C、D的第一电离能由小到大的顺序为
(2)C的氢化物分子是
(3)化合物BD3的分子空间构型是
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断E(CO)5的晶体类型为
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。体心立方晶胞和面心立方晶胞中实际含有的E原子个数之比为

您最近一年使用:0次
2020-09-04更新
|
261次组卷
|
2卷引用:山东省济宁市微山县第二中学2021届高三上学期开学收心考试化学试题
名校
解题方法
4 . 氮化硼(BN)晶体有多种结构。回答下列问题:
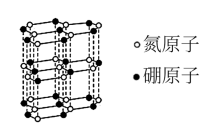
(1)六方氮化硼的结构与石墨相似(如图所示),具有层状结构,可作高温润滑剂。该晶体中存在的作用力类型有___________ ,六方氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为___________ 。
(2)六方氮化硼在高温高压下,可以转化为立方氮化硼(如图所示),立方氮化硼密度为 ,该c原子的坐标参数为
,该c原子的坐标参数为 ,e为(
,e为( ,
, ,0),f为(
,0),f为( ,0,
,0, )。
)。
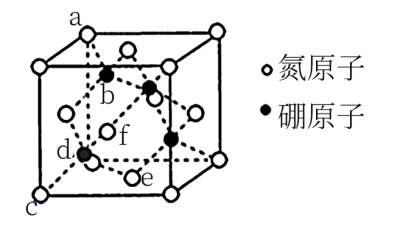
①由题干所给的坐标参数知,d原子的坐标参数为________ 。
②B原子填充在N原子的四面体空隙,且占据此类空隙的比例为________ 。
③a位置N原子与b位置B原子的距离为_______ cm。
(1)六方氮化硼的结构与石墨相似(如图所示),具有层状结构,可作高温润滑剂。该晶体中存在的作用力类型有

(2)六方氮化硼在高温高压下,可以转化为立方氮化硼(如图所示),立方氮化硼密度为
 ,该c原子的坐标参数为
,该c原子的坐标参数为 ,e为(
,e为( ,
, ,0),f为(
,0),f为( ,0,
,0, )。
)。
①由题干所给的坐标参数知,d原子的坐标参数为
②B原子填充在N原子的四面体空隙,且占据此类空隙的比例为
③a位置N原子与b位置B原子的距离为
您最近一年使用:0次
2020·山东·模拟预测
解题方法
5 . 决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
元素M化合态常见化合价是____ 价,其基态原子电子排布式为______________ 。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为__________________ 。
(3)PO43-的中心原子的杂化方式为____ ,该离子的空间构型为____ ,键角为____ ,其等电子体有____ (请写出两种)。
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为____ ;已知Ca2+和F-半径分别为a cm、b cm,阿伏加 德罗常数为NA,M为摩尔质量,则晶体密度为____ g·cm-3(不必化简)。
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为____ ,原因为______ 。

(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ/mol | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为
(3)PO43-的中心原子的杂化方式为
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为

您最近一年使用:0次
2020·山东·模拟预测
解题方法
6 . (12分)氮原子可以形成σ键、π键、大π键和配位键,成键的多样性使其形成了多种具有独特组成的物质。回答下列问题:
(1)第一电离能:氮_______ 氧(填“大于”或“小于”),基态氮原子价电子排布图不是 ,是因为该排布方式违背了
,是因为该排布方式违背了________________ 。
(2)肼(H2N−NH2)分子中孤电子对与σ键的数目之比为__________ ,肼的相对分子质量与乙烯接近,但沸点远高于乙烯的原因是________________________________ 。
(3)正硝酸钠(Na3NO4)为白色晶体,是一种重要的化工原料。
图中“●”表示_________ (填“Na+”或“O2−”),距离“●”最近且等距离的“○”有_____ 个,Na2O晶胞的参数为a pm,则晶胞密度为_______________ g•cm−3。(列出计算式即可,NA为阿伏加 德罗常数的值)
(1)第一电离能:氮
 ,是因为该排布方式违背了
,是因为该排布方式违背了(2)肼(H2N−NH2)分子中孤电子对与σ键的数目之比为
(3)正硝酸钠(Na3NO4)为白色晶体,是一种重要的化工原料。
①Na3NO4阴离子的空间构型为
②分别写出一种与Na3NO4的阴离子互为等电子体的阴离子和分子
③在573 K条件下,实验室中用NaNO3和Na2O在银皿中反应制得Na3NO4,Na2O的立方晶胞如图所示。

图中“●”表示
您最近一年使用:0次



