1 . 樱黄素(乙)具有抗过敏、抗炎、抗肿瘤和保护心脑血管等多方面生物活性。以金雀异黄酮(甲)为原料,经碘甲烷甲基化合成樱黄素的反应如下,下列说法正确的是

| A.甲、乙所含官能团种类不相同 |
B.乙分子中所有原子杂化类型均为 |
C.一定条件下,甲与足量的 加成产物的分子中有8个手性碳原子 加成产物的分子中有8个手性碳原子 |
D.甲、乙既能与 溶液反应,又能与 溶液反应,又能与 溶液反应 溶液反应 |
您最近一年使用:0次
2 . 2022年诺贝尔化学奖授予了点击化学领域的三位科学家。一价铜催化的叠氮化物-炔烃环加成反应可谓点击化学中的第一个经典之作,其中 代表烃基,含氮五元环为平面结构,催化剂
代表烃基,含氮五元环为平面结构,催化剂 的结构属立方晶系,晶胞如图所示,下列说法正确的是
的结构属立方晶系,晶胞如图所示,下列说法正确的是

 代表烃基,含氮五元环为平面结构,催化剂
代表烃基,含氮五元环为平面结构,催化剂 的结构属立方晶系,晶胞如图所示,下列说法正确的是
的结构属立方晶系,晶胞如图所示,下列说法正确的是
A.基态 的价电子排布图为 的价电子排布图为 |
B.五元环中 和 和 原子轨道的杂化类型相同 原子轨道的杂化类型相同 |
C. 的第一电离能从大到小的顺序是 的第一电离能从大到小的顺序是 |
D.若晶胞参数为 ,则距离最近的两个 ,则距离最近的两个 之间的距离为 之间的距离为 |
您最近一年使用:0次
解题方法
3 . 氧化镓是一种新型超宽窄带半导体材料,由于自身的优异性能,在紫外探测、高频功率器件等领域吸引了越来越多的关注和研究,中国科技部将其列入“十四五研发计划”,让第四代半导体获得更广泛的关注。回答下列问题:
(1)基态 原子最外层电子排布式为
原子最外层电子排布式为_______ 。
(2)①氧化镓的熔点为1740℃,氧化钙的熔点为2613℃,但有的离子晶体如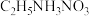 (硝酸乙基铵)的熔点只有12℃。
(硝酸乙基铵)的熔点只有12℃。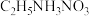 中N原子的杂化轨道类型是
中N原子的杂化轨道类型是_______ , 离子的空间结构为
离子的空间结构为_______ ,该物质中所含化学键类型:_______ (填字母)。
A.金属键 B.离子键 C.共价键 D.范德华力 E.σ键
②第一电离能:Al_______ Mg(填“>”或“<”),其原因是_______ 。
(3)锑化物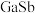 是一种超窄禁带半导体材料,可用于红外探测其晶胞结构如图所示。若该晶体的密度为
是一种超窄禁带半导体材料,可用于红外探测其晶胞结构如图所示。若该晶体的密度为 ,设Ga和Sb的原子半径分别为
,设Ga和Sb的原子半径分别为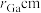 和
和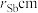 ,则原子的空间占有率为
,则原子的空间占有率为_______  (列出计算表达式,
(列出计算表达式,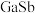 的摩尔质量为
的摩尔质量为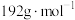 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 )。
)。

(1)基态
 原子最外层电子排布式为
原子最外层电子排布式为(2)①氧化镓的熔点为1740℃,氧化钙的熔点为2613℃,但有的离子晶体如
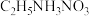 (硝酸乙基铵)的熔点只有12℃。
(硝酸乙基铵)的熔点只有12℃。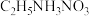 中N原子的杂化轨道类型是
中N原子的杂化轨道类型是 离子的空间结构为
离子的空间结构为A.金属键 B.离子键 C.共价键 D.范德华力 E.σ键
②第一电离能:Al
(3)锑化物
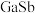 是一种超窄禁带半导体材料,可用于红外探测其晶胞结构如图所示。若该晶体的密度为
是一种超窄禁带半导体材料,可用于红外探测其晶胞结构如图所示。若该晶体的密度为 ,设Ga和Sb的原子半径分别为
,设Ga和Sb的原子半径分别为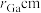 和
和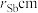 ,则原子的空间占有率为
,则原子的空间占有率为 (列出计算表达式,
(列出计算表达式,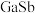 的摩尔质量为
的摩尔质量为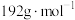 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
4 . 阿魏酸(结构如图)存在于蔬菜和坚果中,在化妆品中主要作为收敛剂、抗炎剂。下列说法错误的是
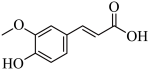

A.分子式为 ,碳原子有两种杂化方式 ,碳原子有两种杂化方式 |
B.可以使 的 的 溶液、酸性高锰酸钾溶液褪色 溶液、酸性高锰酸钾溶液褪色 |
C. 阿魏酸最多可与 阿魏酸最多可与  发生反应 发生反应 |
| D.分子中所有碳原子一定处于同一平面内 |
您最近一年使用:0次
名校
5 . 短周期主族元素X,Y,Z,W的原子序数依次增大,在如图所示转化关系中,甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物。其中A为W元素组成的单质,常温下为黄绿色气体,常温下乙为液体,丁物质常用于消毒、漂白。下列说法错误的是
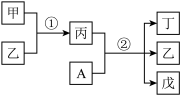

| A.这四种元素中Z的原子半径最大 |
| B.丁中既有离子键又有极性共价键 |
| C.Y、Z形成的化合物中阴、阳离子数目比为1:1 |
D.Y、Z、W形成的三种较高化合价的化合物中,W的杂化方式是 |
您最近一年使用:0次
2022-11-26更新
|
339次组卷
|
2卷引用:山西省太原市第五中学校2022-2023学年高三上学期期末考试化学试题
解题方法
6 . 金属钼(Mo)常用于工业、军事等领域,已被多个国家列为战略金属,我国的钼储量居世界第二。已知钼在元素周期表中呈现的信息为
(1)钼位于元素周期表的位置是_______ ,基态Mo原子核外有_______ 种不同运动状态的电子,其核外电子排布式是_______ 。
(2)辉钼( )在纳米电子设备制造领域比硅或富勒烯(如Co)更有优势,可用
)在纳米电子设备制造领域比硅或富勒烯(如Co)更有优势,可用 硫化
硫化 溶液生产辉钼。O、N、S的第一电离能由大到小的顺序为
溶液生产辉钼。O、N、S的第一电离能由大到小的顺序为_______ , 中心原子的杂化轨道类型为
中心原子的杂化轨道类型为_______ 。
(3) 纳米粒子具有类似于石墨的层状结构,具有优异的润滑性能,其原因是
纳米粒子具有类似于石墨的层状结构,具有优异的润滑性能,其原因是_______ 。
(4)Mo能与CO形成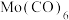 的配合物,其中Mo的化合价为
的配合物,其中Mo的化合价为_______ ,其配体分子与 具有相似的化学结构,则该配体分子中σ键与π键数目之比为
具有相似的化学结构,则该配体分子中σ键与π键数目之比为_______ 。
(5)金属钼晶体中的原子堆积方式如图所示,这种堆积方式为_______ 堆积。若晶体钼的密度为 ,钼原子半径为r pm,
,钼原子半径为r pm, 表示阿伏加德罗常数的值,M表示钼的相对原子质量,则钼晶胞中原子的空间利用率为
表示阿伏加德罗常数的值,M表示钼的相对原子质量,则钼晶胞中原子的空间利用率为_______ (用含有ρ、r、 、M的代数式表示)。
、M的代数式表示)。

(1)钼位于元素周期表的位置是
(2)辉钼(
 )在纳米电子设备制造领域比硅或富勒烯(如Co)更有优势,可用
)在纳米电子设备制造领域比硅或富勒烯(如Co)更有优势,可用 硫化
硫化 溶液生产辉钼。O、N、S的第一电离能由大到小的顺序为
溶液生产辉钼。O、N、S的第一电离能由大到小的顺序为 中心原子的杂化轨道类型为
中心原子的杂化轨道类型为(3)
 纳米粒子具有类似于石墨的层状结构,具有优异的润滑性能,其原因是
纳米粒子具有类似于石墨的层状结构,具有优异的润滑性能,其原因是(4)Mo能与CO形成
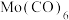 的配合物,其中Mo的化合价为
的配合物,其中Mo的化合价为 具有相似的化学结构,则该配体分子中σ键与π键数目之比为
具有相似的化学结构,则该配体分子中σ键与π键数目之比为(5)金属钼晶体中的原子堆积方式如图所示,这种堆积方式为
 ,钼原子半径为r pm,
,钼原子半径为r pm, 表示阿伏加德罗常数的值,M表示钼的相对原子质量,则钼晶胞中原子的空间利用率为
表示阿伏加德罗常数的值,M表示钼的相对原子质量,则钼晶胞中原子的空间利用率为 、M的代数式表示)。
、M的代数式表示)。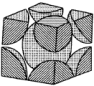
您最近一年使用:0次
2022-05-28更新
|
251次组卷
|
3卷引用:山西运城盐湖五中2023-2024学年高三上学期期末考试化学试题
解题方法
7 . 铜及其化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1)[Cu(NH3)2]Ac溶液可以吸收合成氨中对催化剂有毒害的CO气体[醋酸根(CH3COO-)简写成Ac-],反应的化学方程式为:[Cu(NH3)2]Ac+CO+NH3 [Cu(NH3)3CO]Ac。
[Cu(NH3)3CO]Ac。
①基态Cu+的核外电子排布式为_____ 。
②CH3COO-中C原子的杂化轨道类型为_____ 。
③[Cu(NH3)2]Ac中所含非金属元素的电负性由大到小的顺序是_____ (用元素符号表示)。
④[Cu(NH3)2]+中N原子形成的H—N—H键角_____ (填“大于”“小于”或“等于”)气态NH3中的键角,原因是_____ 。
⑤1个[Cu(NH3)3CO]+中含有的共价键数为_____ 。
(2)Cu—Mn—Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:
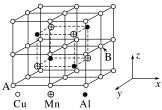
①合金的化学式为_____ 。
②若A原子的坐标参数为(0,1,0),则B原子的坐标参数为_____ 。
③已知该合金晶体的密度为ρg·cm-3,则最近的两个Al原子间的距离为_____ nm(阿伏加德罗常数的值用NA表示)。
(1)[Cu(NH3)2]Ac溶液可以吸收合成氨中对催化剂有毒害的CO气体[醋酸根(CH3COO-)简写成Ac-],反应的化学方程式为:[Cu(NH3)2]Ac+CO+NH3
 [Cu(NH3)3CO]Ac。
[Cu(NH3)3CO]Ac。①基态Cu+的核外电子排布式为
②CH3COO-中C原子的杂化轨道类型为
③[Cu(NH3)2]Ac中所含非金属元素的电负性由大到小的顺序是
④[Cu(NH3)2]+中N原子形成的H—N—H键角
⑤1个[Cu(NH3)3CO]+中含有的共价键数为
(2)Cu—Mn—Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:

①合金的化学式为
②若A原子的坐标参数为(0,1,0),则B原子的坐标参数为
③已知该合金晶体的密度为ρg·cm-3,则最近的两个Al原子间的距离为
您最近一年使用:0次
解题方法
8 . 半导体砷化硼具有超高的导热系数,有助于电子器件降温散热。回答下列问题:
(1)基态硼原子的价电子排布式为_______ ,根据“对角线规则”,硼的性质与_______ (填名称)相似。
(2)实验测得,砷的第一电离能大于硒的第一电离能,原因是_______ 。
(3)三氧化二砷的分子结构如图所示,其中砷原子的杂化方式是_______ ,1 mol As4O6中含有的σ键数目为_______ 。

(4)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),则H、B、N电负性由大到小的顺序是_______ 。
(5)氢化物的沸点:SbH3>NH3>AsH3,其理由是_______ 。
(6)砷化硼的晶胞结构如图(a)所示,图(b)中矩形AA'C'C是沿如图(a)放置的晶胞对角面取得的截图。

①若该晶体的密度为a g/cm3,设B和As的原子半径分别为rB pm和rAs pm,则原子的空间占有率为_______ ×100%(列出计算表达式,阿伏加德罗常数的值为NA)。
②晶胞中各原子在矩形AA'C'C中的位置为_______ (填“甲”、“乙”、“丙”、“丁”)。
甲. 乙.
乙. 
丙. 丁.
丁. 
(1)基态硼原子的价电子排布式为
(2)实验测得,砷的第一电离能大于硒的第一电离能,原因是
(3)三氧化二砷的分子结构如图所示,其中砷原子的杂化方式是

(4)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),则H、B、N电负性由大到小的顺序是
(5)氢化物的沸点:SbH3>NH3>AsH3,其理由是
(6)砷化硼的晶胞结构如图(a)所示,图(b)中矩形AA'C'C是沿如图(a)放置的晶胞对角面取得的截图。

①若该晶体的密度为a g/cm3,设B和As的原子半径分别为rB pm和rAs pm,则原子的空间占有率为
②晶胞中各原子在矩形AA'C'C中的位置为
甲.
 乙.
乙. 
丙.
 丁.
丁. 
您最近一年使用:0次
9 . I.金(79Au)是一种非常稳定的金属,但也可以形成多种化合物,并在化合物中呈一价或三价。
(1)已知Au的基态原子的价电子排布式为5dl06s1,则Au位于周期表______ 区。基态Au3+的价电子中空间运动状态不同的电子数为______ 种
(2)有一种化合物由Cs、Cl、Au三种元素组成,其晶胞如下。大球为Cs,小球为Cl,其余球为Au。
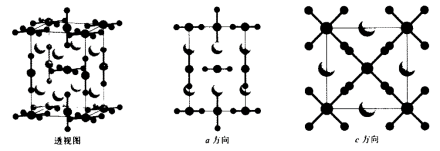
该化合物的化学式为______ ,其中金原子有2种不同的化学环境,形成2种不同的配离子,它们分别是______ 和______ 。
II.过渡金属钛、铜、锌等金属及其化合物在工业上有重要用途。
(3)TiOSO4溶液中加入H2O2可以生成稳定的[TiO(H2O2)]+。己如SzCl2的分子结构与H2O2相似,第一电离能(I1): I1(O)______ I1(S)(填“大于或“小于”),原因是______ ;沸点: H2O2______ S2Cl2(填“>”或“<”),其原因是______ 。
(4)超细铜粉可用作导电材料、催化剂等,制备方法如下:
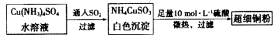
①关于[Cu(NH3)4]SO4和NH4CuSO3中的阴离子相同之处为______ 不同之处为______ ( 填标号)
A.中心原子的杂化轨道类型 B.中心原子的孤电子对数
C.立体结构 D.VSEPR模型
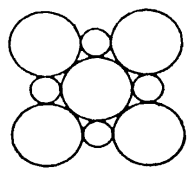
III.(5)MgO具有NaCl型结构(示意图如图所示),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为______ nm(结果保留三位小数)。
(1)已知Au的基态原子的价电子排布式为5dl06s1,则Au位于周期表
(2)有一种化合物由Cs、Cl、Au三种元素组成,其晶胞如下。大球为Cs,小球为Cl,其余球为Au。

该化合物的化学式为
II.过渡金属钛、铜、锌等金属及其化合物在工业上有重要用途。
(3)TiOSO4溶液中加入H2O2可以生成稳定的[TiO(H2O2)]+。己如SzCl2的分子结构与H2O2相似,第一电离能(I1): I1(O)
(4)超细铜粉可用作导电材料、催化剂等,制备方法如下:

①关于[Cu(NH3)4]SO4和NH4CuSO3中的阴离子相同之处为
A.中心原子的杂化轨道类型 B.中心原子的孤电子对数
C.立体结构 D.VSEPR模型
III.(5)MgO具有NaCl型结构(示意图如图所示),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为

您最近一年使用:0次
解题方法
10 . 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回 答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]___________ ,有___________ 种不同运动状态的电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是___________ 。
(3)如下表所示,GeCl4、GeBr4、GeI4的熔沸点依次升高,原因___________ 。
(4)催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn位于周期表___________ 区,Zn、Ge、O电负性由大至小的顺序是___________ 。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为___________ ,微粒之间存在的作用力是___________ 。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2 );C为(1/2,1/2,0)。则D原子的坐标参数为___________ 。
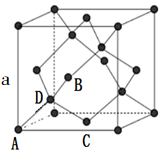
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为___________ g·cm-3(阿佛加的罗常数的值用NA表示。列出计算式即可)。
(1)基态Ge原子的核外电子排布式为[Ar]
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是
(3)如下表所示,GeCl4、GeBr4、GeI4的熔沸点依次升高,原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/C | -49.5 | 26 | 146 |
| 沸点/C | 83.1 | 186 | 约400 |
(4)催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn位于周期表
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2 );C为(1/2,1/2,0)。则D原子的坐标参数为


②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为
您最近一年使用:0次



