解题方法
1 . 铬的化合物应用广泛,工业上以铬铁矿(含Al、Si氧化物等杂质)为主要原料制备红矾钠(Na2Cr2O7·2H2O)的工艺流程如下图。已知:①FeCr2O4中Cr化合价为+3;
②焙烧的目的是将FeCr2O4转化为Na2CrO4,并将Al、Si氧化物转化为可溶性钠盐。

请回答下列问题:
(1)基态铬原子的价电子排布式为___________ 。
(2)为了提高焙烧效果,可采取的一种措施是___________ 。
(3)浸取所得的滤渣为Fe2O3,由此推断FeCr2O4焙烧时发生反应的主要化学方程式为:___________ 。
(4)常温下,矿物中相关元素可溶性组分物质的量浓度的常用对数[1g(c/mol·L-1)]与pH的关系如图所示。当溶液中可溶性组分浓度c≤1.0×10-5mol·L-1时,可认为已除尽,则“中和”时pH的理论范围为___________ ;“酸化”过程中的离子方程式为___________ 。

(5)三价铬离子能形成多种配位化合物, [Cr(NH3)3(H2O)2Cl]Cl,是其中一种,该配合物中心离子的配位数为___________ ;配体中分子的中心原子杂化方式为___________ 。
(6)工业上常用电解法处理含Cr2O 的酸性废水,用金属铁阳极、石墨作阴极,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。若电解后溶液中c(Cr3+)=3.0×10-5mol·L-1,则c(Fe3+)=
的酸性废水,用金属铁阳极、石墨作阴极,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。若电解后溶液中c(Cr3+)=3.0×10-5mol·L-1,则c(Fe3+)=___________ mol·L-1。(已知Ksp[Cr(OH)3]=6.0×10-31,Ksp[Fe(OH)3]可从第(4)小题图中计算得出)。
②焙烧的目的是将FeCr2O4转化为Na2CrO4,并将Al、Si氧化物转化为可溶性钠盐。

请回答下列问题:
(1)基态铬原子的价电子排布式为
(2)为了提高焙烧效果,可采取的一种措施是
(3)浸取所得的滤渣为Fe2O3,由此推断FeCr2O4焙烧时发生反应的主要化学方程式为:
(4)常温下,矿物中相关元素可溶性组分物质的量浓度的常用对数[1g(c/mol·L-1)]与pH的关系如图所示。当溶液中可溶性组分浓度c≤1.0×10-5mol·L-1时,可认为已除尽,则“中和”时pH的理论范围为

(5)三价铬离子能形成多种配位化合物, [Cr(NH3)3(H2O)2Cl]Cl,是其中一种,该配合物中心离子的配位数为
(6)工业上常用电解法处理含Cr2O
 的酸性废水,用金属铁阳极、石墨作阴极,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。若电解后溶液中c(Cr3+)=3.0×10-5mol·L-1,则c(Fe3+)=
的酸性废水,用金属铁阳极、石墨作阴极,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。若电解后溶液中c(Cr3+)=3.0×10-5mol·L-1,则c(Fe3+)=
您最近一年使用:0次
2022-09-09更新
|
276次组卷
|
2卷引用:湖北省“宜荆荆恩”2023届高三上学期起点考试化学试题
解题方法
2 . 碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛。
(1)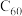 分子的晶体中,在晶胞的顶点和面心均含有一个
分子的晶体中,在晶胞的顶点和面心均含有一个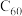 分子,则一个
分子,则一个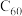 晶胞的质量为
晶胞的质量为_______ 。
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是_____ (填字母)。
a.晶体的熔点:干冰>冰
b.晶体中的空间利用率:干冰>冰
c.晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的是______ (填字母)。
a.金刚石中碳原子的杂化类型为 杂化,石墨中碳原子的杂化类型为
杂化,石墨中碳原子的杂化类型为 杂化
杂化
b.晶体中共价键的键长:金刚石中 <石墨中
<石墨中
C.晶体的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
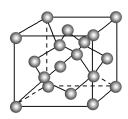
(4)金刚石晶胞结构如下图,立方 结构与金刚石相似,在
结构与金刚石相似,在 晶体中,
晶体中, 原子周围最近的
原子周围最近的 原子所构成的立体图形为
原子所构成的立体图形为_______ , 原子与
原子与 原子之间共价键与配位键的数目比为
原子之间共价键与配位键的数目比为_______ ,一个晶胞中 原子数目为
原子数目为___________ 。
(5)已知 单质的晶体密度为
单质的晶体密度为 ,
, 的相对原子质量为
的相对原子质量为 ,阿伏加 德罗常数为
,阿伏加 德罗常数为 ,则
,则 的原子半径为
的原子半径为_________ 。
(1)
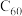 分子的晶体中,在晶胞的顶点和面心均含有一个
分子的晶体中,在晶胞的顶点和面心均含有一个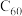 分子,则一个
分子,则一个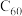 晶胞的质量为
晶胞的质量为(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是
a.晶体的熔点:干冰>冰
b.晶体中的空间利用率:干冰>冰
c.晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的是
a.金刚石中碳原子的杂化类型为
 杂化,石墨中碳原子的杂化类型为
杂化,石墨中碳原子的杂化类型为 杂化
杂化b.晶体中共价键的键长:金刚石中
 <石墨中
<石墨中
C.晶体的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体

(4)金刚石晶胞结构如下图,立方
 结构与金刚石相似,在
结构与金刚石相似,在 晶体中,
晶体中, 原子周围最近的
原子周围最近的 原子所构成的立体图形为
原子所构成的立体图形为 原子与
原子与 原子之间共价键与配位键的数目比为
原子之间共价键与配位键的数目比为 原子数目为
原子数目为(5)已知
 单质的晶体密度为
单质的晶体密度为 ,
, 的相对原子质量为
的相对原子质量为 ,阿伏加 德罗常数为
,阿伏加 德罗常数为 ,则
,则 的原子半径为
的原子半径为
您最近一年使用:0次



