1 . 乙苯脱氢法是目前国内外生产苯乙烯的主要方法,研究发现,在 气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图:
气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图:
 气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图:
气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图: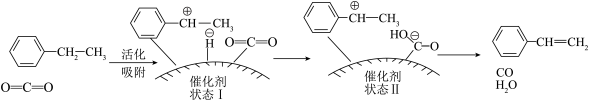
| A.乙苯和苯乙烯均为非极性分子 |
| B.催化剂表面碱性较强时有利于提高乙苯的转化率 |
C.反应涉及 、 、 断裂和 断裂和 形成 形成 |
D.该方法可减少 的排放,有利于实现“碳中和” 的排放,有利于实现“碳中和” |
您最近一年使用:0次
名校
2 . 配合物在许多尖端领域如激光材料、超导材料、抗癌药物的研究、催化剂的研制、自组装超分子等方面有广泛的应用。回答下列问题:
(1)《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的 、
、 生成的红色配合物X是最早的媒染染料。
生成的红色配合物X是最早的媒染染料。 的核外电子的运动状态有
的核外电子的运动状态有________ 种,配合物X中 的配体有
的配体有________ ,茜素的水溶性较好的主要原因是________ 。
(2)Ni与CO形成的配合物 为无色液体,易溶于
为无色液体,易溶于 、
、 等有机溶剂。
等有机溶剂。 为
为________ (填“极性”或“非极性”)分子,分子中 键与
键与 键的个数之比为
键的个数之比为________ 。
(3)向 溶液中滴加铁氰化钾溶液后,经提纯、结晶可得到一种蓝色晶体
溶液中滴加铁氰化钾溶液后,经提纯、结晶可得到一种蓝色晶体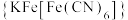 。实验表明,
。实验表明, 、
、 、
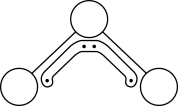
、 通过配位键构成了晶体的骨架,其局部结构如图1,记为Ⅰ型立方结构。将Ⅰ型立方结构平移、旋转、并置,可得到晶体的复晶胞(如图2,记为Ⅱ型立方结构,下层左后的小立方体g未标出)。
通过配位键构成了晶体的骨架,其局部结构如图1,记为Ⅰ型立方结构。将Ⅰ型立方结构平移、旋转、并置,可得到晶体的复晶胞(如图2,记为Ⅱ型立方结构,下层左后的小立方体g未标出)。________ 实验,可确定该晶体结构。
② 的配位数为
的配位数为________ 。
③若 位于Ⅱ型立方结构的棱心和体心,则
位于Ⅱ型立方结构的棱心和体心,则 位于Ⅱ型立方结构的
位于Ⅱ型立方结构的________ ;一个Ⅱ型立方结构中含________ 个 ;若该蓝色晶体的密度为
;若该蓝色晶体的密度为 ,Ⅱ型立方结构的边长为anm,则阿伏加德罗常数的值可表示为
,Ⅱ型立方结构的边长为anm,则阿伏加德罗常数的值可表示为________ 。
(1)《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的
 、
、 生成的红色配合物X是最早的媒染染料。
生成的红色配合物X是最早的媒染染料。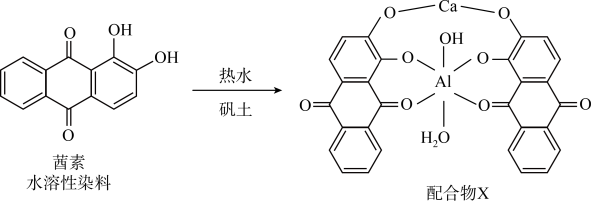
 的核外电子的运动状态有
的核外电子的运动状态有 的配体有
的配体有(2)Ni与CO形成的配合物
 为无色液体,易溶于
为无色液体,易溶于 、
、 等有机溶剂。
等有机溶剂。 为
为 键与
键与 键的个数之比为
键的个数之比为(3)向
 溶液中滴加铁氰化钾溶液后,经提纯、结晶可得到一种蓝色晶体
溶液中滴加铁氰化钾溶液后,经提纯、结晶可得到一种蓝色晶体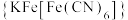 。实验表明,
。实验表明, 、
、 、
、 通过配位键构成了晶体的骨架,其局部结构如图1,记为Ⅰ型立方结构。将Ⅰ型立方结构平移、旋转、并置,可得到晶体的复晶胞(如图2,记为Ⅱ型立方结构,下层左后的小立方体g未标出)。
通过配位键构成了晶体的骨架,其局部结构如图1,记为Ⅰ型立方结构。将Ⅰ型立方结构平移、旋转、并置,可得到晶体的复晶胞(如图2,记为Ⅱ型立方结构,下层左后的小立方体g未标出)。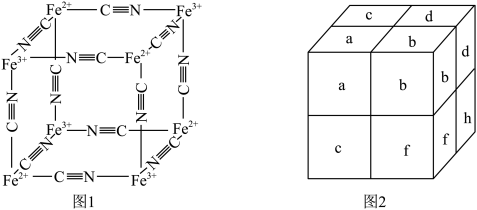
②
 的配位数为
的配位数为③若
 位于Ⅱ型立方结构的棱心和体心,则
位于Ⅱ型立方结构的棱心和体心,则 位于Ⅱ型立方结构的
位于Ⅱ型立方结构的 ;若该蓝色晶体的密度为
;若该蓝色晶体的密度为 ,Ⅱ型立方结构的边长为anm,则阿伏加德罗常数的值可表示为
,Ⅱ型立方结构的边长为anm,则阿伏加德罗常数的值可表示为
您最近一年使用:0次
名校
解题方法
3 . 1994年度诺贝尔化学奖授予为研究臭氧做出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图,呈V形,键角116.5o,与SO2近似,三个原子以一个O原子为中心,与另外两个O原子分别构成一个极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个大π键——三个O原子均等地享有这4个电子。在1.01×105Pa,273K时,O3在催化剂作用下能迅速转化为O2,当生成该状态下22.4L O2时,转移电子数的物质的量为
| A.1 mol | B.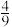 mol mol | C.0 mol | D.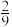 mol mol |
您最近一年使用:0次
4 . 被称为“不倒翁”的凉水石,其外观与翡翠极为相似。某种凉水石的化学式为 ,X、Y、Z、R、T均为前四周期元素且原子序数依次增大。X原子的电子只有一种自旋取向,基态T原子的核外电子恰好填满10个原子轨道。R元素的单质可作为制造太阳能电池帆板的半导体材料,Y的p轨道上的电子数为R的p轨道上电子数的一半。下列说法正确的是
,X、Y、Z、R、T均为前四周期元素且原子序数依次增大。X原子的电子只有一种自旋取向,基态T原子的核外电子恰好填满10个原子轨道。R元素的单质可作为制造太阳能电池帆板的半导体材料,Y的p轨道上的电子数为R的p轨道上电子数的一半。下列说法正确的是
 ,X、Y、Z、R、T均为前四周期元素且原子序数依次增大。X原子的电子只有一种自旋取向,基态T原子的核外电子恰好填满10个原子轨道。R元素的单质可作为制造太阳能电池帆板的半导体材料,Y的p轨道上的电子数为R的p轨道上电子数的一半。下列说法正确的是
,X、Y、Z、R、T均为前四周期元素且原子序数依次增大。X原子的电子只有一种自旋取向,基态T原子的核外电子恰好填满10个原子轨道。R元素的单质可作为制造太阳能电池帆板的半导体材料,Y的p轨道上的电子数为R的p轨道上电子数的一半。下列说法正确的是| A.原子半径:R>X>Y |
| B.同一周期,第一电离能比Z小的元素有1种 |
| C.Y形成的单质只能为非极性分子 |
| D.简单氢化物的沸点:Y>T |
您最近一年使用:0次
名校
解题方法
5 . 某种阴离子结构如图所示,Q、W、X、Y、Z五种短周期元素的原子半径依次增大,基态Q原子的电子填充了3个能级,有4对成对电子,Z与其他元素不在同一周期。下列说法正确的是
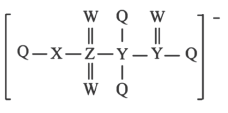
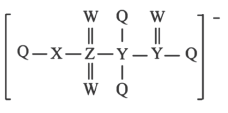
| A.Q和W形成的化合物中W为正价 | B.最简单氢化物的沸点: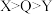 |
| C.Q、W、X的单质分子均为非极性分子 | D.同周期中第一电离能小于X的元素有4种 |
您最近一年使用:0次
2024-01-14更新
|
401次组卷
|
2卷引用:陕西省咸阳市实验中学2023-2024学年高二上学期段性检测(一)化学试题
名校
解题方法
6 . 盐X溶液能发生如图所示的转化关系(部分反应的反应条件已略),相对分子质量:c比b大16,f比e大16。下列推断正确的是


| A.X可能为正盐,也可能为酸式盐 | B.将b通入a的水溶液中可能生成白色沉淀 |
| C.a、b、c、d、e、f可能都是极性分子 | D.反应①、②可能具有相同的实验现象 |
您最近一年使用:0次
2022-04-01更新
|
2157次组卷
|
8卷引用:重庆市西南大学附属中学校2022届高三模拟考试(一)化学试题
重庆市西南大学附属中学校2022届高三模拟考试(一)化学试题(已下线)专项06 元素及其化合物-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考考前押题密卷(辽宁卷)辽宁省沈阳市东北育才双语学校2022-2023学年高三上学期第一次模拟测试化学试题湖南省长沙市雅礼中学2022-2023学年高三上学期第五次月考化学试题湖南省攸县第三中学2022-2023学年高三第六次月考化学试题湖南省株洲市第四中学2023届高三第六次月考化学试题天津市和平区天津市耀华中学2023-2024学年高三上学期第三次月考化学试卷
解题方法
7 . 黄铜矿是炼铜的最主要矿物,在野外很容易被误会为黄金,又称愚人金。
(1)向CuSO4溶液中加入过量的氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是______
A. 氨气极易溶于水,是因为NH3分子和水分子之间形成3种不同的氢键
B. [Cu(NH3)4]SO4组成元素中。N、O、S第一电离能大小顺序是O>N>S
C. [Cu(NH3)4]SO4所含有的化学键有离子键、极性键和配位键
D. NH3分子和H2O分子的空间构型不同,且氨气分子的键角小于水分子的键角
(2)Te位于周期表中__________ 族,H2Te比H2S沸点__________ (填“高”或“低”)。某处于激发态的S原子,其中1个3s电子跃迁到3p轨道中,该激发态S原子的核外电子排布式为__________ 。
(3)S有+4和+6两种价态的氧化物,回答下列问题:
①下列关于气态SO3和SO2的说法中,正确的是__________
A. 中心原子的价层电子对数目相等 B. 都是极性分子
C. 中心原子的孤对电子数目相等 D. 都含有极性键
②将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图1,此固态SO3中S原子的杂化轨道类型是__________ 。

(4)Cu有+1和+2两种价态的化合物,回答下列问题:
①Cu+的价层轨道示意图为__________ ,Cu2+有__________ 个未成对电子。
②新制的Cu(OH)2能够溶解于过量浓碱溶液中,反应的离子方程式是___________________
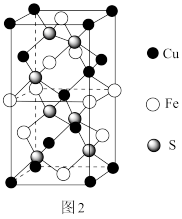
(5)CuFeS2的晶胞如图2所示,晶胞参数a=0.524nm,c=1.032nm;CuFeS2的晶胞中每个Cu原子与__________ 个S原子相连,列式计算晶体密度 ρ= __________ g•cm-3.
(1)向CuSO4溶液中加入过量的氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是
A. 氨气极易溶于水,是因为NH3分子和水分子之间形成3种不同的氢键
B. [Cu(NH3)4]SO4组成元素中。N、O、S第一电离能大小顺序是O>N>S
C. [Cu(NH3)4]SO4所含有的化学键有离子键、极性键和配位键
D. NH3分子和H2O分子的空间构型不同,且氨气分子的键角小于水分子的键角
(2)Te位于周期表中
(3)S有+4和+6两种价态的氧化物,回答下列问题:
①下列关于气态SO3和SO2的说法中,正确的是
A. 中心原子的价层电子对数目相等 B. 都是极性分子
C. 中心原子的孤对电子数目相等 D. 都含有极性键
②将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图1,此固态SO3中S原子的杂化轨道类型是

(4)Cu有+1和+2两种价态的化合物,回答下列问题:
①Cu+的价层轨道示意图为
②新制的Cu(OH)2能够溶解于过量浓碱溶液中,反应的离子方程式是
(5)CuFeS2的晶胞如图2所示,晶胞参数a=0.524nm,c=1.032nm;CuFeS2的晶胞中每个Cu原子与

您最近一年使用:0次



