名校
1 . 下列说法正确的是
| A.HF、HCl、HBr、HI中共价键的极性逐渐减弱,而熔、沸点逐渐升高 |
| B.TiCl4熔点是-25℃,沸点是136.4℃,可溶于苯和CCl4,该晶体属于分子晶体 |
| C.SiO2属于共价晶体,熔化时破坏共价键和分子间作用力 |
| D.O3、H2O2均是含非极性键的非极性分子 |
您最近一年使用:0次
2022-04-20更新
|
118次组卷
|
2卷引用:黑龙江省牡丹江市第一高级中学2021-2022学年高二下学期4月月考化学试题
名校
2 . 下列说法中正确的是
A.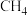 、 、 、 、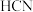 都是含有极性键的非极性分子 都是含有极性键的非极性分子 |
B. 与 与 的立体构型相似,都是非极性分子 的立体构型相似,都是非极性分子 |
C.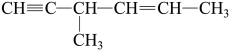 分子中含有 分子中含有 个手性碳原子 个手性碳原子 |
D. 键的电子云图形是镜面对称的,而 键的电子云图形是镜面对称的,而 键的电子云图形是轴对称的 键的电子云图形是轴对称的 |
您最近一年使用:0次
2022-04-19更新
|
148次组卷
|
3卷引用:黑龙江省大庆中学2021-2022学年高二下学期第一次月考化学试题
名校
3 . 下列对分子的性质的解释中,不正确的是
| A.水很稳定(1000℃以上才会部分分解),是因为水中含有大量的氢键 |
B. 分子的结构为 分子的结构为 ,可知 ,可知 为极性分子 为极性分子 |
| C.“碘易溶于四氯化碳”“甲烷难溶于水”都可用相似相溶原理解释 |
D.H2O和 中心原子均为 中心原子均为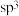 杂化,前者空间结构为 杂化,前者空间结构为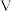 形,后者为正四面体形 形,后者为正四面体形 |
您最近一年使用:0次
2022-04-19更新
|
227次组卷
|
4卷引用:黑龙江省大庆中学2021-2022学年高二下学期第一次月考化学试题
名校
4 . 下列说法中正确的是
| A.价层电子排布为3d104s1的原子位于第四周期第IA族,属于s区元素 |
| B.SO2分子和O3分子的空间结构均为V形 |
C.有机物CH3-CH=CH3分子中有1个π键、2个 键 键 |
| D.O3为非极性分子 |
您最近一年使用:0次
2022-04-19更新
|
114次组卷
|
2卷引用:黑龙江省大庆中学2021-2022学年高二下学期第一次月考化学试题
名校
5 . 下列说法正确的是
| A.含有N、O、F的分子一定能形成氢键 |
| B.分子的沸点只受范德华力的影响 |
| C.氯化氢易溶于水是因为与水形成氢键 |
| D.NH3、H2O均属于极性分子且中心原子均为sp3杂化 |
您最近一年使用:0次
2022-04-19更新
|
160次组卷
|
3卷引用:黑龙江省大庆中学2021-2022学年高二下学期第一次月考化学试题
名校
解题方法
6 . 某化合物的分子式为AB2,常温下为气态。A属第ⅥA族元素,B属第ⅦA族元素,A和B在同一周期,它们的电负性分别为3.5和4.0,已知AB2分子的键角为103.3°。下列推断不正确的是
| A.AB2分子的VSEPR模型为四面体形 |
| B.A—B键为极性共价键,AB2分子为极性分子 |
| C.简单气态氢化物的稳定性:A<B |
| D.AB2与H2O相比,AB2的熔点、沸点比H2O的高 |
您最近一年使用:0次
2022-04-04更新
|
290次组卷
|
2卷引用:黑龙江省肇东市第四中学2021-2022学年高二下学期期中考试化学试题
名校
解题方法
7 . 下列反应是合成某种抗肿瘤药物的一步,下列说法正确的是
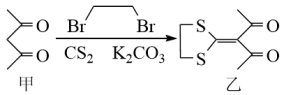

| A.乙分子有2个手性碳原子 |
B. 中阴离子的VSEPR模型为正四面体形 中阴离子的VSEPR模型为正四面体形 |
C.物质甲中含 键和 键和 键的数目之比为3:1 键的数目之比为3:1 |
D. 是由极性键构成的非极性分子 是由极性键构成的非极性分子 |
您最近一年使用:0次
2022-03-24更新
|
314次组卷
|
5卷引用:黑龙江省鸡西实验中学2021-2022学年高二下学期第一次月考化学试题
8 . 下列说法错误的是
A.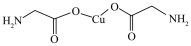 σ键和π键比例为9:1 σ键和π键比例为9:1 |
| B.某元素气态基态原子的逐级电离能(kJ•mol-1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+ |
C.C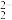 与O 与O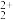 互为等电子体,1molO 互为等电子体,1molO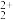 中含有的π键数目为2NA,O 中含有的π键数目为2NA,O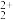 的电子式为 的电子式为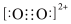 |
D.H2O2的分子立体构型为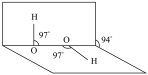 ,由此可知H2O2为非极性分子 ,由此可知H2O2为非极性分子 |
您最近一年使用:0次
2022-03-20更新
|
529次组卷
|
9卷引用:黑龙江省绥化市第九中学2021-2022学年高二4月月考化学试题
黑龙江省绥化市第九中学2021-2022学年高二4月月考化学试题黑龙江省哈尔滨市德强高级中学2021-2022学年高二下学期4月月考化学试题重庆市第七中学2021-2022学年高二下学期第一次月考化学试题吉林省吉林市第一中学2021-2022学年高二下学期第一次质量检测化学试题广西壮族自治区玉林市博白县中学2021-2022学年高二下学期4月月考理综化学试题福建省福州第一中学2021-2022学年高二下学期期中考试化学试题广西玉林市博白县中学2021-2022学年高二下学期第一次月考理综化学试题福建省福州市五校(金山中学、 十八中、华侨中学、教院附中、闽江学院附中)2022-2023学年高二下学期期中考试化学试题河北省沧州市东光县等三县联考2022-2023学年高二下学期4月月考化学试题
名校
9 . 影响物质在水中的溶解程度的因素有很多,下列关于溶解的说法错误的是
| A.分子晶体溶于水,会破坏分子间作用力,分子间作用力越大,溶解度可能越小 |
| B.能形成分子间氢键的物质常温下在水中的溶解度一定很大 |
| C.极性分子在水中的溶解度一般比较大 |
| D.物质溶于水有可能破坏化学键,甚至形成新的化学键 |
您最近一年使用:0次
2022-03-18更新
|
307次组卷
|
2卷引用:黑龙江省绥化市第九中学2021-2022学年高二4月月考化学试题
名校
解题方法
10 . 有X、Y、Z、Q、T五种元素,X原子M层上有2个未成对电子且无空轨道;Y原子的价层电子排布式为3d64s2;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的p能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是
| A.元素Y和Q可形成化合物Y2Q3 |
| B.T和Z各有一种单质的空间构型为正四面体形 |
| C.元素X和Z形成的化合物不可能是分子晶体 |
| D.ZQ2是极性键构成的非极性分子 |
您最近一年使用:0次
2022-03-17更新
|
170次组卷
|
2卷引用:黑龙江省绥化市第九中学2021-2022学年高二4月月考化学试题



