12-13高二上·四川遂宁·期中
名校
解题方法
1 . 下列说法错误的是
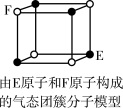
A.从CH4、 、 、 为正四面体结构,可推测PH 为正四面体结构,可推测PH 、 、 也为正四面体结构 也为正四面体结构 |
| B.1mol金刚石晶体中,平均含有2molC-C键 |
| C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键 |
| D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
您最近一年使用:0次
2022-10-31更新
|
243次组卷
|
8卷引用:2012-2013学年四川省遂宁二中高二上学期期中考试化学试卷
名校
解题方法
2 . SiS2的无限长链状结构截取部分如图所示。下列说法不正确的是
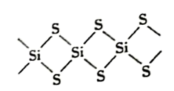

| A.92gSiS2中含有4mol共价键 | B.SiS2为原子晶体 |
| C.SiS2的熔沸点比CS2高 | D.SiS2水解产生H2S |
您最近一年使用:0次
2021-09-17更新
|
662次组卷
|
3卷引用:浙江省宁波市北仑中学2021-2022学年高二上学期期中考试化学(育英班)试题
解题方法
3 . (1)碳可以形成CO、CO2、H2CO3等多种无机化合物。
①国家实验室成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,CO2原子晶体的晶胞如图所示,下列关于CO2的原子晶体说法正确的是_______ (填字母)。

A.CO2原子晶体的熔点比SiO2晶体低
B.1molCO2原子晶体和1molCO2分子晶体均有2mol共价键
C.在一定条件下,CO2原子晶体转化为CO2分子晶体属于化学变化
②在反应CO转化成CO2的过程中,下列说法正确的是_______ (填字母)。
A.每个分子中孤对电子数不变 B.分子极性变化 C.原子间成键方式改变
(2)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键,则氨硼烷分子结构式为_______ ,写出一种与氨硼烷互为等电子体的分子_______ (填化学式)。
(3)硼酸(B(OH)3)本身不能电离出H+,因在水中能生成[B(OH)4]-而体现弱酸性,请写出硼酸溶于水呈酸性的离子方程式_______ 。
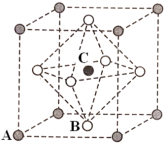
(4)Na3OCl是一种良好的离子半导体,Na3OCl晶体属于立方晶系,晶胞结构如图所示,Na3OCl晶胞中,Cl位于各顶点位置,则Na位于_______ 位置(填“顶点”,“体心”或“面心”)。晶胞有两种基本要素,其中一种是原子坐标参数,表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0),B为(0.5,0.5,0),则C点的原子坐标参数为_______ 。

①国家实验室成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,CO2原子晶体的晶胞如图所示,下列关于CO2的原子晶体说法正确的是

A.CO2原子晶体的熔点比SiO2晶体低
B.1molCO2原子晶体和1molCO2分子晶体均有2mol共价键
C.在一定条件下,CO2原子晶体转化为CO2分子晶体属于化学变化
②在反应CO转化成CO2的过程中,下列说法正确的是
A.每个分子中孤对电子数不变 B.分子极性变化 C.原子间成键方式改变
(2)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键,则氨硼烷分子结构式为
(3)硼酸(B(OH)3)本身不能电离出H+,因在水中能生成[B(OH)4]-而体现弱酸性,请写出硼酸溶于水呈酸性的离子方程式
(4)Na3OCl是一种良好的离子半导体,Na3OCl晶体属于立方晶系,晶胞结构如图所示,Na3OCl晶胞中,Cl位于各顶点位置,则Na位于


您最近一年使用:0次
2021-04-30更新
|
233次组卷
|
2卷引用:福建省龙岩市长汀、连城、上杭、武平、漳平、永定六校(一中)2020-2021学年高二下学期期中联考化学试题
名校
解题方法
4 . 下面是C60、金刚石、二氧化碳和S8分子的模型。


请回答下列问题:
(1)硅与碳同主族,写出硅原子基态时的核外电子排布式:_________ 。
(2)从晶体类型来看,C60属于_________ 晶体。
(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上有________ 个原子;晶体硅中硅原子与共价键的个数比为__________ 。
(4)图丙是二氧化碳的晶胞模型,图中显示出的二氧化碳分子数为14个。实际上一个二氧化碳晶胞中含有________ 个二氧化碳分子,二氧化碳分子中 键与
键与 键的个数比为
键的个数比为 _______ 。
(5)S单质的常见形式为S8,其环状结构如上图所示,S原子采用的轨道杂化方式是______ ;
(6)Se和S同主族,H2Se的热稳定性比H2S_________ (填“强”或“弱”)。气态SeO3分子的立体构型为_________________ 。
(7) H2SO4比 H2SO3酸性强的原因是______


请回答下列问题:
(1)硅与碳同主族,写出硅原子基态时的核外电子排布式:
(2)从晶体类型来看,C60属于
(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上有
(4)图丙是二氧化碳的晶胞模型,图中显示出的二氧化碳分子数为14个。实际上一个二氧化碳晶胞中含有
 键与
键与 键的个数比为
键的个数比为 (5)S单质的常见形式为S8,其环状结构如上图所示,S原子采用的轨道杂化方式是
(6)Se和S同主族,H2Se的热稳定性比H2S
(7) H2SO4比 H2SO3酸性强的原因是
您最近一年使用:0次
名校
解题方法
5 . (1)氯酸钾熔化,粒子间克服了________ 的作用力;二氧化硅熔化,粒子间克服了________ 的作用力;碘的升华,粒子间克服了________ 的作用力。三种晶体的熔点由高到低的顺序是______ (填化学式)。
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为________ (填序号)。
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子是________ ,由非极性键形成的非极性分子是________ ,能形成分子晶体的物质是________ ,含有氢键的晶体的化学式是__________ ,属于离子晶体的是_________ ,属于原子晶体的是_______ ,五种物质的熔点由高到低的顺序是__________ 。
(4)A、B、C、D为四种晶体,性质如下:
A 固态时能导电,能溶于盐酸
B 能溶于CS2,不溶于水
C 固态时不导电,液态时能导电,可溶于水
D 固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:
A.______ ;B.______ ;C.________ ;D._____ 。
(5)相同压强下,部分元素氟化物的熔点见下表:
试解释上表中氟化物熔点差异的原因:__________
(6)镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。150 ℃时,Ni(CO)4分解为Ni和CO。Ni(CO)是________ 晶体,Ni(CO)4易溶于下列________ (填序号)
a 水 b 四氯化碳 c 苯 d 硫酸镍溶液
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子是
(4)A、B、C、D为四种晶体,性质如下:
A 固态时能导电,能溶于盐酸
B 能溶于CS2,不溶于水
C 固态时不导电,液态时能导电,可溶于水
D 固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:
A.
(5)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1266 | 1534 | 183 |
试解释上表中氟化物熔点差异的原因:
(6)镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。150 ℃时,Ni(CO)4分解为Ni和CO。Ni(CO)是
a 水 b 四氯化碳 c 苯 d 硫酸镍溶液
您最近一年使用:0次



