12-13高二上·四川遂宁·期中
名校
解题方法
1 . 下列说法错误的是
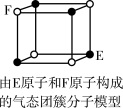
A.从CH4、 、 、 为正四面体结构,可推测PH 为正四面体结构,可推测PH 、 、 也为正四面体结构 也为正四面体结构 |
| B.1mol金刚石晶体中,平均含有2molC-C键 |
| C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键 |
| D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
您最近半年使用:0次
2022-10-31更新
|
243次组卷
|
8卷引用:2012-2013学年四川省遂宁二中高二上学期期中考试化学试卷
解题方法
2 . 过渡金属在生产、生活、科技等方面有着广泛的应用。例如仿生簇化合物Mn4XO4(X=Ca2+/Y3+/Gd3+)有望为实现利用太阳能和水获取清洁能源(氢能)开辟新途径,MnOx·Na2WO4·SiO2、钴(Co)的合金及其化合物材料等广泛应用于化工催化剂等领域。
请回答下列问题:
(1)基态钇(39Y)的价层电子排布式为_______ 。
(2)基态Co原子核外有_______ 种运动状态不同的电子,其3d能级上有_______ 对成对电子。
(3)[Co(NO2)6]3-中三种元素的第一电离能由大到小的顺序是_______ (填元素符号)。已知:[Co(CN)6]4-是强还原剂,与水反应能生成[Co(CN)6]3-。[Co(CN)6]4-中含有σ键与π键的数目之比为_______ ,[Co(CN)6]3-中C的杂化方式为_______ 。
(4)[Mn(NH3)2]2+中配体分子的立体构型是_______ 。[Mn(NH3)2]2+中键角∠HNH_______ (填“大于” 、“小于”或“等于”)NH3中键角∠HNH。
(5)MnF2、MnCl2晶体的熔点分别为856 °C、650 °C,二者熔点存在明显差异的主要原因是_______ 。
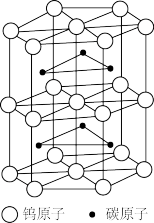
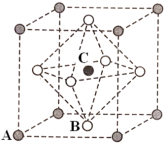
(6)碳化钨是一种由钨(W)和碳组成的晶体,其晶体结构如图所示,晶体的熔点为2870° C,硬度与金刚石相当。碳化钨的晶体类型是_______ ;已知:碳化钨晶体的密度为ρg·cm-3,NA为阿伏加德罗常数的值,六棱柱高为a cm,则底边长为_______ (用含ρ、a、N的表达式表示)nm。
请回答下列问题:
(1)基态钇(39Y)的价层电子排布式为
(2)基态Co原子核外有
(3)[Co(NO2)6]3-中三种元素的第一电离能由大到小的顺序是
(4)[Mn(NH3)2]2+中配体分子的立体构型是
(5)MnF2、MnCl2晶体的熔点分别为856 °C、650 °C,二者熔点存在明显差异的主要原因是
(6)碳化钨是一种由钨(W)和碳组成的晶体,其晶体结构如图所示,晶体的熔点为2870° C,硬度与金刚石相当。碳化钨的晶体类型是

您最近半年使用:0次
2022-05-27更新
|
409次组卷
|
5卷引用:河北省秦皇岛市2022届高三三模化学试题
河北省秦皇岛市2022届高三三模化学试题(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编河南省2022届高三下学期仿真模拟大联考理科综合化学试题(已下线)新疆博乐高级中学2022届高三第一次诊断性测试理科综合化学试卷广东省部分学校2022届高三下学期高考冲刺化学试题
2022·河北·模拟预测
解题方法
3 . 叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定等方面越来越引起人们的重视,其中氢叠氮酸( )是一种弱酸,分子结构示意图可表示为
)是一种弱酸,分子结构示意图可表示为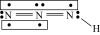 ,联氨被亚硝酸氧化时便可生成氢叠氮酸(
,联氨被亚硝酸氧化时便可生成氢叠氮酸( ):
): ,它的酸性类似于醋酸,微弱电离出
,它的酸性类似于醋酸,微弱电离出 和
和 。试回答下列问题:
。试回答下列问题:
(1)下列有关说法正确的是___________(填序号)。
(2)叠氮化物能与部分金属离子形成配合物,如 ,在该配合物中钴显
,在该配合物中钴显___________ 价,根据价层电子对互斥理论可知 的空间构型为
的空间构型为___________ ,写出钴原子在基态时的核外电子排布式:___________ 。
(3)与 互为等电子体的分子有
互为等电子体的分子有___________ (举2例)。
(4)人造立方氮化硼的硬度仅次于金刚石而远远高于其他材料,因它与金刚石统称为超硬材料。立方氮化硼晶胞如图所示,试分析:

①该晶体的类别为___________ 晶体。
②晶体中每个N原子同时吸引___________ 个B原子。
③设该晶体的摩尔质量为Mg/mol,晶体的密度为 ,阿伏加德罗常数的值为NA,则晶体中两个距离最近的B原子之间的距离为
,阿伏加德罗常数的值为NA,则晶体中两个距离最近的B原子之间的距离为___________ cm。
 )是一种弱酸,分子结构示意图可表示为
)是一种弱酸,分子结构示意图可表示为 ,联氨被亚硝酸氧化时便可生成氢叠氮酸(
,联氨被亚硝酸氧化时便可生成氢叠氮酸( ):
): ,它的酸性类似于醋酸,微弱电离出
,它的酸性类似于醋酸,微弱电离出 和
和 。试回答下列问题:
。试回答下列问题:(1)下列有关说法正确的是___________(填序号)。
A. 中含有5个σ键 中含有5个σ键 |
B. 中三个氮原子采用的都是sp2杂化 中三个氮原子采用的都是sp2杂化 |
C. 、 、 、 、 , , 都是极性分子 都是极性分子 |
D.肼( )沸点高达113.5℃,说明肼分子间可形成氢键 )沸点高达113.5℃,说明肼分子间可形成氢键 |
 ,在该配合物中钴显
,在该配合物中钴显 的空间构型为
的空间构型为(3)与
 互为等电子体的分子有
互为等电子体的分子有(4)人造立方氮化硼的硬度仅次于金刚石而远远高于其他材料,因它与金刚石统称为超硬材料。立方氮化硼晶胞如图所示,试分析:

①该晶体的类别为
②晶体中每个N原子同时吸引
③设该晶体的摩尔质量为Mg/mol,晶体的密度为
 ,阿伏加德罗常数的值为NA,则晶体中两个距离最近的B原子之间的距离为
,阿伏加德罗常数的值为NA,则晶体中两个距离最近的B原子之间的距离为
您最近半年使用:0次
名校
解题方法
4 . 碳族中的碳、硅、锗及其化合物在多领域有重要用途。
(1)基态 的电子排布式为
的电子排布式为___________ 。
(2)我国科学家研发的“液态阳光”计划是通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。 分子中存在
分子中存在___________ 个 键和
键和___________ 个 键,
键, 分子是
分子是___________ 分子(填“极性”或“非极性”)。
(3)关于 、
、 及其化合物的结构与性质,下列论述
及其化合物的结构与性质,下列论述不正确 的是___________。
(4) 与
与 -甲基咪唑(
-甲基咪唑(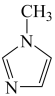 )反应可以得到
)反应可以得到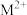 ,其结构如下图所示:
,其结构如下图所示:

 -甲基咪唑中碳原子的杂化轨道类型有
-甲基咪唑中碳原子的杂化轨道类型有___________ 。
(5)汞( )、锗(
)、锗( )、锑(
)、锑( )形成的一种新物质
)形成的一种新物质 为潜在的拓扑绝缘体材料。
为潜在的拓扑绝缘体材料。 的晶体(晶胞为下图
的晶体(晶胞为下图 )可视为
)可视为 晶体(晶胞为下图
晶体(晶胞为下图 )中部分
)中部分 原子被
原子被 和
和 取代后形成。
取代后形成。
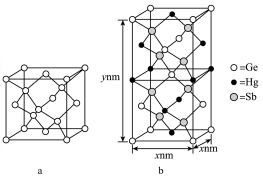
 的最简式的相对分子质量为
的最简式的相对分子质量为 ,阿伏加德罗常数的数值为
,阿伏加德罗常数的数值为 ,则
,则 晶体的密度为
晶体的密度为___________  (列出计算式)。注:
(列出计算式)。注:
(1)基态
 的电子排布式为
的电子排布式为(2)我国科学家研发的“液态阳光”计划是通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。
 分子中存在
分子中存在 键和
键和 键,
键, 分子是
分子是(3)关于
 、
、 及其化合物的结构与性质,下列论述
及其化合物的结构与性质,下列论述A.键能 、 、 ,因此 ,因此 稳定性小于 稳定性小于 |
B. 是与金刚石结构相似的共价晶体,因此 是与金刚石结构相似的共价晶体,因此 具有较高的硬度 具有较高的硬度 |
C. 中 中 的化合价为 的化合价为 , , 中 中 的化合价为 的化合价为 ,因此 ,因此 还原性小于 还原性小于 |
D. 原子间难形成双键和三键而 原子间难形成双键和三键而 原子间可以,是因为 原子间可以,是因为 的原子半径大于 的原子半径大于 ,因此难以形成 ,因此难以形成 键 键 |
 与
与 -甲基咪唑(
-甲基咪唑( )反应可以得到
)反应可以得到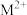 ,其结构如下图所示:
,其结构如下图所示:
 -甲基咪唑中碳原子的杂化轨道类型有
-甲基咪唑中碳原子的杂化轨道类型有(5)汞(
 )、锗(
)、锗( )、锑(
)、锑( )形成的一种新物质
)形成的一种新物质 为潜在的拓扑绝缘体材料。
为潜在的拓扑绝缘体材料。 的晶体(晶胞为下图
的晶体(晶胞为下图 )可视为
)可视为 晶体(晶胞为下图
晶体(晶胞为下图 )中部分
)中部分 原子被
原子被 和
和 取代后形成。
取代后形成。
 的最简式的相对分子质量为
的最简式的相对分子质量为 ,阿伏加德罗常数的数值为
,阿伏加德罗常数的数值为 ,则
,则 晶体的密度为
晶体的密度为 (列出计算式)。注:
(列出计算式)。注:
您最近半年使用:0次
名校
解题方法
5 . SiS2的无限长链状结构截取部分如图所示。下列说法不正确的是
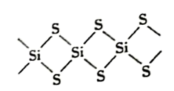

| A.92gSiS2中含有4mol共价键 | B.SiS2为原子晶体 |
| C.SiS2的熔沸点比CS2高 | D.SiS2水解产生H2S |
您最近半年使用:0次
2021-09-17更新
|
660次组卷
|
3卷引用:浙江省名校新高考研究联盟(Z20联盟)2022届高三上学期第一次联考化学试题
解题方法
6 . (1)碳可以形成CO、CO2、H2CO3等多种无机化合物。
①国家实验室成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,CO2原子晶体的晶胞如图所示,下列关于CO2的原子晶体说法正确的是_______ (填字母)。

A.CO2原子晶体的熔点比SiO2晶体低
B.1molCO2原子晶体和1molCO2分子晶体均有2mol共价键
C.在一定条件下,CO2原子晶体转化为CO2分子晶体属于化学变化
②在反应CO转化成CO2的过程中,下列说法正确的是_______ (填字母)。
A.每个分子中孤对电子数不变 B.分子极性变化 C.原子间成键方式改变
(2)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键,则氨硼烷分子结构式为_______ ,写出一种与氨硼烷互为等电子体的分子_______ (填化学式)。
(3)硼酸(B(OH)3)本身不能电离出H+,因在水中能生成[B(OH)4]-而体现弱酸性,请写出硼酸溶于水呈酸性的离子方程式_______ 。
(4)Na3OCl是一种良好的离子半导体,Na3OCl晶体属于立方晶系,晶胞结构如图所示,Na3OCl晶胞中,Cl位于各顶点位置,则Na位于_______ 位置(填“顶点”,“体心”或“面心”)。晶胞有两种基本要素,其中一种是原子坐标参数,表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0),B为(0.5,0.5,0),则C点的原子坐标参数为_______ 。

①国家实验室成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,CO2原子晶体的晶胞如图所示,下列关于CO2的原子晶体说法正确的是

A.CO2原子晶体的熔点比SiO2晶体低
B.1molCO2原子晶体和1molCO2分子晶体均有2mol共价键
C.在一定条件下,CO2原子晶体转化为CO2分子晶体属于化学变化
②在反应CO转化成CO2的过程中,下列说法正确的是
A.每个分子中孤对电子数不变 B.分子极性变化 C.原子间成键方式改变
(2)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键,则氨硼烷分子结构式为
(3)硼酸(B(OH)3)本身不能电离出H+,因在水中能生成[B(OH)4]-而体现弱酸性,请写出硼酸溶于水呈酸性的离子方程式
(4)Na3OCl是一种良好的离子半导体,Na3OCl晶体属于立方晶系,晶胞结构如图所示,Na3OCl晶胞中,Cl位于各顶点位置,则Na位于


您最近半年使用:0次
2021-04-30更新
|
233次组卷
|
2卷引用:福建省龙岩市长汀、连城、上杭、武平、漳平、永定六校(一中)2020-2021学年高二下学期期中联考化学试题
7 . 据古籍《燕闲清赏笺》记载:“宣窑之青,乃苏勃泥青”,说明宣德时期青花瓷使用的颜料是“苏勃泥青”,它是从一种钻毒砂[主要成分:( ,
, )
) ]中提取出来的。回答下列问题:
]中提取出来的。回答下列问题:
(1)基态S原子的价层电子排布图为_______ ,其原子核外电子共有_______ 种空间运动状态。
(2)比较元素第一电离能:S_______ P(填“>”、“<”或=)。
(3) 位于周期表的第
位于周期表的第_______ 周期 _______ 族,_______ (填“d”或“ds”)区。
(4)区分晶体与非晶体最可靠的科学方法是_______ 。
(5)砷化镓晶胞结构如图所示。晶胞中 与周围最近且等距的
与周围最近且等距的 形成的空间结构为
形成的空间结构为_______ 。已知 晶胞棱长为apm,其密度
晶胞棱长为apm,其密度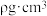 ,则阿伏加德罗常数的数值为
,则阿伏加德罗常数的数值为_______ (列出计算式即可, 的摩尔质量为
的摩尔质量为 )。
)。

(6) 的熔点为
的熔点为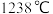 ,
, 与
与 晶体类型相同,
晶体类型相同, 的熔点
的熔点_______ (填“>”、“<”或“=”)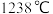 。
。
 ,
, )
) ]中提取出来的。回答下列问题:
]中提取出来的。回答下列问题:(1)基态S原子的价层电子排布图为
(2)比较元素第一电离能:S
(3)
 位于周期表的第
位于周期表的第(4)区分晶体与非晶体最可靠的科学方法是
(5)砷化镓晶胞结构如图所示。晶胞中
 与周围最近且等距的
与周围最近且等距的 形成的空间结构为
形成的空间结构为 晶胞棱长为apm,其密度
晶胞棱长为apm,其密度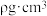 ,则阿伏加德罗常数的数值为
,则阿伏加德罗常数的数值为 的摩尔质量为
的摩尔质量为 )。
)。
(6)
 的熔点为
的熔点为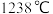 ,
, 与
与 晶体类型相同,
晶体类型相同, 的熔点
的熔点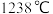 。
。
您最近半年使用:0次
名校
解题方法
8 . 生命起源假说认为,在地球生命形成初期(约36亿年前),由NH3、CO、H2O、H2、H2S等小分子在放电条件下形成了多种氨基酸,继而合成了蛋白质而形成单细胞。
(1)写出基态S原子的价电子排布式____ ,其基态原子具有____ 种不同能量的电子。
(2)H2S的沸点低于H2O的沸点,其原因是____ 。
(3)NH3的VSEPR模型名称为____ ,H2O分子中孤对电子占据2个____ 杂化轨道。
(4)太阳能电池种类繁多,如铜铟镓硒镍薄膜太阳能电池等。1molNi(CO)4中π键与σ键的个数比为____ 。高温下CuO容易转化为Cu2O,试从原子结构角度解释原因:____ 。
(5)①金刚石的晶胞如图,其中C原子的配位数是____ ;晶体硅、金刚砂(SiC)的结构与之相似,则金刚石、晶体硅、金刚砂的熔点由高到低的排列顺序是____ (用化学式表示);

②金刚石的晶胞参数为a pm。 1cm3晶体的平均质量为___ g(只要求列出算式,阿伏加德罗常数值为NA)
(1)写出基态S原子的价电子排布式
(2)H2S的沸点低于H2O的沸点,其原因是
(3)NH3的VSEPR模型名称为
(4)太阳能电池种类繁多,如铜铟镓硒镍薄膜太阳能电池等。1molNi(CO)4中π键与σ键的个数比为
(5)①金刚石的晶胞如图,其中C原子的配位数是

②金刚石的晶胞参数为a pm。 1cm3晶体的平均质量为
您最近半年使用:0次
2020-11-20更新
|
543次组卷
|
2卷引用:四川省遂宁市2021届高三零诊考试理综化学试题
名校
解题方法
9 . 下面是C60、金刚石、二氧化碳和S8分子的模型。


请回答下列问题:
(1)硅与碳同主族,写出硅原子基态时的核外电子排布式:_________ 。
(2)从晶体类型来看,C60属于_________ 晶体。
(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上有________ 个原子;晶体硅中硅原子与共价键的个数比为__________ 。
(4)图丙是二氧化碳的晶胞模型,图中显示出的二氧化碳分子数为14个。实际上一个二氧化碳晶胞中含有________ 个二氧化碳分子,二氧化碳分子中 键与
键与 键的个数比为
键的个数比为 _______ 。
(5)S单质的常见形式为S8,其环状结构如上图所示,S原子采用的轨道杂化方式是______ ;
(6)Se和S同主族,H2Se的热稳定性比H2S_________ (填“强”或“弱”)。气态SeO3分子的立体构型为_________________ 。
(7) H2SO4比 H2SO3酸性强的原因是______


请回答下列问题:
(1)硅与碳同主族,写出硅原子基态时的核外电子排布式:
(2)从晶体类型来看,C60属于
(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上有
(4)图丙是二氧化碳的晶胞模型,图中显示出的二氧化碳分子数为14个。实际上一个二氧化碳晶胞中含有
 键与
键与 键的个数比为
键的个数比为 (5)S单质的常见形式为S8,其环状结构如上图所示,S原子采用的轨道杂化方式是
(6)Se和S同主族,H2Se的热稳定性比H2S
(7) H2SO4比 H2SO3酸性强的原因是
您最近半年使用:0次
名校
解题方法
10 . 如图所示,NaCl是一种重要的化工原料,可以制备一系列物质。以下是钠法(液氨法)制备NaN3的工艺流程:

(1)工业可通过电解熔融NaCl制得金属钠,请写出电解时阳极的电极反应式:____ 。
(2)用电子式表示NH3分子的形成过程____ 。
(3)工业上在210-220℃合成NaN3,请写出该合成反应的化学方程式____ 。
(4)NaN3是一种易溶于水、有爆炸性的白色固体,销毁NaN3可用NaClO溶液,该销毁反应的离子方程式为____ ( 被氧化为N2)。
被氧化为N2)。
(5)生成过程中产生的Cl2、H2用途广泛,其中可用于生产高纯硅。
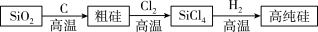
①硅元素位于周期表第____ 周期____ 族。
②SiO2熔点1723℃,质地硬而脆;SiCl4常温下为液体,易挥发。请根据性质推断SiO2属于____ 晶体,SiCl4晶体微粒间的作用力为____ 。

(1)工业可通过电解熔融NaCl制得金属钠,请写出电解时阳极的电极反应式:
(2)用电子式表示NH3分子的形成过程
(3)工业上在210-220℃合成NaN3,请写出该合成反应的化学方程式
(4)NaN3是一种易溶于水、有爆炸性的白色固体,销毁NaN3可用NaClO溶液,该销毁反应的离子方程式为
 被氧化为N2)。
被氧化为N2)。(5)生成过程中产生的Cl2、H2用途广泛,其中可用于生产高纯硅。

①硅元素位于周期表第
②SiO2熔点1723℃,质地硬而脆;SiCl4常温下为液体,易挥发。请根据性质推断SiO2属于
您最近半年使用:0次



