解题方法
1 . 过渡金属在生产、生活、科技等方面有着广泛的应用。例如仿生簇化合物Mn4XO4(X=Ca2+/Y3+/Gd3+)有望为实现利用太阳能和水获取清洁能源(氢能)开辟新途径,MnOx·Na2WO4·SiO2、钴(Co)的合金及其化合物材料等广泛应用于化工催化剂等领域。
请回答下列问题:
(1)基态钇(39Y)的价层电子排布式为_______ 。
(2)基态Co原子核外有_______ 种运动状态不同的电子,其3d能级上有_______ 对成对电子。
(3)[Co(NO2)6]3-中三种元素的第一电离能由大到小的顺序是_______ (填元素符号)。已知:[Co(CN)6]4-是强还原剂,与水反应能生成[Co(CN)6]3-。[Co(CN)6]4-中含有σ键与π键的数目之比为_______ ,[Co(CN)6]3-中C的杂化方式为_______ 。
(4)[Mn(NH3)2]2+中配体分子的立体构型是_______ 。[Mn(NH3)2]2+中键角∠HNH_______ (填“大于” 、“小于”或“等于”)NH3中键角∠HNH。
(5)MnF2、MnCl2晶体的熔点分别为856 °C、650 °C,二者熔点存在明显差异的主要原因是_______ 。
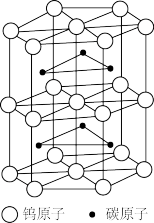
(6)碳化钨是一种由钨(W)和碳组成的晶体,其晶体结构如图所示,晶体的熔点为2870° C,硬度与金刚石相当。碳化钨的晶体类型是_______ ;已知:碳化钨晶体的密度为ρg·cm-3,NA为阿伏加德罗常数的值,六棱柱高为a cm,则底边长为_______ (用含ρ、a、N的表达式表示)nm。
请回答下列问题:
(1)基态钇(39Y)的价层电子排布式为
(2)基态Co原子核外有
(3)[Co(NO2)6]3-中三种元素的第一电离能由大到小的顺序是
(4)[Mn(NH3)2]2+中配体分子的立体构型是
(5)MnF2、MnCl2晶体的熔点分别为856 °C、650 °C,二者熔点存在明显差异的主要原因是
(6)碳化钨是一种由钨(W)和碳组成的晶体,其晶体结构如图所示,晶体的熔点为2870° C,硬度与金刚石相当。碳化钨的晶体类型是

您最近一年使用:0次
2022-05-27更新
|
409次组卷
|
5卷引用:河北省秦皇岛市2022届高三三模化学试题
河北省秦皇岛市2022届高三三模化学试题(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编河南省2022届高三下学期仿真模拟大联考理科综合化学试题(已下线)新疆博乐高级中学2022届高三第一次诊断性测试理科综合化学试卷广东省部分学校2022届高三下学期高考冲刺化学试题
2022·河北·模拟预测
解题方法
2 . 叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定等方面越来越引起人们的重视,其中氢叠氮酸( )是一种弱酸,分子结构示意图可表示为
)是一种弱酸,分子结构示意图可表示为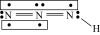 ,联氨被亚硝酸氧化时便可生成氢叠氮酸(
,联氨被亚硝酸氧化时便可生成氢叠氮酸( ):
): ,它的酸性类似于醋酸,微弱电离出
,它的酸性类似于醋酸,微弱电离出 和
和 。试回答下列问题:
。试回答下列问题:
(1)下列有关说法正确的是___________(填序号)。
(2)叠氮化物能与部分金属离子形成配合物,如 ,在该配合物中钴显
,在该配合物中钴显___________ 价,根据价层电子对互斥理论可知 的空间构型为
的空间构型为___________ ,写出钴原子在基态时的核外电子排布式:___________ 。
(3)与 互为等电子体的分子有
互为等电子体的分子有___________ (举2例)。
(4)人造立方氮化硼的硬度仅次于金刚石而远远高于其他材料,因它与金刚石统称为超硬材料。立方氮化硼晶胞如图所示,试分析:

①该晶体的类别为___________ 晶体。
②晶体中每个N原子同时吸引___________ 个B原子。
③设该晶体的摩尔质量为Mg/mol,晶体的密度为 ,阿伏加德罗常数的值为NA,则晶体中两个距离最近的B原子之间的距离为
,阿伏加德罗常数的值为NA,则晶体中两个距离最近的B原子之间的距离为___________ cm。
 )是一种弱酸,分子结构示意图可表示为
)是一种弱酸,分子结构示意图可表示为 ,联氨被亚硝酸氧化时便可生成氢叠氮酸(
,联氨被亚硝酸氧化时便可生成氢叠氮酸( ):
): ,它的酸性类似于醋酸,微弱电离出
,它的酸性类似于醋酸,微弱电离出 和
和 。试回答下列问题:
。试回答下列问题:(1)下列有关说法正确的是___________(填序号)。
A. 中含有5个σ键 中含有5个σ键 |
B. 中三个氮原子采用的都是sp2杂化 中三个氮原子采用的都是sp2杂化 |
C. 、 、 、 、 , , 都是极性分子 都是极性分子 |
D.肼( )沸点高达113.5℃,说明肼分子间可形成氢键 )沸点高达113.5℃,说明肼分子间可形成氢键 |
 ,在该配合物中钴显
,在该配合物中钴显 的空间构型为
的空间构型为(3)与
 互为等电子体的分子有
互为等电子体的分子有(4)人造立方氮化硼的硬度仅次于金刚石而远远高于其他材料,因它与金刚石统称为超硬材料。立方氮化硼晶胞如图所示,试分析:

①该晶体的类别为
②晶体中每个N原子同时吸引
③设该晶体的摩尔质量为Mg/mol,晶体的密度为
 ,阿伏加德罗常数的值为NA,则晶体中两个距离最近的B原子之间的距离为
,阿伏加德罗常数的值为NA,则晶体中两个距离最近的B原子之间的距离为
您最近一年使用:0次
名校
解题方法
3 . 碳族中的碳、硅、锗及其化合物在多领域有重要用途。
(1)基态 的电子排布式为
的电子排布式为___________ 。
(2)我国科学家研发的“液态阳光”计划是通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。 分子中存在
分子中存在___________ 个 键和
键和___________ 个 键,
键, 分子是
分子是___________ 分子(填“极性”或“非极性”)。
(3)关于 、
、 及其化合物的结构与性质,下列论述
及其化合物的结构与性质,下列论述不正确 的是___________。
(4) 与
与 -甲基咪唑(
-甲基咪唑(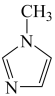 )反应可以得到
)反应可以得到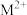 ,其结构如下图所示:
,其结构如下图所示:

 -甲基咪唑中碳原子的杂化轨道类型有
-甲基咪唑中碳原子的杂化轨道类型有___________ 。
(5)汞( )、锗(
)、锗( )、锑(
)、锑( )形成的一种新物质
)形成的一种新物质 为潜在的拓扑绝缘体材料。
为潜在的拓扑绝缘体材料。 的晶体(晶胞为下图
的晶体(晶胞为下图 )可视为
)可视为 晶体(晶胞为下图
晶体(晶胞为下图 )中部分
)中部分 原子被
原子被 和
和 取代后形成。
取代后形成。
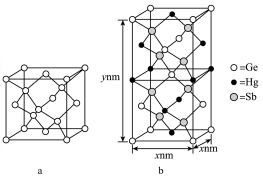
 的最简式的相对分子质量为
的最简式的相对分子质量为 ,阿伏加德罗常数的数值为
,阿伏加德罗常数的数值为 ,则
,则 晶体的密度为
晶体的密度为___________  (列出计算式)。注:
(列出计算式)。注:
(1)基态
 的电子排布式为
的电子排布式为(2)我国科学家研发的“液态阳光”计划是通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。
 分子中存在
分子中存在 键和
键和 键,
键, 分子是
分子是(3)关于
 、
、 及其化合物的结构与性质,下列论述
及其化合物的结构与性质,下列论述A.键能 、 、 ,因此 ,因此 稳定性小于 稳定性小于 |
B. 是与金刚石结构相似的共价晶体,因此 是与金刚石结构相似的共价晶体,因此 具有较高的硬度 具有较高的硬度 |
C. 中 中 的化合价为 的化合价为 , , 中 中 的化合价为 的化合价为 ,因此 ,因此 还原性小于 还原性小于 |
D. 原子间难形成双键和三键而 原子间难形成双键和三键而 原子间可以,是因为 原子间可以,是因为 的原子半径大于 的原子半径大于 ,因此难以形成 ,因此难以形成 键 键 |
 与
与 -甲基咪唑(
-甲基咪唑( )反应可以得到
)反应可以得到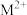 ,其结构如下图所示:
,其结构如下图所示:
 -甲基咪唑中碳原子的杂化轨道类型有
-甲基咪唑中碳原子的杂化轨道类型有(5)汞(
 )、锗(
)、锗( )、锑(
)、锑( )形成的一种新物质
)形成的一种新物质 为潜在的拓扑绝缘体材料。
为潜在的拓扑绝缘体材料。 的晶体(晶胞为下图
的晶体(晶胞为下图 )可视为
)可视为 晶体(晶胞为下图
晶体(晶胞为下图 )中部分
)中部分 原子被
原子被 和
和 取代后形成。
取代后形成。
 的最简式的相对分子质量为
的最简式的相对分子质量为 ,阿伏加德罗常数的数值为
,阿伏加德罗常数的数值为 ,则
,则 晶体的密度为
晶体的密度为 (列出计算式)。注:
(列出计算式)。注:
您最近一年使用:0次
名校
解题方法
4 . SiS2的无限长链状结构截取部分如图所示。下列说法不正确的是
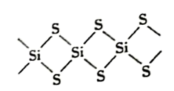

| A.92gSiS2中含有4mol共价键 | B.SiS2为原子晶体 |
| C.SiS2的熔沸点比CS2高 | D.SiS2水解产生H2S |
您最近一年使用:0次
2021-09-17更新
|
662次组卷
|
3卷引用:浙江省名校新高考研究联盟(Z20联盟)2022届高三上学期第一次联考化学试题
5 . 据古籍《燕闲清赏笺》记载:“宣窑之青,乃苏勃泥青”,说明宣德时期青花瓷使用的颜料是“苏勃泥青”,它是从一种钻毒砂[主要成分:( ,
, )
) ]中提取出来的。回答下列问题:
]中提取出来的。回答下列问题:
(1)基态S原子的价层电子排布图为_______ ,其原子核外电子共有_______ 种空间运动状态。
(2)比较元素第一电离能:S_______ P(填“>”、“<”或=)。
(3) 位于周期表的第
位于周期表的第_______ 周期 _______ 族,_______ (填“d”或“ds”)区。
(4)区分晶体与非晶体最可靠的科学方法是_______ 。
(5)砷化镓晶胞结构如图所示。晶胞中 与周围最近且等距的
与周围最近且等距的 形成的空间结构为
形成的空间结构为_______ 。已知 晶胞棱长为apm,其密度
晶胞棱长为apm,其密度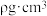 ,则阿伏加德罗常数的数值为
,则阿伏加德罗常数的数值为_______ (列出计算式即可, 的摩尔质量为
的摩尔质量为 )。
)。

(6) 的熔点为
的熔点为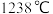 ,
, 与
与 晶体类型相同,
晶体类型相同, 的熔点
的熔点_______ (填“>”、“<”或“=”)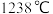 。
。
 ,
, )
) ]中提取出来的。回答下列问题:
]中提取出来的。回答下列问题:(1)基态S原子的价层电子排布图为
(2)比较元素第一电离能:S
(3)
 位于周期表的第
位于周期表的第(4)区分晶体与非晶体最可靠的科学方法是
(5)砷化镓晶胞结构如图所示。晶胞中
 与周围最近且等距的
与周围最近且等距的 形成的空间结构为
形成的空间结构为 晶胞棱长为apm,其密度
晶胞棱长为apm,其密度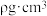 ,则阿伏加德罗常数的数值为
,则阿伏加德罗常数的数值为 的摩尔质量为
的摩尔质量为 )。
)。
(6)
 的熔点为
的熔点为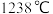 ,
, 与
与 晶体类型相同,
晶体类型相同, 的熔点
的熔点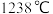 。
。
您最近一年使用:0次
名校
解题方法
6 . 生命起源假说认为,在地球生命形成初期(约36亿年前),由NH3、CO、H2O、H2、H2S等小分子在放电条件下形成了多种氨基酸,继而合成了蛋白质而形成单细胞。
(1)写出基态S原子的价电子排布式____ ,其基态原子具有____ 种不同能量的电子。
(2)H2S的沸点低于H2O的沸点,其原因是____ 。
(3)NH3的VSEPR模型名称为____ ,H2O分子中孤对电子占据2个____ 杂化轨道。
(4)太阳能电池种类繁多,如铜铟镓硒镍薄膜太阳能电池等。1molNi(CO)4中π键与σ键的个数比为____ 。高温下CuO容易转化为Cu2O,试从原子结构角度解释原因:____ 。
(5)①金刚石的晶胞如图,其中C原子的配位数是____ ;晶体硅、金刚砂(SiC)的结构与之相似,则金刚石、晶体硅、金刚砂的熔点由高到低的排列顺序是____ (用化学式表示);

②金刚石的晶胞参数为a pm。 1cm3晶体的平均质量为___ g(只要求列出算式,阿伏加德罗常数值为NA)
(1)写出基态S原子的价电子排布式
(2)H2S的沸点低于H2O的沸点,其原因是
(3)NH3的VSEPR模型名称为
(4)太阳能电池种类繁多,如铜铟镓硒镍薄膜太阳能电池等。1molNi(CO)4中π键与σ键的个数比为
(5)①金刚石的晶胞如图,其中C原子的配位数是

②金刚石的晶胞参数为a pm。 1cm3晶体的平均质量为
您最近一年使用:0次
2020-11-20更新
|
543次组卷
|
2卷引用:四川省遂宁市2021届高三零诊考试理综化学试题
名校
解题方法
7 . (1)氯酸钾熔化,粒子间克服了________ 的作用力;二氧化硅熔化,粒子间克服了________ 的作用力;碘的升华,粒子间克服了________ 的作用力。三种晶体的熔点由高到低的顺序是______ (填化学式)。
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为________ (填序号)。
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子是________ ,由非极性键形成的非极性分子是________ ,能形成分子晶体的物质是________ ,含有氢键的晶体的化学式是__________ ,属于离子晶体的是_________ ,属于原子晶体的是_______ ,五种物质的熔点由高到低的顺序是__________ 。
(4)A、B、C、D为四种晶体,性质如下:
A 固态时能导电,能溶于盐酸
B 能溶于CS2,不溶于水
C 固态时不导电,液态时能导电,可溶于水
D 固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:
A.______ ;B.______ ;C.________ ;D._____ 。
(5)相同压强下,部分元素氟化物的熔点见下表:
试解释上表中氟化物熔点差异的原因:__________
(6)镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。150 ℃时,Ni(CO)4分解为Ni和CO。Ni(CO)是________ 晶体,Ni(CO)4易溶于下列________ (填序号)
a 水 b 四氯化碳 c 苯 d 硫酸镍溶液
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子是
(4)A、B、C、D为四种晶体,性质如下:
A 固态时能导电,能溶于盐酸
B 能溶于CS2,不溶于水
C 固态时不导电,液态时能导电,可溶于水
D 固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:
A.
(5)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1266 | 1534 | 183 |
试解释上表中氟化物熔点差异的原因:
(6)镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。150 ℃时,Ni(CO)4分解为Ni和CO。Ni(CO)是
a 水 b 四氯化碳 c 苯 d 硫酸镍溶液
您最近一年使用:0次



