1 . 甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。利用甲醇一定条件下直接脱氢可制甲醛,涉及的反应如下:
反应I:

反应II:

已知:①平衡状态下,甲醛选择性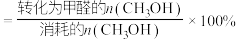 ;甲醛的收率
;甲醛的收率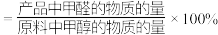 。
。
②几种物质的燃烧热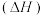 如下表:
如下表:
回答下列问题:
(1)
_______ ,HCHO的空间结构为_______ 形。
(2)反应I、反应II的反应历程可表示为:
历程i:……
历程ii: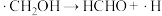
历程iii:
历程iv: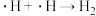
写出历程i的反应方程式:_______ 。
(3)将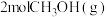 加入容积为2L的刚性密闭容器中,温度对平衡状态下
加入容积为2L的刚性密闭容器中,温度对平衡状态下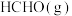 的选择性和收率的影响如图所示:
的选择性和收率的影响如图所示:_______ (填“I”或“II”),判断的依据是_______ 。
② ℃,反应进行到10min时达到平衡,此时
℃,反应进行到10min时达到平衡,此时 的转化率为
的转化率为_______ ,
_______ ,反应I的平衡常数
_______  。
。
反应I:


反应II:


已知:①平衡状态下,甲醛选择性
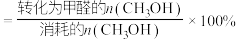 ;甲醛的收率
;甲醛的收率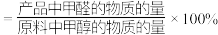 。
。②几种物质的燃烧热
 如下表:
如下表:| 物质 |  |  |  |  |
燃烧热 | -725.8 | -563.6 | -283.0 | -285.8 |
(1)

(2)反应I、反应II的反应历程可表示为:
历程i:……
历程ii:
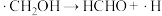
历程iii:

历程iv:
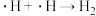
写出历程i的反应方程式:
(3)将
 加入容积为2L的刚性密闭容器中,温度对平衡状态下
加入容积为2L的刚性密闭容器中,温度对平衡状态下 的选择性和收率的影响如图所示:
的选择性和收率的影响如图所示: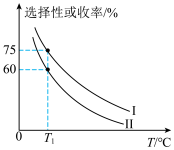
②
 ℃,反应进行到10min时达到平衡,此时
℃,反应进行到10min时达到平衡,此时 的转化率为
的转化率为

 。
。
您最近一年使用:0次
2024-06-01更新
|
273次组卷
|
3卷引用:2024届河南省周口市高三5月全真模拟理科综合试题-高中化学
解题方法
2 . 研究表明,光催化剂Ti-CNO对 与氧化苯乙烯环加成生成碳酸苯乙烯酯表现出优异的光热催化活性和稳定性,其反应机理如图所示(部分微粒未标出):
与氧化苯乙烯环加成生成碳酸苯乙烯酯表现出优异的光热催化活性和稳定性,其反应机理如图所示(部分微粒未标出):
 与氧化苯乙烯环加成生成碳酸苯乙烯酯表现出优异的光热催化活性和稳定性,其反应机理如图所示(部分微粒未标出):
与氧化苯乙烯环加成生成碳酸苯乙烯酯表现出优异的光热催化活性和稳定性,其反应机理如图所示(部分微粒未标出):
已知:TBAB的结构简式为 ;—Ph代表苯基。
;—Ph代表苯基。
A.若基态钛原子的价电子轨道表示式为 ,则违背了泡利原理和洪特规则 ,则违背了泡利原理和洪特规则 |
B.TBAB中氮原子的杂化类型为 ,氮元素显+5价 ,氮元素显+5价 |
C. 转化为 转化为 的过程中,碳氢极性键断裂 的过程中,碳氢极性键断裂 |
D.在“碱性点位”上 得电子发生还原反应 得电子发生还原反应 |
您最近一年使用:0次
2024-05-30更新
|
48次组卷
|
2卷引用:2024届河南省名校联盟高三考前模拟大联考(三模)理综试题-高中化学
解题方法
3 . 氨硼烷( )因具有较高的含氢量成为受人关注的潜在储氢材料之一。铱鳌合复合物催化氨硼烷脱氢反应的一种反应机理和相对能量的变化情况如图所示[已知
)因具有较高的含氢量成为受人关注的潜在储氢材料之一。铱鳌合复合物催化氨硼烷脱氢反应的一种反应机理和相对能量的变化情况如图所示[已知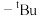 表示
表示 。下列说法错误的是
。下列说法错误的是
 )因具有较高的含氢量成为受人关注的潜在储氢材料之一。铱鳌合复合物催化氨硼烷脱氢反应的一种反应机理和相对能量的变化情况如图所示[已知
)因具有较高的含氢量成为受人关注的潜在储氢材料之一。铱鳌合复合物催化氨硼烷脱氢反应的一种反应机理和相对能量的变化情况如图所示[已知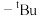 表示
表示 。下列说法错误的是
。下列说法错误的是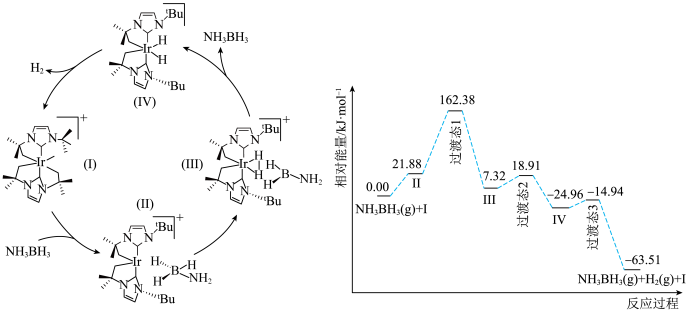
| A.氨硼烷中氢元素的化合价不相同 |
| B.化合物I能降低该反应的活化能 |
C.反应过程中 的成键数目发生改变 的成键数目发生改变 |
D.该反应决速步的活化能为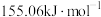 |
您最近一年使用:0次
名校
解题方法
4 . 在催化剂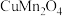 表面的
表面的 选择性催化还原NO的反应机理如下图所示(如)
选择性催化还原NO的反应机理如下图所示(如) 吸附在催化剂表面可表示为
吸附在催化剂表面可表示为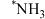 ,Ea表示活化能)。
,Ea表示活化能)。
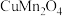 表面的
表面的 选择性催化还原NO的反应机理如下图所示(如)
选择性催化还原NO的反应机理如下图所示(如) 吸附在催化剂表面可表示为
吸附在催化剂表面可表示为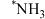 ,Ea表示活化能)。
,Ea表示活化能)。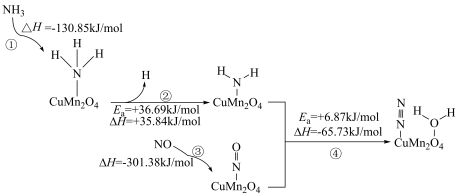
| A.该反应温度越高,反应速率越快 |
B. 比NO更易被催化剂 比NO更易被催化剂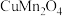 吸附 吸附 |
| C.反应过程中有非极性键的断裂与极性键的形成 |
D.决定总反应速率的基元反应可表示为: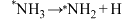 |
您最近一年使用:0次
2024-03-09更新
|
330次组卷
|
5卷引用:2024届河南省信阳高级中学高三下学期模拟考试(十六)理科综合试题-高中化学
解题方法
5 . 工业合成氨是人类科学技术的重大突破,其反应为
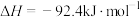 。合成氨原料中的
。合成氨原料中的 一般由分馏液态空气得到,
一般由分馏液态空气得到, 可来源于水煤气,相关反应如下:
可来源于水煤气,相关反应如下:
a.
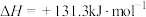
b.
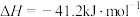
回答下列问题:
(1)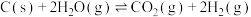 的反应物总能量
的反应物总能量_______ 生成物总能量(填“高于”或“低于”)。
(2)在密闭容器中同时发生反应 ,下列说法正确的是_______。
,下列说法正确的是_______。
(3)实验室模拟合成水煤气,一定温度下在 的密闭容器中加入
的密闭容器中加入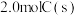 与
与 发生反应
发生反应 ,在
,在 达到平衡时,
达到平衡时, 的转化率是
的转化率是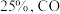 的物质的量是
的物质的量是 ,反应开始到平衡时生成
,反应开始到平衡时生成 的平均反应速率为
的平均反应速率为_______ ,计算反应 的平衡常数
的平衡常数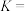
_____ (写出计算过程)。
(4)合成氨总反应在起始反应物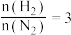 时,在不同条件下达到平衡,设体系中
时,在不同条件下达到平衡,设体系中 的体积分数为
的体积分数为 ,在
,在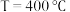 下的
下的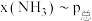 、
、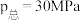 下的
下的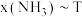 如图所示,图中对应等压过程的曲线是
如图所示,图中对应等压过程的曲线是______ (填“Ⅰ”或“Ⅱ”),当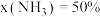 时氨气的分压
时氨气的分压
______  (分压=气体的物质的量分数×总压)。
(分压=气体的物质的量分数×总压)。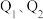 均大于0):
均大于0):________ 。
②合成尿素过程中会积聚一定浓度的氨基甲酸铵( ),为减少氨基甲酸铵的积聚,提高尿素的产率,可控制
),为减少氨基甲酸铵的积聚,提高尿素的产率,可控制 与
与 的通入比例
的通入比例_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。

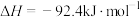 。合成氨原料中的
。合成氨原料中的 一般由分馏液态空气得到,
一般由分馏液态空气得到, 可来源于水煤气,相关反应如下:
可来源于水煤气,相关反应如下:a.

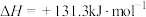
b.

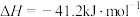
回答下列问题:
(1)
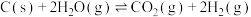 的反应物总能量
的反应物总能量(2)在密闭容器中同时发生反应
 ,下列说法正确的是_______。
,下列说法正确的是_______。A.增大压强,反应 平衡不移动 平衡不移动 | B.使用催化剂提高 平衡转化率 平衡转化率 |
C.升高温度,反应a的 增大, 增大, 减小 减小 | D.反应a有非极性键的断裂与形成 |
(3)实验室模拟合成水煤气,一定温度下在
 的密闭容器中加入
的密闭容器中加入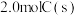 与
与 发生反应
发生反应 ,在
,在 达到平衡时,
达到平衡时, 的转化率是
的转化率是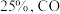 的物质的量是
的物质的量是 ,反应开始到平衡时生成
,反应开始到平衡时生成 的平均反应速率为
的平均反应速率为 的平衡常数
的平衡常数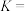
(4)合成氨总反应在起始反应物
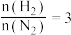 时,在不同条件下达到平衡,设体系中
时,在不同条件下达到平衡,设体系中 的体积分数为
的体积分数为 ,在
,在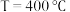 下的
下的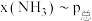 、
、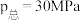 下的
下的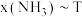 如图所示,图中对应等压过程的曲线是
如图所示,图中对应等压过程的曲线是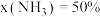 时氨气的分压
时氨气的分压
 (分压=气体的物质的量分数×总压)。
(分压=气体的物质的量分数×总压)。
 均大于0):
均大于0):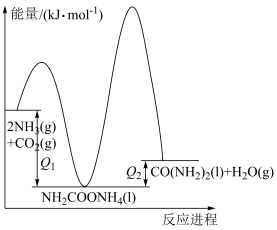
②合成尿素过程中会积聚一定浓度的氨基甲酸铵(
 ),为减少氨基甲酸铵的积聚,提高尿素的产率,可控制
),为减少氨基甲酸铵的积聚,提高尿素的产率,可控制 与
与 的通入比例
的通入比例 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
您最近一年使用:0次
2024-02-03更新
|
238次组卷
|
3卷引用:2024届河南省许昌市部分学校高三下学期高考冲刺(一)理科综合试题-高中化学
6 . 甲醇和乙醇都是清洁能源,也是重要的化工原料。回答下列问题:
(1)工业上利用合成气合成甲醇:

已知:几种热化学方程式如下、其中,a、b、c都大于0。
①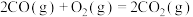
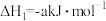 ;
;
②
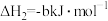 ;
;
③

则上述反应中的
_______  。
。
(2)一定温度下,在恒容密闭容器中充入1molCO和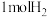 ,在固体催化剂作用下合成甲醇:
,在固体催化剂作用下合成甲醇: ,下列叙述正确的是_______(填字母)。
,下列叙述正确的是_______(填字母)。
(3)甲醇是一种潜在储氢材料。我国学者研究甲醇在钯基催化剂表而上分解制氢: ,其反应历程如图所示(吸附在催化剂表面的物种用“*”表示)。
,其反应历程如图所示(吸附在催化剂表面的物种用“*”表示)。

总反应的焓变为_______ ;催化剂主要是降低反应_______ (填序号)的活化能;总反应经历5步反应中,最大能垒为_______  ,写出该步反应式:
,写出该步反应式:_______ 。
(4)工业上,可以采用 催化还原制备
催化还原制备 、
、 。发生反应如下:
。发生反应如下:
① (主反应);
(主反应);
② (主反应);
(主反应);
③ (副反应)。
(副反应)。
一定温度下,在甲、乙体积相同的反应容器中分别充入 和
和 ,发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得
,发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得 平衡转化率与压强关系如图所示。其他条件相同,增大压强,
平衡转化率与压强关系如图所示。其他条件相同,增大压强, 平衡转化率增大,其原因是
平衡转化率增大,其原因是_______ ;采用水分子膜分离技术的容器是_______ (填“甲”或“乙”)。

(5)一定温度下,向总压强恒定为100kPa的反应器中充入 和
和 ,发生(4)中反应①②③,达到平衡时
,发生(4)中反应①②③,达到平衡时 转化率为50%,甲醇选择性为
转化率为50%,甲醇选择性为 ,生成
,生成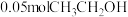 ,则反应①的平衡常数
,则反应①的平衡常数 为
为_______  (写出数字表达式即可)[用分压计算的平衡常数为压强平衡常数
(写出数字表达式即可)[用分压计算的平衡常数为压强平衡常数 ,分压=总压×物质的量分数;甲醇选择性:
,分压=总压×物质的量分数;甲醇选择性: ]。
]。
(1)工业上利用合成气合成甲醇:


已知:几种热化学方程式如下、其中,a、b、c都大于0。
①
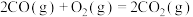
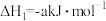 ;
;②

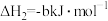 ;
;③


则上述反应中的

 。
。(2)一定温度下,在恒容密闭容器中充入1molCO和
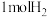 ,在固体催化剂作用下合成甲醇:
,在固体催化剂作用下合成甲醇: ,下列叙述正确的是_______(填字母)。
,下列叙述正确的是_______(填字母)。| A.当CO体积分数不变时达到平衡状态 |
| B.平衡后充入少量氩气,平衡向左移动 |
C.平衡后再充入0.1molCO和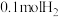 ,CO平衡转化率增大 ,CO平衡转化率增大 |
| D.增大催化剂质量,正、逆反应速率同倍数增大 |
(3)甲醇是一种潜在储氢材料。我国学者研究甲醇在钯基催化剂表而上分解制氢:
 ,其反应历程如图所示(吸附在催化剂表面的物种用“*”表示)。
,其反应历程如图所示(吸附在催化剂表面的物种用“*”表示)。
总反应的焓变为
 ,写出该步反应式:
,写出该步反应式:(4)工业上,可以采用
 催化还原制备
催化还原制备 、
、 。发生反应如下:
。发生反应如下:①
 (主反应);
(主反应);②
 (主反应);
(主反应);③
 (副反应)。
(副反应)。一定温度下,在甲、乙体积相同的反应容器中分别充入
 和
和 ,发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得
,发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得 平衡转化率与压强关系如图所示。其他条件相同,增大压强,
平衡转化率与压强关系如图所示。其他条件相同,增大压强, 平衡转化率增大,其原因是
平衡转化率增大,其原因是
(5)一定温度下,向总压强恒定为100kPa的反应器中充入
 和
和 ,发生(4)中反应①②③,达到平衡时
,发生(4)中反应①②③,达到平衡时 转化率为50%,甲醇选择性为
转化率为50%,甲醇选择性为 ,生成
,生成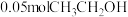 ,则反应①的平衡常数
,则反应①的平衡常数 为
为 (写出数字表达式即可)[用分压计算的平衡常数为压强平衡常数
(写出数字表达式即可)[用分压计算的平衡常数为压强平衡常数 ,分压=总压×物质的量分数;甲醇选择性:
,分压=总压×物质的量分数;甲醇选择性: ]。
]。
您最近一年使用:0次
名校
解题方法
7 . 中国科学院南京土壤研究所方国东研究员系统地开展了基于土壤中钒氧化物(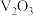 )高效活化过硫酸盐,降解持久性有机污染物多氯联苯的研究,该降解土壤中多氯联苯的反应机理如图所示。
)高效活化过硫酸盐,降解持久性有机污染物多氯联苯的研究,该降解土壤中多氯联苯的反应机理如图所示。
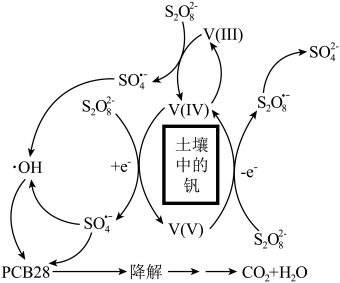
已知:①PCB28为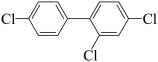 。
。
② 的结构为
的结构为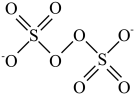
下列说法正确的是
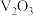 )高效活化过硫酸盐,降解持久性有机污染物多氯联苯的研究,该降解土壤中多氯联苯的反应机理如图所示。
)高效活化过硫酸盐,降解持久性有机污染物多氯联苯的研究,该降解土壤中多氯联苯的反应机理如图所示。
已知:①PCB28为
 。
。②
 的结构为
的结构为
下列说法正确的是
| A.该反应机理中只有一个基元反应 |
| B.PCB28属于高分子 |
C. 和·OH自由基均具有较强的还原性 和·OH自由基均具有较强的还原性 |
| D.土壤中+3价的钒在反应过程中作催化剂 |
您最近一年使用:0次
8 . 工业合成氨[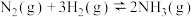 ]是人类科学技术的一项重大突破。已知:工业合成氨的主要设备是反应塔;合成氨反应的速率方程为
]是人类科学技术的一项重大突破。已知:工业合成氨的主要设备是反应塔;合成氨反应的速率方程为 (k为速率常数,与温度、催化剂有关,与浓度无关)。下列有关说法错误的是
(k为速率常数,与温度、催化剂有关,与浓度无关)。下列有关说法错误的是
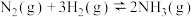 ]是人类科学技术的一项重大突破。已知:工业合成氨的主要设备是反应塔;合成氨反应的速率方程为
]是人类科学技术的一项重大突破。已知:工业合成氨的主要设备是反应塔;合成氨反应的速率方程为 (k为速率常数,与温度、催化剂有关,与浓度无关)。下列有关说法错误的是
(k为速率常数,与温度、催化剂有关,与浓度无关)。下列有关说法错误的是| A.选用合适的催化剂能提高工业合成氨的生产效率 |
| B.在合成氨过程中,不断分离出氨气,可以加快反应速率 |
| C.工业采用高温、高压反应条件,均可增大活化分子百分数 |
| D.将反应塔与外接电源负极相连并控制适当电压,可防其腐蚀 |
您最近一年使用:0次
9 . 如图为某反应的机理示意图。下列说法不正确的是


| A.该反应为分解反应 |
| B.催化剂参与了反应 |
| C.用HCOOK溶液代替HCOOH得不到H2 |
| D.用HCOOD代替HCOOH可得HD |
您最近一年使用:0次
10 . 从下列实验事实所得出的现象解释或结论错误的是
| 选项 | 实验事实 | 现象解释或结论 |
| A | 将0.1mol/L5mL的Na2S2O3溶液和0.1mol/L5mL的H2SO4溶液混合后平均分装在2支试管中,一支放入冷水中,另一支放入热水中 | 放置在热水的试管中的溶液先出现浑浊,说明升高温度,化学反应速率会加快 |
| B | 锌与稀硫酸反应过程中,开始反应后速率逐渐增大 | 该反应是放热反应 |
| C | 压缩针筒内的NO2和N2O4混合气体,颜色先变深后变浅 | 颜色先变深是浓度变大的原因,后变浅是压强变化对化学平衡的影响 |
| D | 向2mL0.1mol/L的FeCl3溶液中加入1滴KSCN溶液变为红色后,再加入少量KCl固体 | 溶液红色变浅,说明增大生成物浓度会使平衡逆向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-10更新
|
361次组卷
|
4卷引用:河南省商丘名校2023-2024学年高二上学期11月期中考试化学试题



