1 . 碱金属及其化合物在工农业生产中用途广泛。下列说法错误的是( )
| A.第一电离能:Na>K>Rb>Cs |
| B.与基态钾原子同周期且未成对电子数相同的元素还有4种 |
| C.金属钠的三维空间堆积方式为体心立方堆积,钠原子的配位数为8 |
| D.锂、钠、钾三种元素焰色反应的颜色分别为绿色、黄色、紫色 |
您最近一年使用:0次
名校
解题方法
2 . 金晶体的晶胞为面心立方堆积,如图所示。设金原子的直径为d,用NA表示阿伏加 德罗常数,在立方体的各个面的对角线上,3个金原子彼此两两相切,M表示金的摩尔质量。则下列说法错误的是( )
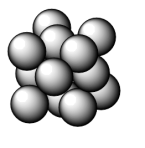

| A.金晶体每个晶胞中含有4个金原子 |
| B.金属键无方向性,金属原子尽可能采取密堆积 |
C.一个晶胞的体积是16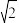 d3 d3 |
D.金晶体的密度是 |
您最近一年使用:0次
2020-06-15更新
|
335次组卷
|
12卷引用:山东省枣庄滕州市2020-2021学年高二下学期期中质量检测化学试题
山东省枣庄滕州市2020-2021学年高二下学期期中质量检测化学试题(已下线)2018年12月5日 《每日一题》一轮复习-晶体的计算(已下线)2019年6月28日《每日一题》选修3—— 晶体结构类题课时1 金属晶体——A学习区 夯实基础(鲁科版选修3)河北省博野中学2019-2020学年高二下学期开学考试化学试题四川省巴中市平昌县驷马中学2020-2021学年高二上学期 十一月月考化学试题(已下线)3.1 认识晶体-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)福建省仙游县枫亭中学2020-2021学年高二下学期期中考试化学试题(已下线)课时56 晶体结构与性质-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第44练 金属晶体与离子晶体-2023年高考化学一轮复习小题多维练(全国通用)专题3 微粒间作用力与物质性质 第一单元 金属键 金属晶体 第2课时 金属晶体3.1.2金属晶体 课后
名校
解题方法
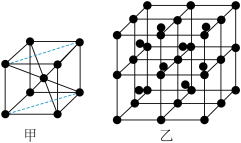
3 . Al 的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示。
已知 Al的原子半径为 d,NA代表阿伏加 德罗常数,Al 的相对原子质量为 M。
(1)晶胞中 Al 原子的配位数为_____ ,一个晶胞中 Al 原子的数目为_____ ,该晶胞的空间利用率是_____ 。
(2)该晶体的密度为_____ (用字母表示)。

已知 Al的原子半径为 d,NA代表阿伏加 德罗常数,Al 的相对原子质量为 M。
(1)晶胞中 Al 原子的配位数为
(2)该晶体的密度为
您最近一年使用:0次
名校
4 . 金属原子在二维平面里的放置有如图所示的两种方式,下列说法中正确的是
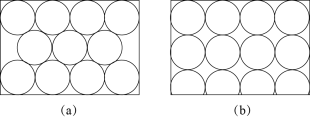

| A.图(a)为非密置层,配位数为 6 |
| B.图(b)为密置层,配位数为 4 |
| C.图(a)在三维空间里堆积可得到镁型和铜型 |
| D.图(b)在三维空间里堆积仅得到简单立方堆积 |
您最近一年使用:0次
解题方法
5 . 已知X、Y、Z、W、R都是周期表中前四周期的元素,它们的核电荷数依次增大。X原子有1个2p空轨道,Y原子最外层电子数等于X原子核外电子总数,Z与X同主族,W原子3p轨道只有一个单电子,R3+的3d轨道为半充满状态。回答下列问题:
(1)元素X、Y、Z的电负性由大到小的顺序是__ (用元素符号表示)。
(2)元素X、Z的最简单气态氢化物的沸点由高到低的顺序是__ (用化学式表示)。
(3)元素X、Y形成的一种化合物在高温高压下所形成的晶体其晶胞如图所示,则该晶体类型属于__ 晶体,1个晶胞中含有__ 个X原子。

(4)R的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的图A~D中正确的是__ (填字母标号)。
A.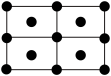 B.
B.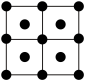 C.
C.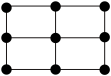 D.
D.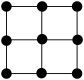
假设R原子的半径是apm,则该晶体的密度的计算式是__ g·cm-3(用含a的式子表示,设阿伏加 德罗常数的值为NA)。
(1)元素X、Y、Z的电负性由大到小的顺序是
(2)元素X、Z的最简单气态氢化物的沸点由高到低的顺序是
(3)元素X、Y形成的一种化合物在高温高压下所形成的晶体其晶胞如图所示,则该晶体类型属于

(4)R的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的图A~D中正确的是

A.
 B.
B. C.
C. D.
D.
假设R原子的半径是apm,则该晶体的密度的计算式是
您最近一年使用:0次
解题方法
6 . 用NaBH4进行“化学镀”镀镍,可以得到坚硬、耐腐蚀的保护层(3Ni3B+Ni),反应的离子方程式为:20Ni2++16BH4-+34OH-+6H2O=2(3Ni3B+Ni)+10B(OH)4-+35H2 ,下列说法不正确的是
,下列说法不正确的是
 ,下列说法不正确的是
,下列说法不正确的是| A.1mol B(OH)4-含有σ键的数目为8NA |
| B.BH4—的立体构型是正四面体形 |
| C.B原子核外电子的运动状态和能量均不相同 |
D.Ni的晶胞结构如图所示: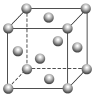 ,镍原子的配位数为12 ,镍原子的配位数为12 |
您最近一年使用:0次
名校
解题方法
7 . 下列对各组物质性质的比较中,不正确的是( )
| A.熔点:Li>Na>K |
| B.空间利用率:体心立方堆积<六方最密堆积<面心立方最密堆积 |
| C.密度:Na<Mg<Al |
| D.导电性:Ag>Cu>Al>Fe |
您最近一年使用:0次
名校
8 . 下列有关叙述卟啉配合物叶绿素的说法不正确的是( )
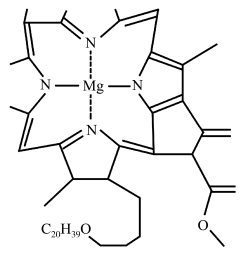

| A.该配合物的配位数为4 |
| B.该化合物所包含元素的非金属性:O>N>C>H>Mg |
| C.Mg单质晶体结构符合A3型最密堆积 |
| D.化合物中C元素的杂化方式sp2、sp3 |
您最近一年使用:0次
名校
解题方法
9 . 铁元素是最重要的金属元素之一,其不仅是各种钢材的主要成分,很多含铁化合物也具有重要意义。
(1)按照电子排布,可把元素周期表中的元素划分成五个区,铁元素属于_________ 区。
(2)Mn2+在水溶液中难被氧化,而Fe2+则易被氧化为Fe3+ ,请从离子的价电子式角度解释Mn2+与Fe2+还原能力的差别:_________ 。Mn2+的半径_________ Fe3+的半径(填“>”、“<”或“=”)。
(3)金属铁晶体中铁原子采用体心立方堆积,该铁晶体的空间利用率为_________ (用含π的式子表示)。
(4)向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN)(H2O)5]2+。N、H、O三种元素的电负性由大到小的顺序为_________ ;[Fe(SCN)(H2O)5]2+中Fe3+的配位数为_________ ,H2O中氧原子的杂化方式为_________ 。
(5)二茂铁是一种含铁的有机化合物,其化学式为Fe(C5H5)2,可看作是Fe2+离子与两个正五边形的环戊二烯负离子(C5H )配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π
)配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π ),则C5H
),则C5H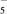 的大π键表示为
的大π键表示为________ 。二茂铁是黄色针状晶体,熔点173 ℃(在100 ℃时开始升华),沸点249 ℃,在水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是________ (填标号)。
A 离子键 B 配位键 C σ 键 D 范德华力
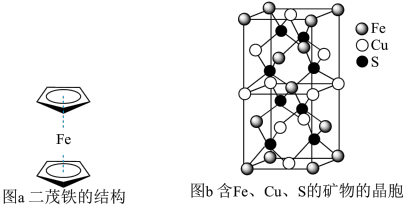
(6)一种含有Fe、Cu、S三种元素的矿物的晶胞(如上图b所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为_________ 。若晶胞的底面边长为A pm,高为C pm,阿伏加 德罗常数为NA,则该晶体的密度为__________ g/cm3(写出表达式)。
(1)按照电子排布,可把元素周期表中的元素划分成五个区,铁元素属于
(2)Mn2+在水溶液中难被氧化,而Fe2+则易被氧化为Fe3+ ,请从离子的价电子式角度解释Mn2+与Fe2+还原能力的差别:
(3)金属铁晶体中铁原子采用体心立方堆积,该铁晶体的空间利用率为
(4)向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的[Fe(SCN)(H2O)5]2+。N、H、O三种元素的电负性由大到小的顺序为
(5)二茂铁是一种含铁的有机化合物,其化学式为Fe(C5H5)2,可看作是Fe2+离子与两个正五边形的环戊二烯负离子(C5H
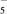 )配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π
)配体形成的夹心型分子(如下图a所示)。已知大π键可用符号Π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π ),则C5H
),则C5H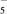 的大π键表示为
的大π键表示为A 离子键 B 配位键 C σ 键 D 范德华力

(6)一种含有Fe、Cu、S三种元素的矿物的晶胞(如上图b所示),属于四方晶系(晶胞底面为正方形),晶胞中S原子位于内部,Fe原子位于体心和晶胞表面,Cu原子位于晶胞表面。此矿物的化学式为
您最近一年使用:0次
2020-03-13更新
|
603次组卷
|
3卷引用:山东省临沂市临沂商城实验学校2020届高三新高考第七次阶段性模拟测试化学试题
10 . 铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg)。则下列说法不正确的是
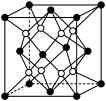

| A.铁镁合金的化学式为Mg2Fe |
| B.晶体中存在的化学键类型为共价键 |
| C.晶格能:氧化镁>氧化钙 |
D.该晶胞的质量是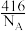 g(NA表示阿伏加 德罗常数的值) g(NA表示阿伏加 德罗常数的值) |
您最近一年使用:0次
2019-11-28更新
|
125次组卷
|
2卷引用:山东省烟台市2020届高三上学期期中考试化学试题



