名校
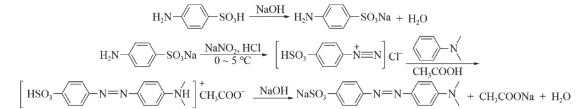
1 . 实验室在酸性环境下用重铬酸钠氧化环己醇制备环己酮的流程如图所示:
下列说法不正确的是
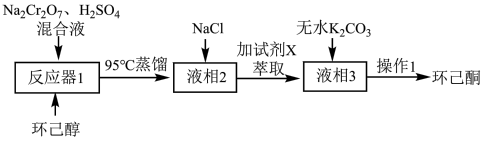
下列说法不正确的是
A.若将环己醇滴加入 和 和 的混合溶液中会降低环己酮的产率 的混合溶液中会降低环己酮的产率 |
| B.NaCl可降低产物在水中溶解度,便于后续萃取、分液 |
| C.“试剂X”可选用丙酮一次萃取“液相2”来提高产率 |
| D.“操作1”中可选用空气冷凝管 |
您最近一年使用:0次
名校
解题方法
2 . 工业上高炉炼铁产生的CO和CO2可以按如下流程脱除或利用。___________ 。
(2)煅烧产生的尾气可通过途径Ⅱ转化为CO2.。2分子氨和1分子CO2生产A,最终转化为尿素[CO(NH2)2];可通过途径Ⅲ转为b。
①下列说法正确的是___________ 。
A.黄铁(FeS2)可作为高炉炼铁的铁源
B.途径Ⅱ可通过实现反应转化MnO2+CO→CO2+Mn2O3
C.化合物A是一种盐
D.化合物B为CH3COONa
②尿素[CO(NH2)2]在较高温度下可以聚合成环状化合物三聚氰胺(C3H6N6),写出该反应的化学方程式___________ 。
(3)设计实验验证化合物A中含有N元素___________ ;写出实验过程中涉及的反应方程式___________ 。

已知: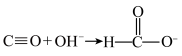 。请回答:
。请回答:
(2)煅烧产生的尾气可通过途径Ⅱ转化为CO2.。2分子氨和1分子CO2生产A,最终转化为尿素[CO(NH2)2];可通过途径Ⅲ转为b。
①下列说法正确的是
A.黄铁(FeS2)可作为高炉炼铁的铁源
B.途径Ⅱ可通过实现反应转化MnO2+CO→CO2+Mn2O3
C.化合物A是一种盐
D.化合物B为CH3COONa
②尿素[CO(NH2)2]在较高温度下可以聚合成环状化合物三聚氰胺(C3H6N6),写出该反应的化学方程式
(3)设计实验验证化合物A中含有N元素
您最近一年使用:0次
名校
解题方法
3 . 富硼渣中含有镁硼酸盐(2MgO·B2O3)、镁硅酸盐(2MgO·SiO2)及少量Al2O3、FeO等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(H3BO3)晶体的一种工艺流程如下。


A.酸浸时镁硼酸盐发生反应为 |
| B.向NaHCO3固体中滴加饱和硼酸溶液,有气泡产生 |
| C.加入MgO的目的是调节溶液的pH,使杂质离子转化为Fe(OH)3、Al(OH)3沉淀 |
| D.已知浓缩滤液时MgSO4和H3BO3接近饱和;将滤液浓缩蒸发结晶,得到硫酸镁晶体,趁热过滤,再将母液降温结晶,分离得到硼酸晶体 |
您最近一年使用:0次
4 . 碘化锡(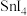 )主要用于制造有机锡配合物。某小组利用单质锡和碘制备碘化锡,其主要实验流程如下(反应装置见下图,夹持仪器略去):
)主要用于制造有机锡配合物。某小组利用单质锡和碘制备碘化锡,其主要实验流程如下(反应装置见下图,夹持仪器略去):
②碘化锡在丙酮和热的石油醚中溶解度较大,在冷的石油醚中溶解度小。
③石油醚的沸点为60~90℃,碘单质的升华温度为45~77℃。
请回答:
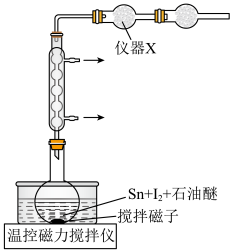
(1)反应装置中仪器X的名称是___________ 。
(2)下列说法不正确的是___________。
(3)反应装置中,为使紫色碘蒸气上升不高于冷凝管的中间部位,可采取的措施是___________ 。判断“反应装置”中的反应已完全的实验现象是___________ 。
(4)步骤 ,圆底烧瓶中还附着四碘化锡晶体,处理的方法是
,圆底烧瓶中还附着四碘化锡晶体,处理的方法是___________ 。
(5)产品中的杂质可以进一步采用重结晶法提纯。请从下列选项中选择最佳选项并进行排序。___________
取碘化锡样品放入烧杯中→___________→___________→___________
a.加入适量的热水
b.加入适量的热的石油醚
c.用冷水浴冷却结晶
d.趁热过滤
e.加入适量的冷的石油醚
(6)该小组对制备的碘化锡产品进行性质和组成上的研究。
①取适量的产品溶解在2mL丙酮中配成溶液,再加入1ml蒸馏水,产生白色无定型沉淀,写出反应的化学方程式___________ 。
②本实验可以通过测定某些物理量来确定碘化锡的化学式,需测定的物理量有___________ 。
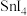 )主要用于制造有机锡配合物。某小组利用单质锡和碘制备碘化锡,其主要实验流程如下(反应装置见下图,夹持仪器略去):
)主要用于制造有机锡配合物。某小组利用单质锡和碘制备碘化锡,其主要实验流程如下(反应装置见下图,夹持仪器略去):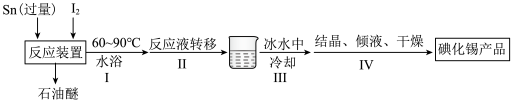
②碘化锡在丙酮和热的石油醚中溶解度较大,在冷的石油醚中溶解度小。
③石油醚的沸点为60~90℃,碘单质的升华温度为45~77℃。
请回答:
(1)反应装置中仪器X的名称是
(2)下列说法不正确的是___________。
| A.将锡片剪成细小碎片、碘磨细的原因是充分反应,同时提高反应速率 |
| B.仪器X的作用是吸收石油醚,防止石油醚扩散到空气中 |
C.步骤 可以不转移反应液,直接在原反应装置(圆底烧瓶)中进行后续操作 可以不转移反应液,直接在原反应装置(圆底烧瓶)中进行后续操作 |
D.步骤 采用蒸发结晶比冷却结晶更好 采用蒸发结晶比冷却结晶更好 |
(3)反应装置中,为使紫色碘蒸气上升不高于冷凝管的中间部位,可采取的措施是
(4)步骤
 ,圆底烧瓶中还附着四碘化锡晶体,处理的方法是
,圆底烧瓶中还附着四碘化锡晶体,处理的方法是(5)产品中的杂质可以进一步采用重结晶法提纯。请从下列选项中选择最佳选项并进行排序。
取碘化锡样品放入烧杯中→___________→___________→___________
a.加入适量的热水
b.加入适量的热的石油醚
c.用冷水浴冷却结晶
d.趁热过滤
e.加入适量的冷的石油醚
(6)该小组对制备的碘化锡产品进行性质和组成上的研究。
①取适量的产品溶解在2mL丙酮中配成溶液,再加入1ml蒸馏水,产生白色无定型沉淀,写出反应的化学方程式
②本实验可以通过测定某些物理量来确定碘化锡的化学式,需测定的物理量有
您最近一年使用:0次
解题方法
5 . 斑铜矿(主要成分是Cu5FeS4,含少量SiO2)是自然界中最丰富的含铜矿物之一,以斑铜矿为原料可实现如下转化。
②Cu+酸性条件发生自身氧化还原反应生成Cu2+和Cu。
③ 加热时易失去NH3。
加热时易失去NH3。
请回答:
(1)①溶液A中加试剂X可实现FeCl3的循环利用,则试剂X是_______ 。
②固体C可通过溶解、过滤、蒸馏等操作分离出硫单质,溶解时最适宜的溶剂为_______ 。
A.水 B.NaOH溶液 C.CS2 D.酒精
(2)步骤Ⅱ需快速将固体B投入到NaCl溶液中,原因是_______ 。
(3)写出溶液D中的所有阳离子_______ 。
(4)写出反应I的离子方程式_______ 。
(5)将斑铜矿在有氧条件下用氨水浸出,可制得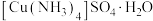 晶体,反应原理为
晶体,反应原理为 (未配平)。设计由浸出液制取
(未配平)。设计由浸出液制取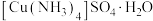 晶体的实验方案:
晶体的实验方案:_______ 。

②Cu+酸性条件发生自身氧化还原反应生成Cu2+和Cu。
③
 加热时易失去NH3。
加热时易失去NH3。请回答:
(1)①溶液A中加试剂X可实现FeCl3的循环利用,则试剂X是
②固体C可通过溶解、过滤、蒸馏等操作分离出硫单质,溶解时最适宜的溶剂为
A.水 B.NaOH溶液 C.CS2 D.酒精
(2)步骤Ⅱ需快速将固体B投入到NaCl溶液中,原因是
(3)写出溶液D中的所有阳离子
(4)写出反应I的离子方程式
(5)将斑铜矿在有氧条件下用氨水浸出,可制得
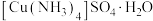 晶体,反应原理为
晶体,反应原理为 (未配平)。设计由浸出液制取
(未配平)。设计由浸出液制取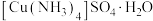 晶体的实验方案:
晶体的实验方案:
您最近一年使用:0次
解题方法
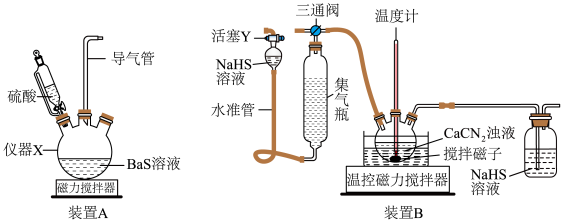
6 . 硫代尿素 是重要的工业原料.某小组按如图流程开展制备实验(部分装置及夹持仪器已省略)。主要反应:
是重要的工业原料.某小组按如图流程开展制备实验(部分装置及夹持仪器已省略)。主要反应:
步骤Ⅱ: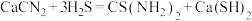
步骤Ⅲ: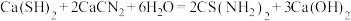
已知:硫代尿素 可溶于水、乙醇,微溶于乙醚
可溶于水、乙醇,微溶于乙醚_________ (填仪器名称)。
(2)下列说法不正确的是_________。
(3)步骤Ⅰ、Ⅱ、Ⅲ的部分操作如下,其正确的顺序是:________ 。
(_________)→(_________)→a→(_________)→e→f→(_________)
c.调节装置B温控磁力搅拌器,并控制温度为
d.调节装置B温控磁力搅拌器,并迅速控温在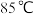
g.检测气体纯净后连接三通阀
(4)步骤Ⅳ的主要 操作是(请补上第一步):_________ →洗涤、合并滤液→冷冻结晶。
上述步骤中的最适宜洗涤剂是_________ 。
A.冷水 B.热水 C.乙醚 D.滤液
(5)产品含量的测定:
滴定反应: ;
;
主要步骤:
Ⅰ.称取 产品用蒸馏水溶解并定容至
产品用蒸馏水溶解并定容至 。移取该溶液
。移取该溶液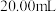 注入碘量瓶中,加
注入碘量瓶中,加 碘标准液,
碘标准液, 氢氧化钠溶液,于暗处放置
氢氧化钠溶液,于暗处放置 。加适量水及盐酸摇匀,用
。加适量水及盐酸摇匀,用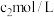 硫代硫酸钠标准溶液滴定,
硫代硫酸钠标准溶液滴定,近终点时,加 3mL淀粉指示液 ,继续滴定至终点,消耗体积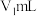 。
。
Ⅱ.空白实验:将上述样品溶液改为蒸馏水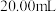 注入碘量瓶中,重复后续步骤,滴定至终点时消耗体积
注入碘量瓶中,重复后续步骤,滴定至终点时消耗体积 。
。
①需要加入淀粉指示液时,锥形瓶中溶液的现象是_________ 。
②产品的质量分数为_________ 。
 是重要的工业原料.某小组按如图流程开展制备实验(部分装置及夹持仪器已省略)。主要反应:
是重要的工业原料.某小组按如图流程开展制备实验(部分装置及夹持仪器已省略)。主要反应:步骤Ⅱ:
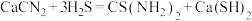
步骤Ⅲ:
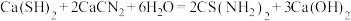
已知:硫代尿素
 可溶于水、乙醇,微溶于乙醚
可溶于水、乙醇,微溶于乙醚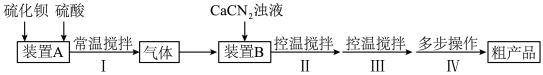
(2)下列说法不正确的是_________。
A.配制5%的 溶液必须用到的玻璃仪器有烧杯、玻璃棒、容量瓶等 溶液必须用到的玻璃仪器有烧杯、玻璃棒、容量瓶等 |
| B.装置A使用恒压分液漏斗添加硫酸溶液时,可以打开漏斗上部的玻璃塞 |
C.在反应前若向装置B中通入一段时间 ,能提高产品的产率 ,能提高产品的产率 |
| D.步骤Ⅱ反应完全的现象是溶液变澄清,集气瓶液面不再改变 |
(3)步骤Ⅰ、Ⅱ、Ⅲ的部分操作如下,其正确的顺序是:
(_________)→(_________)→a→(_________)→e→f→(_________)
a.调节三通阀如图 ,收集气体一段时间
,收集气体一段时间
c.调节装置B温控磁力搅拌器,并控制温度为

d.调节装置B温控磁力搅拌器,并迅速控温在
e.调节三通阀如图
g.检测气体纯净后连接三通阀
(4)步骤Ⅳ的
上述步骤中的最适宜洗涤剂是
A.冷水 B.热水 C.乙醚 D.滤液
(5)产品含量的测定:
滴定反应:
 ;
;
主要步骤:
Ⅰ.称取
 产品用蒸馏水溶解并定容至
产品用蒸馏水溶解并定容至 。移取该溶液
。移取该溶液 注入碘量瓶中,加
注入碘量瓶中,加 碘标准液,
碘标准液, 氢氧化钠溶液,于暗处放置
氢氧化钠溶液,于暗处放置 。加适量水及盐酸摇匀,用
。加适量水及盐酸摇匀,用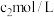 硫代硫酸钠标准溶液滴定,
硫代硫酸钠标准溶液滴定,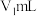 。
。Ⅱ.空白实验:将上述样品溶液改为蒸馏水
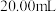 注入碘量瓶中,重复后续步骤,滴定至终点时消耗体积
注入碘量瓶中,重复后续步骤,滴定至终点时消耗体积 。
。①需要加入淀粉指示液时,锥形瓶中溶液的现象是
②产品的质量分数为
您最近一年使用:0次
2024-04-01更新
|
395次组卷
|
4卷引用:2024届浙江省温州市高三下学期第二次适应性考试(二模)化学试题
2024届浙江省温州市高三下学期第二次适应性考试(二模)化学试题浙江省温州市普通高中2024届高三下学期第二次适应性考试(二模)化学试题(已下线)化学(浙江卷02)-2024年高考押题预测卷(已下线)压轴题12 化学实验综合题(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
名校
解题方法
7 . 合成甲基橙( ,分子量为327,变色范围
,分子量为327,变色范围 值为
值为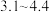 )的实验步骤如下:
)的实验步骤如下:
①在一支试管中加入 对氨基苯磺酸(分子量为173),
对氨基苯磺酸(分子量为173),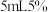 的氢氧化钠溶液,使其溶解,另加入
的氢氧化钠溶液,使其溶解,另加入 亚硝酸钠溶于
亚硝酸钠溶于 水中,加入上述反应液的溶液。在(a)冰盐浴冷却并搅拌下,将该混合液加入盛有
水中,加入上述反应液的溶液。在(a)冰盐浴冷却并搅拌下,将该混合液加入盛有 水和
水和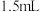 浓盐酸的烧杯中,温度始终保持在
浓盐酸的烧杯中,温度始终保持在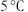 以下,直至产生白色沉淀(已知此反应大量放热)。
以下,直至产生白色沉淀(已知此反应大量放热)。
②在试管中将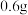 的N,N-二甲基苯胺(分子量为121)和
的N,N-二甲基苯胺(分子量为121)和 冰乙酸混合均匀。在搅拌下将该溶液滴加到冷却的重氮盐溶液中,加完后继续搅拌
冰乙酸混合均匀。在搅拌下将该溶液滴加到冷却的重氮盐溶液中,加完后继续搅拌 ,此时溶液为深红色。在搅拌下,慢慢加入
,此时溶液为深红色。在搅拌下,慢慢加入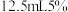 氢氧化钠溶液,此时有固体析出,(b)溶液变成橙黄色,在沸水浴加热5分钟,抽滤,依次用少量水、乙醇、乙醚洗涤。得到(c)紫色晶体,产率约
氢氧化钠溶液,此时有固体析出,(b)溶液变成橙黄色,在沸水浴加热5分钟,抽滤,依次用少量水、乙醇、乙醚洗涤。得到(c)紫色晶体,产率约 。
。
③将粗产品用0.4%的氢氧化钠水溶液进行重结晶,得到橙黄色明亮的小叶片状晶体。
根据上述实验原理,下列说法错误的是
 ,分子量为327,变色范围
,分子量为327,变色范围 值为
值为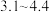 )的实验步骤如下:
)的实验步骤如下:①在一支试管中加入
 对氨基苯磺酸(分子量为173),
对氨基苯磺酸(分子量为173),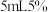 的氢氧化钠溶液,使其溶解,另加入
的氢氧化钠溶液,使其溶解,另加入 亚硝酸钠溶于
亚硝酸钠溶于 水中,加入上述反应液的溶液。在(a)冰盐浴冷却并搅拌下,将该混合液加入盛有
水中,加入上述反应液的溶液。在(a)冰盐浴冷却并搅拌下,将该混合液加入盛有 水和
水和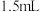 浓盐酸的烧杯中,温度始终保持在
浓盐酸的烧杯中,温度始终保持在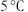 以下,直至产生白色沉淀(已知此反应大量放热)。
以下,直至产生白色沉淀(已知此反应大量放热)。②在试管中将
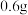 的N,N-二甲基苯胺(分子量为121)和
的N,N-二甲基苯胺(分子量为121)和 冰乙酸混合均匀。在搅拌下将该溶液滴加到冷却的重氮盐溶液中,加完后继续搅拌
冰乙酸混合均匀。在搅拌下将该溶液滴加到冷却的重氮盐溶液中,加完后继续搅拌 ,此时溶液为深红色。在搅拌下,慢慢加入
,此时溶液为深红色。在搅拌下,慢慢加入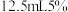 氢氧化钠溶液,此时有固体析出,(b)溶液变成橙黄色,在沸水浴加热5分钟,抽滤,依次用少量水、乙醇、乙醚洗涤。得到(c)紫色晶体,产率约
氢氧化钠溶液,此时有固体析出,(b)溶液变成橙黄色,在沸水浴加热5分钟,抽滤,依次用少量水、乙醇、乙醚洗涤。得到(c)紫色晶体,产率约 。
。③将粗产品用0.4%的氢氧化钠水溶液进行重结晶,得到橙黄色明亮的小叶片状晶体。

根据上述实验原理,下列说法错误的是
| A.实验中得到的N,N-二甲基苯胺需要在蒸馏后才能使用 |
| B.使用乙醚洗涤的目的是为了除去产物中残留的乙醇和水 |
| C.重结晶操作时需要加入过量水使甲基橙溶解 |
| D.N,N-二甲基苯胺的蒸馏应当在通风橱中进行 |
您最近一年使用:0次
2024-02-19更新
|
480次组卷
|
2卷引用:浙江省宁波市镇海中学2023-2024学年高三上学期新高考调研卷化学试题
名校
解题方法
8 . 硼氢化钠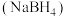 是一种潜在储氢剂,在有机合成中也被称为“万能还原剂”。实验室制备、提纯、分析
是一种潜在储氢剂,在有机合成中也被称为“万能还原剂”。实验室制备、提纯、分析 纯度的步骤如下。
纯度的步骤如下。
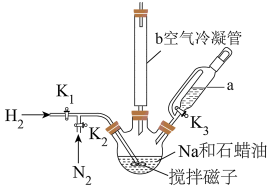
Ⅰ. 的制备
的制备
利用如图甲装置(加热及夹持装置略)进行操作: ,鼓入
,鼓入 ,升温到110℃,快速搅拌,将融化的Na快速分散到石蜡油中;
,升温到110℃,快速搅拌,将融化的Na快速分散到石蜡油中;
(ⅱ)升温到200℃,关闭 ,打开
,打开 通入
通入 ,充分反应后制得
,充分反应后制得 ;
;
(ⅲ)升温到240℃,持续搅拌下通入 ,打开
,打开 滴入硼酸三甲酯[分子式为
滴入硼酸三甲酯[分子式为 ];
];
(ⅳ)降温后,分离得到 和
和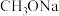 的固体混合物。
的固体混合物。
已知:
 :可溶于异丙胺或水,常温下与水缓慢反应,强碱环境下能稳定存在
:可溶于异丙胺或水,常温下与水缓慢反应,强碱环境下能稳定存在
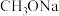 :难溶于异丙胺
:难溶于异丙胺
异丙胺:有机溶剂,沸点:33℃
Ⅱ. 的提纯
的提纯
 可采用索氏提取法提纯,其装置如图乙所示,实验时将
可采用索氏提取法提纯,其装置如图乙所示,实验时将 和
和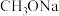 的固体混合物放入滤纸套筒1中,烧瓶中加入异丙胺。烧瓶中异丙胺受热蒸发上升,冷凝后滴入滤纸套筒1中,再经导管返回烧瓶,从而实现连续萃取。
的固体混合物放入滤纸套筒1中,烧瓶中加入异丙胺。烧瓶中异丙胺受热蒸发上升,冷凝后滴入滤纸套筒1中,再经导管返回烧瓶,从而实现连续萃取。
步骤1:取m g产品(杂质不参加反应)溶于 溶液后配成
溶液后配成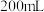 溶液,取
溶液,取 置于碘量瓶中,加入
置于碘量瓶中,加入 的
的 溶液充分反应。(
溶液充分反应。( )
)
步骤2:向步骤1反应后溶液中加入过量的KI溶液,用稀硫酸调节pH,使过量 转化为
转化为 ,冷却后于暗处放数分钟。
,冷却后于暗处放数分钟。
步骤3:将步骤2所得混合液调pH约为5.0,加入几滴淀粉,用 标准溶液滴定至终点,消耗溶液
标准溶液滴定至终点,消耗溶液 。(
。( )
)
回答下列问题:
(1)仪器a的名称是__________ 。
(2)写出 与
与 反应的化学方程式
反应的化学方程式__________ 。
(3)下列有关说法不正确的是__________。
(4)按照先后顺序对本实验的滴定操作排序
检查是否漏水→蒸馏水洗涤→__________ →__________→a→__________→__________→__________。
a.加液至“0”刻度以上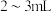 处
处
b.调整液面至“0”刻度或“0”刻度下方,记录读数
c.倾斜转动滴定管,使标准液润湿滴定管内壁,将润洗液从下口排出
d.赶出尖嘴部分气泡
e.向碱式滴定管中加 标准液
标准液
f.向酸式滴定管中加 标准液
标准液
g.左手控制活塞(或挤压玻璃珠),右手振荡锥形瓶
h.左手振荡锥形瓶,右手控制活塞(或挤压玻璃珠)
(5)产品中 的纯度为
的纯度为__________ %。
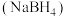 是一种潜在储氢剂,在有机合成中也被称为“万能还原剂”。实验室制备、提纯、分析
是一种潜在储氢剂,在有机合成中也被称为“万能还原剂”。实验室制备、提纯、分析 纯度的步骤如下。
纯度的步骤如下。Ⅰ.
 的制备
的制备利用如图甲装置(加热及夹持装置略)进行操作:
 ,鼓入
,鼓入 ,升温到110℃,快速搅拌,将融化的Na快速分散到石蜡油中;
,升温到110℃,快速搅拌,将融化的Na快速分散到石蜡油中;(ⅱ)升温到200℃,关闭
 ,打开
,打开 通入
通入 ,充分反应后制得
,充分反应后制得 ;
;(ⅲ)升温到240℃,持续搅拌下通入
 ,打开
,打开 滴入硼酸三甲酯[分子式为
滴入硼酸三甲酯[分子式为 ];
];(ⅳ)降温后,分离得到
 和
和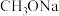 的固体混合物。
的固体混合物。已知:
 :可溶于异丙胺或水,常温下与水缓慢反应,强碱环境下能稳定存在
:可溶于异丙胺或水,常温下与水缓慢反应,强碱环境下能稳定存在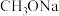 :难溶于异丙胺
:难溶于异丙胺异丙胺:有机溶剂,沸点:33℃
Ⅱ.
 的提纯
的提纯 可采用索氏提取法提纯,其装置如图乙所示,实验时将
可采用索氏提取法提纯,其装置如图乙所示,实验时将 和
和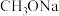 的固体混合物放入滤纸套筒1中,烧瓶中加入异丙胺。烧瓶中异丙胺受热蒸发上升,冷凝后滴入滤纸套筒1中,再经导管返回烧瓶,从而实现连续萃取。
的固体混合物放入滤纸套筒1中,烧瓶中加入异丙胺。烧瓶中异丙胺受热蒸发上升,冷凝后滴入滤纸套筒1中,再经导管返回烧瓶,从而实现连续萃取。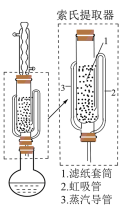
步骤1:取m g产品(杂质不参加反应)溶于
 溶液后配成
溶液后配成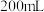 溶液,取
溶液,取 置于碘量瓶中,加入
置于碘量瓶中,加入 的
的 溶液充分反应。(
溶液充分反应。( )
)步骤2:向步骤1反应后溶液中加入过量的KI溶液,用稀硫酸调节pH,使过量
 转化为
转化为 ,冷却后于暗处放数分钟。
,冷却后于暗处放数分钟。步骤3:将步骤2所得混合液调pH约为5.0,加入几滴淀粉,用
 标准溶液滴定至终点,消耗溶液
标准溶液滴定至终点,消耗溶液 。(
。( )
)回答下列问题:
(1)仪器a的名称是
(2)写出
 与
与 反应的化学方程式
反应的化学方程式(3)下列有关说法不正确的是__________。
A. 和 和 中氢化合价相同 中氢化合价相同 | B.装置甲应该处于无水、无氧的反应环境 |
| C.装置乙中异丙胺蒸汽沿导管2上升 | D.萃取完全后, 在圆底烧瓶中 在圆底烧瓶中 |
(4)按照先后顺序对本实验的滴定操作排序
检查是否漏水→蒸馏水洗涤→
a.加液至“0”刻度以上
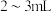 处
处b.调整液面至“0”刻度或“0”刻度下方,记录读数

c.倾斜转动滴定管,使标准液润湿滴定管内壁,将润洗液从下口排出
d.赶出尖嘴部分气泡
e.向碱式滴定管中加
 标准液
标准液f.向酸式滴定管中加
 标准液
标准液g.左手控制活塞(或挤压玻璃珠),右手振荡锥形瓶
h.左手振荡锥形瓶,右手控制活塞(或挤压玻璃珠)
(5)产品中
 的纯度为
的纯度为
您最近一年使用:0次
9 .  易溶于水,溶解度随着温度降低明显减小,能溶于乙醇、丙酮等有机溶剂,可作为替代氟利昂的绿色制冷剂。合成
易溶于水,溶解度随着温度降低明显减小,能溶于乙醇、丙酮等有机溶剂,可作为替代氟利昂的绿色制冷剂。合成 工艺流程如下:
工艺流程如下:
 易溶于水,溶解度随着温度降低明显减小,能溶于乙醇、丙酮等有机溶剂,可作为替代氟利昂的绿色制冷剂。合成
易溶于水,溶解度随着温度降低明显减小,能溶于乙醇、丙酮等有机溶剂,可作为替代氟利昂的绿色制冷剂。合成 工艺流程如下:
工艺流程如下:
A.还原工序逸出的 可用 可用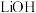 溶液吸收,吸收液直接返回还原工序 溶液吸收,吸收液直接返回还原工序 |
| B.除杂得到的滤渣中加煤油或水都可以进行组分分离 |
C.中和工序中的离子方程式为: |
| D.结晶时,可向溶液中加入丙酮以促使产品析出 |
您最近一年使用:0次
10 . 某化学小组模拟工业生产原理:以废铁屑(含少量 、Mn、C等杂质)为原料生产配合物乙二胺四乙酸铁钠(EDTA铁钠盐),并测定所制取的样品中铁元素的含量。
、Mn、C等杂质)为原料生产配合物乙二胺四乙酸铁钠(EDTA铁钠盐),并测定所制取的样品中铁元素的含量。
已知:①乙二胺四乙酸铁钠,易溶于水和稀酸,微溶于乙醇;该螯合型配合物稳定性好
②氢氧化铁沉淀通常呈胶体状态,有较强的吸附性
Ⅰ.制备乙二胺四乙酸铁钠晶体
实验原理:
实验流程:
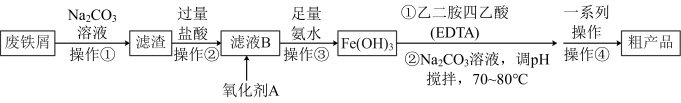
方案1:
(1)由 制乙二胺四乙酸铁钠可以选择
制乙二胺四乙酸铁钠可以选择_________ (填“酒精灯直接加热”或“水浴加热”)。
(2)氧化剂A可以选择 ,试写出该步反应的离子方程式
,试写出该步反应的离子方程式___________ 。
(3)下列说法正确的是___________ 。
A.为避免 沉淀中裹入过多杂质,可以采用一次性加入氨水
沉淀中裹入过多杂质,可以采用一次性加入氨水
B.该流程中两次用到 溶液,均可用
溶液,均可用 溶液代替
溶液代替
C.操作④洗涤时宜采用冷水洗涤
D.“一系列的操作”是指“蒸发浓缩,趁热过滤、洗涤、干燥”
E.乙二胺四乙酸铁钠溶液中滴入KSCN溶液不一定会显红色
方案2:用EDTA、 与
与 反应,制备乙二胺四乙酸铁钠,此法EDTA先被
反应,制备乙二胺四乙酸铁钠,此法EDTA先被 中和后再和
中和后再和 直接反应。两个方案都有不足之处,方案1的缺点:氢氧化铁沉淀成胶体状态,难以过滤和洗涤。
直接反应。两个方案都有不足之处,方案1的缺点:氢氧化铁沉淀成胶体状态,难以过滤和洗涤。
(4)为使沉淀颗粒增大,实验中往往可以采取___________ (填实验条件)。
(5)方案2的缺点:产品中含杂质多,纯度不好。方案2后剩余废液可用层柱法(利用筛网孔径与微粒孔径不同的一种分离方法)可得到反应的副产物___________ (填名称)。
Ⅱ.测定所制取样品中铁的含量(EDTA标准溶液滴定法)
取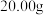 样品溶于水,然后将其中的铁元素用萃取剂从配合物中“反萃取”出来并配成
样品溶于水,然后将其中的铁元素用萃取剂从配合物中“反萃取”出来并配成 溶液,取出
溶液,取出 加入过量的
加入过量的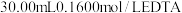 标准溶液并加热煮沸,充分反应后,再用
标准溶液并加热煮沸,充分反应后,再用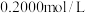 的
的 标准溶液滴定过量的EDTA至终点,消耗
标准溶液滴定过量的EDTA至终点,消耗 标准溶液体积为
标准溶液体积为 。
。
已知: 、
、 与EDTA反应的化学计量比均为
与EDTA反应的化学计量比均为 。
。
(6)实验室进行萃取操作时,需要打开分液漏斗活塞放气,正确的放气图示___________。
(7)计算铁元素的质量分数___________ 。
 、Mn、C等杂质)为原料生产配合物乙二胺四乙酸铁钠(EDTA铁钠盐),并测定所制取的样品中铁元素的含量。
、Mn、C等杂质)为原料生产配合物乙二胺四乙酸铁钠(EDTA铁钠盐),并测定所制取的样品中铁元素的含量。已知:①乙二胺四乙酸铁钠,易溶于水和稀酸,微溶于乙醇;该螯合型配合物稳定性好
②氢氧化铁沉淀通常呈胶体状态,有较强的吸附性
Ⅰ.制备乙二胺四乙酸铁钠晶体
实验原理:

实验流程:
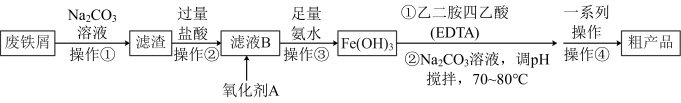
方案1:
(1)由
 制乙二胺四乙酸铁钠可以选择
制乙二胺四乙酸铁钠可以选择(2)氧化剂A可以选择
 ,试写出该步反应的离子方程式
,试写出该步反应的离子方程式(3)下列说法正确的是
A.为避免
 沉淀中裹入过多杂质,可以采用一次性加入氨水
沉淀中裹入过多杂质,可以采用一次性加入氨水B.该流程中两次用到
 溶液,均可用
溶液,均可用 溶液代替
溶液代替C.操作④洗涤时宜采用冷水洗涤
D.“一系列的操作”是指“蒸发浓缩,趁热过滤、洗涤、干燥”
E.乙二胺四乙酸铁钠溶液中滴入KSCN溶液不一定会显红色
方案2:用EDTA、
 与
与 反应,制备乙二胺四乙酸铁钠,此法EDTA先被
反应,制备乙二胺四乙酸铁钠,此法EDTA先被 中和后再和
中和后再和 直接反应。两个方案都有不足之处,方案1的缺点:氢氧化铁沉淀成胶体状态,难以过滤和洗涤。
直接反应。两个方案都有不足之处,方案1的缺点:氢氧化铁沉淀成胶体状态,难以过滤和洗涤。(4)为使沉淀颗粒增大,实验中往往可以采取
(5)方案2的缺点:产品中含杂质多,纯度不好。方案2后剩余废液可用层柱法(利用筛网孔径与微粒孔径不同的一种分离方法)可得到反应的副产物
Ⅱ.测定所制取样品中铁的含量(EDTA标准溶液滴定法)
取
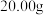 样品溶于水,然后将其中的铁元素用萃取剂从配合物中“反萃取”出来并配成
样品溶于水,然后将其中的铁元素用萃取剂从配合物中“反萃取”出来并配成 溶液,取出
溶液,取出 加入过量的
加入过量的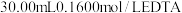 标准溶液并加热煮沸,充分反应后,再用
标准溶液并加热煮沸,充分反应后,再用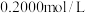 的
的 标准溶液滴定过量的EDTA至终点,消耗
标准溶液滴定过量的EDTA至终点,消耗 标准溶液体积为
标准溶液体积为 。
。已知:
 、
、 与EDTA反应的化学计量比均为
与EDTA反应的化学计量比均为 。
。(6)实验室进行萃取操作时,需要打开分液漏斗活塞放气,正确的放气图示___________。
A. | B. | C.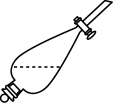 | D. |
(7)计算铁元素的质量分数
您最近一年使用:0次



