解题方法
1 . 以盐湖锂矿(主要成分为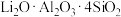 ,还含有
,还含有 及少量有机物等)为原料制备
及少量有机物等)为原料制备 的方法如下:
的方法如下:
(1)酸化:将适量盐湖锂矿粉与水混合,加入一定量浓 ,充分反应后加水稀释,过滤。酸化过程会产生少量
,充分反应后加水稀释,过滤。酸化过程会产生少量 ,原因是
,原因是___________ 。
(2)净化:
①加碱调节滤液的 至弱碱性,使
至弱碱性,使 沉淀;将再加入适量
沉淀;将再加入适量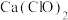 溶液将
溶液将 转化为沉淀,过滤。
转化为沉淀,过滤。 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
②调节滤液的 ,再加入适量
,再加入适量 粉末,过滤,得
粉末,过滤,得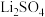 溶液。过滤所得滤渣的主要成分是
溶液。过滤所得滤渣的主要成分是___________ 。
(3)沉锂:80℃时将饱和 溶液与饱和
溶液与饱和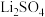 溶液混合充分反应,过滤,得
溶液混合充分反应,过滤,得 晶体。“沉锂”时选择较高温度,所得
晶体。“沉锂”时选择较高温度,所得 的产率及纯度较高。原因是
的产率及纯度较高。原因是___________ 。
已知 三种物质在不同温度下的溶解度如下表:
三种物质在不同温度下的溶解度如下表:
(4) 样品纯度测定:称取
样品纯度测定:称取 样品置于锥形瓶中,加入
样品置于锥形瓶中,加入 盐酸,搅拌,充分反应(杂质不与酸反应)。再加入几滴酚酞,用
盐酸,搅拌,充分反应(杂质不与酸反应)。再加入几滴酚酞,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的体积为
溶液的体积为 。计算
。计算 样品的纯度
样品的纯度___________ (写出计算过程)。
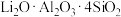 ,还含有
,还含有 及少量有机物等)为原料制备
及少量有机物等)为原料制备 的方法如下:
的方法如下:(1)酸化:将适量盐湖锂矿粉与水混合,加入一定量浓
 ,充分反应后加水稀释,过滤。酸化过程会产生少量
,充分反应后加水稀释,过滤。酸化过程会产生少量 ,原因是
,原因是(2)净化:
①加碱调节滤液的
 至弱碱性,使
至弱碱性,使 沉淀;将再加入适量
沉淀;将再加入适量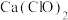 溶液将
溶液将 转化为沉淀,过滤。
转化为沉淀,过滤。 与
与 反应的离子方程式为
反应的离子方程式为②调节滤液的
 ,再加入适量
,再加入适量 粉末,过滤,得
粉末,过滤,得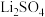 溶液。过滤所得滤渣的主要成分是
溶液。过滤所得滤渣的主要成分是(3)沉锂:80℃时将饱和
 溶液与饱和
溶液与饱和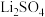 溶液混合充分反应,过滤,得
溶液混合充分反应,过滤,得 晶体。“沉锂”时选择较高温度,所得
晶体。“沉锂”时选择较高温度,所得 的产率及纯度较高。原因是
的产率及纯度较高。原因是已知
 三种物质在不同温度下的溶解度如下表:
三种物质在不同温度下的溶解度如下表:温度/℃ 物质 | 0 | 20 | 40 | 60 | 80 |
 | 7.0 | 21.5 | 49.0 | 46.0 | 43.9 |
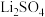 | 36.1 | 34.8 | 33.7 | 32.6 | 31.4 |
 | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 |
 样品纯度测定:称取
样品纯度测定:称取 样品置于锥形瓶中,加入
样品置于锥形瓶中,加入 盐酸,搅拌,充分反应(杂质不与酸反应)。再加入几滴酚酞,用
盐酸,搅拌,充分反应(杂质不与酸反应)。再加入几滴酚酞,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液的体积为
溶液的体积为 。计算
。计算 样品的纯度
样品的纯度
您最近一年使用:0次
名校
2 . 二硫化钼(MoS2,难溶于水)具有良好的光、电性能,可由钼精矿(主要含MoS2,还含NiS、CaMoO4等)为原料经过如下过程制得。
(1)“浸取”。向钼精矿中加入NaOH溶液,再加入NaClO溶液,充分反应后的溶液中含有Na2MoO4、Na2SO4、NiSO4、NaCl。
①写出浸取时MoS2发生反应的离子方程式:_______ 。
②浸取后的滤渣中含CaMoO4。若浸取时向溶液中加入Na2CO3溶液,可提高浸出液中Mo元素的含量,原因是_______ 。
③浸取时,Mo元素的浸出率与时间的变化如图1所示。已知生成物对反应无影响,则反应3~4min时,Mo元素的浸出率迅速上升的原因是_______ 。

(2)“制硫代钼酸铵[(NH4)2MoS4,摩尔质量260g•mol-1]”。向浸出液中加入NH4NO3和HNO3,析出(NH4)2Mo4O13,将(NH4)2Mo4O13溶于水,向其中加入(NH4)2S溶液,可得(NH4)2MoS4,写出生成(NH4)2MoS4反应的化学方程式:________ 。
(3)“制MoS2”。(NH4)2MoS4可通过如下两种方法制取MoS2:
方法一:将(NH4)2MoS4在一定条件下加热,可分解得到MoS2、NH3、H2S和硫单质。其中NH3、H2S和硫单质的物质的量之比为8:4:1。
方法二:将(NH4)2MoS4在空气中加热可得MoS2,加热时所得剩余固体的质量与原始固体质量的比值与温度的关系如图2所示。
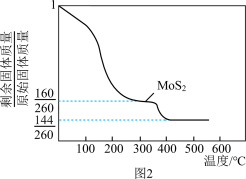
①方法一中,所得硫单质的分子式为_______ 。
②方法二中,500℃可得到Mo的一种氧化物,该氧化物的化学式为_______ 。
(1)“浸取”。向钼精矿中加入NaOH溶液,再加入NaClO溶液,充分反应后的溶液中含有Na2MoO4、Na2SO4、NiSO4、NaCl。
①写出浸取时MoS2发生反应的离子方程式:
②浸取后的滤渣中含CaMoO4。若浸取时向溶液中加入Na2CO3溶液,可提高浸出液中Mo元素的含量,原因是
③浸取时,Mo元素的浸出率与时间的变化如图1所示。已知生成物对反应无影响,则反应3~4min时,Mo元素的浸出率迅速上升的原因是

(2)“制硫代钼酸铵[(NH4)2MoS4,摩尔质量260g•mol-1]”。向浸出液中加入NH4NO3和HNO3,析出(NH4)2Mo4O13,将(NH4)2Mo4O13溶于水,向其中加入(NH4)2S溶液,可得(NH4)2MoS4,写出生成(NH4)2MoS4反应的化学方程式:
(3)“制MoS2”。(NH4)2MoS4可通过如下两种方法制取MoS2:
方法一:将(NH4)2MoS4在一定条件下加热,可分解得到MoS2、NH3、H2S和硫单质。其中NH3、H2S和硫单质的物质的量之比为8:4:1。
方法二:将(NH4)2MoS4在空气中加热可得MoS2,加热时所得剩余固体的质量与原始固体质量的比值与温度的关系如图2所示。

①方法一中,所得硫单质的分子式为
②方法二中,500℃可得到Mo的一种氧化物,该氧化物的化学式为
您最近一年使用:0次
2023-05-29更新
|
500次组卷
|
3卷引用:江苏省常州高级中学2023-2024学年高三上学期开学考试化学试题
名校
3 . 海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了如下图所示实验:
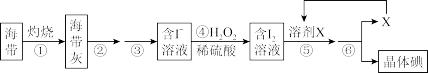
请回答下列问题:
(1)实验时灼烧海带应在___________ (填仪器名称)内进行。
(2)步骤④中反应的离子方程式是___________ 。
(3)步骤⑤中应选用的一种溶剂X可以是___________ (填试剂名称)。
(4)步骤⑥的操作名称是___________ 。
(5)上述流程中的实验操作包括下图中的___________(按操作顺序选填代号)。
请回答下列问题:
(1)实验时灼烧海带应在
(2)步骤④中反应的离子方程式是
(3)步骤⑤中应选用的一种溶剂X可以是
(4)步骤⑥的操作名称是
(5)上述流程中的实验操作包括下图中的___________(按操作顺序选填代号)。
A. | B. | C. | D. |
您最近一年使用:0次
4 . 海洋是一个巨大的宝藏,海水淡化是重要的化学研究课题。
(1)蒸馏法获取淡水,历史悠久,操作简单,图中符合模拟蒸馏海水的装置是___ (填序号)。
a.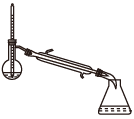 b.
b.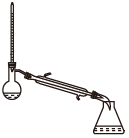
c.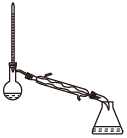 d.
d.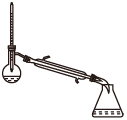
蒸馏前,应向烧瓶中加入沸石或碎瓷片,目的是___ ,冷凝水一般不采用“上进下出”,其原因是____ 。
(2)电渗析法的技术原理如图(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过):
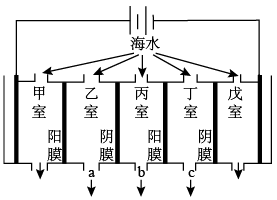
某地海水中主要含Na+、K+、Ca2+、Mg2+、Cl-、HCO 、SO
、SO 等,则淡化过程中,甲室的电极反应式为
等,则淡化过程中,甲室的电极反应式为___ ,产生水垢最多的是___ 室,淡水的出口为____ (填“a”、“b”或“c”)。
(3)离子交换法获取淡水模拟图如图:

经过阳离子交换树脂后水中阳离子数目____ (填“增加”“不变”或“减少”),阴离子交换树脂中发生了离子反应,其离子方程式为___ 。
(1)蒸馏法获取淡水,历史悠久,操作简单,图中符合模拟蒸馏海水的装置是
a.
 b.
b.
c.
 d.
d.
蒸馏前,应向烧瓶中加入沸石或碎瓷片,目的是
(2)电渗析法的技术原理如图(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过):

某地海水中主要含Na+、K+、Ca2+、Mg2+、Cl-、HCO
 、SO
、SO 等,则淡化过程中,甲室的电极反应式为
等,则淡化过程中,甲室的电极反应式为(3)离子交换法获取淡水模拟图如图:

经过阳离子交换树脂后水中阳离子数目
您最近一年使用:0次
2021-09-06更新
|
1253次组卷
|
5卷引用:安徽省A10联盟2022届高三上学期摸底考试化学试题
安徽省A10联盟2022届高三上学期摸底考试化学试题(已下线)专题35 物质的检验、分离和提纯(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练(已下线)3.3.1 粗盐提纯 从海水中提取溴-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)(已下线)第八章 化学与可持续发展(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第八章 化学与可持续发展【单元测试B卷】
解题方法
5 . 按要求填空
(1)向CuCl2溶液中滴加NaOH溶液,现象:_________ ,离子方程式:_____ ,
(2)向NaHCO3溶液中滴加稀硫酸,现象:_____ ,离子方程式:_______ ;
(3)铜粉(铁粉):除杂,括号内为杂质,所加试剂_____ ,离子方程式;_____ 。
(4)FeSO4 (CuSO4):除杂,括号内为杂质,所加试剂________ ,离子方程式__________ 。
(1)向CuCl2溶液中滴加NaOH溶液,现象:
(2)向NaHCO3溶液中滴加稀硫酸,现象:
(3)铜粉(铁粉):除杂,括号内为杂质,所加试剂
(4)FeSO4 (CuSO4):除杂,括号内为杂质,所加试剂
您最近一年使用:0次
2021-01-09更新
|
1981次组卷
|
5卷引用:湖南省岳阳市岳阳县2021-2022学年高三上学期入学考试化学试题
解题方法
6 . I.除去括号中的杂质(填试剂)
(1)CuCl2溶液(FeCl3)_________________________ ;
(2)Fe2(SO4) 3溶液( FeSO4)_______________________ ;
(3)NaHCO3溶液(Na2CO3)___________________ ;
(4)CO2(HCl)_________________________ ;
Ⅱ写出下列反应的离子方程式
(5)二氧化硫使溴水褪色的原理_________________________________ ;
(6)将NaHCO3溶液与澄清石灰水等物质的量混合_________________________________ ;
(7)向NaAlO2溶液中通入过量CO2气体__________________________________________ ;
(8)FeBr2溶液和等物质的量的Cl2反应_________________________________________ 。
(1)CuCl2溶液(FeCl3)
(2)Fe2(SO4) 3溶液( FeSO4)
(3)NaHCO3溶液(Na2CO3)
(4)CO2(HCl)
Ⅱ写出下列反应的离子方程式
(5)二氧化硫使溴水褪色的原理
(6)将NaHCO3溶液与澄清石灰水等物质的量混合
(7)向NaAlO2溶液中通入过量CO2气体
(8)FeBr2溶液和等物质的量的Cl2反应
您最近一年使用:0次
7 . 海水是一种丰富的资源,工业上可从海水中提取多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。

回答下列问题:
(1)流程图中操作a的名称为________ 。(填序号)
A、蒸发结晶 B、降温结晶
(2)生产生石灰的方程式__________________________ 。从离子反应的角度思考,往海水中加入石灰乳的作用是____________________ 。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是_____________ 。
②操作b是在________ 氛围中进行,若在空气中加热,则会生成Mg(OH)2,
写出有关反应的化学方程式:________________________________________ 。
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为__________ ,从考虑成本和废物循环利用的角度,副产物氯气可以用于_______________ 。

回答下列问题:
(1)流程图中操作a的名称为
A、蒸发结晶 B、降温结晶
(2)生产生石灰的方程式
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是
②操作b是在
写出有关反应的化学方程式:
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为
您最近一年使用:0次
2019-01-19更新
|
465次组卷
|
2卷引用:河南省南阳市内乡县菊潭高级中学2022届高三入学考试化学试题
名校
8 . 工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe均为中等活泼金属)的工艺流程如图所示:
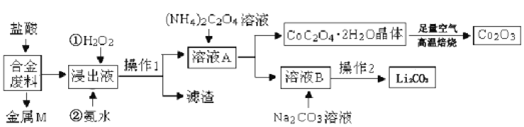
问答下列问题:
(l)(NH4)2C2O4中C元素的化合价为________ 。
(2)合金废料加入盐酸浸取,该盐酸不能换为硝酸,原因是____________ 。
残渣M的主要成分是一种金属单质,该金属为_______________ ,
(3)“浸出液”中先后加入的两种试剂涉及氨水、H2O2溶液,应先加入____________ ,加入氨水发生反应的离+方程式为____________________ 。
(4)溶液A中的金属阳离子是_________ ,加入(NH4)2C2O4溶液的目的是__________ 。
(5)“操作1”的名称是_________ ,草酸钴高温焙烧生成Co2O3,实验室中高温焙烧使用的仪器是_____ (填字)。
a.蒸发皿b.表面皿c.烧杯d.坩埚
(6)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。“操作2”中,蒸发浓缩后必须趁热过滤,其目的是_________________ ,90℃时Ksp(Li2CO3)的值为___________ 。

问答下列问题:
(l)(NH4)2C2O4中C元素的化合价为
(2)合金废料加入盐酸浸取,该盐酸不能换为硝酸,原因是
残渣M的主要成分是一种金属单质,该金属为
(3)“浸出液”中先后加入的两种试剂涉及氨水、H2O2溶液,应先加入
(4)溶液A中的金属阳离子是
(5)“操作1”的名称是
a.蒸发皿b.表面皿c.烧杯d.坩埚
(6)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。“操作2”中,蒸发浓缩后必须趁热过滤,其目的是
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol·L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
您最近一年使用:0次
2017-09-25更新
|
449次组卷
|
4卷引用:江西省井冈山市宁冈中学2021-2022学年高三下学期开学考试化学试题
名校
9 . 食盐是人类生活中不可缺少的物质,海水中含有大量食盐。某地出产的粗盐中,所含杂质是CaCl2,通过下面的实验可制得纯净的NaCl。
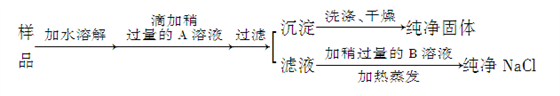
请回答:
(1)加入的A是__________ ,检验A已过量的方法是___________ 。
(2)加入的B是__________ ,加入稍过量B的目的是__________ 。
(3)为检验沉淀是否洗净,最好在最后几滴洗出液中加入_________________ 溶液。

请回答:
(1)加入的A是
(2)加入的B是
(3)为检验沉淀是否洗净,最好在最后几滴洗出液中加入
您最近一年使用:0次
2017-09-13更新
|
853次组卷
|
7卷引用:河南省周口市中英文学校2018届高三上学期开学摸底考试化学试题
河南省周口市中英文学校2018届高三上学期开学摸底考试化学试题江西省南昌市第十中学2019-2020学年高一上学期期中考试化学试题吉林省公主岭市范家屯镇第一中学2019-2020学年高一上学期期末考试化学试题人教版2019必修第二册 第五章 第一节 第2课时 硫酸 硫酸根离子的检验山西省晋中市寿阳县第一中学2019—2020学年高一上学期第二次月考化学试题内蒙古包头市一机一中2021-2022学年高一上学期10月月考化学试题(已下线)第03讲 硫酸根离子的检验 含硫物质的转化(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)
名校
10 . 平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某小组以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4。

已知:CeO2不溶于强酸或强碱;Ce3+易水解,酸性条件下,Ce4+有强氧化性。
(1)滤液A的主要成分________ (填写化学式),滤液B中所含金属阳离子为_________ 。
(2)反应①的离子方程武是_________________________________ 。
(3)反应①之前要洗涤滤渣B,对滤渣B进行洗涤的实验操作方法是__________________ 。
(4)反应②的化学反应方程式是____________________________ 。
(5)用滴定法测定制得的Ce(OH)4产品纯度。

若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数________ 。(填“偏大”、“偏小”或“无影响”)

已知:CeO2不溶于强酸或强碱;Ce3+易水解,酸性条件下,Ce4+有强氧化性。
(1)滤液A的主要成分
(2)反应①的离子方程武是
(3)反应①之前要洗涤滤渣B,对滤渣B进行洗涤的实验操作方法是
(4)反应②的化学反应方程式是
(5)用滴定法测定制得的Ce(OH)4产品纯度。

若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数
您最近一年使用:0次



