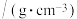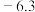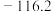2024·福建·模拟预测
解题方法
1 . 双氰胺( )为白色晶体,在冷水中溶解度较小,溶于热水、乙醇,其水溶液在80℃以上会发生分解等副反应,主要用于生产树脂、涂料、含氮复合肥等。实验室以石灰氮
)为白色晶体,在冷水中溶解度较小,溶于热水、乙醇,其水溶液在80℃以上会发生分解等副反应,主要用于生产树脂、涂料、含氮复合肥等。实验室以石灰氮 为原料制备双氰胺的流程如下:
为原料制备双氰胺的流程如下:


(1)已知:氰基是吸电子基团。氰氨
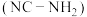 的碱性
的碱性(2)写出步骤Ⅰ的化学反应方程式:
(3)步骤Ⅱ中调节溶液pH为9.1,pH不能过低的原因:
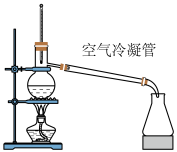
(4)步骤Ⅲ中蒸发浓缩时,常采用真空蒸发浓缩,目的是
(5)凯氏定氮法是测定有机物中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐。
已知:
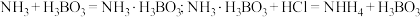

②仪器清洗后,g中加入硼酸
 和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭
和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭 ,d中保留少量水。打开
,d中保留少量水。打开 ,加热b,使水蒸气进入e。d中保留少量水的目的是
,加热b,使水蒸气进入e。d中保留少量水的目的是③取双氰胺样品m克进行测定,滴定g中吸收液时消耗浓度为
 的盐酸VmL,则样品中氮的质量分数为
的盐酸VmL,则样品中氮的质量分数为
您最近半年使用:0次
名校
解题方法
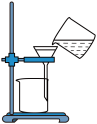
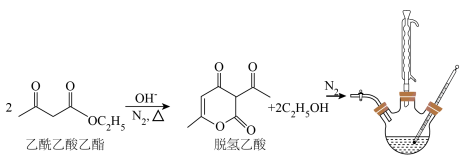
2 . 脱氢乙酸是一种重要的有机合成中间体和低毒高效食品防腐剂,实验室以乙酰乙酸乙酯为原料,在OH-的催化作用下制备脱氢乙酸的反应原理和实验装置如图(夹持和加热装置已省略):
Ⅰ.脱氢乙酸的合成
①在N2氛围中,向三颈烧瓶中加入100 mL乙酰乙酸乙酯和0.05 g催化剂,磁力搅拌加热10 min后再升高至某温度,回流一段时间。
②反应结束后,将其改为蒸馏装置,控制温度为80℃左右蒸出乙醇,在三颈烧瓶中得到脱氢乙酸粗产品。
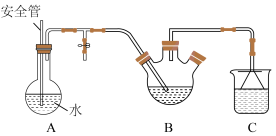
Ⅱ.脱氢乙酸的分离与提纯
将盛有脱氢乙酸粗产品的三颈烧瓶改为下图中的装置B,进行水蒸气蒸馏(夹持和加热装置已省略),蒸出乙酰乙酸乙酯和脱氢乙酸,过滤装置C中的混合物,得白色晶体,再用乙醇洗涤该晶体,干燥后得固体产品56.0 g。
(1)步骤Ⅰ中通入N2的目的是___________ 。
(2)步骤Ⅰ中②过程中不需要用到的仪器为___________ (填字母)。___________ ℃、___________ h、___________ 作催化剂。与其他催化剂相比,所选催化剂使脱氢乙酸产率最高的原因可能为___________ 。___________ ,漏斗的作用为___________ 。
(5)脱氢乙酸的产率约为___________(填字母)。
| 名称 | 相对分子质量 | 性状 | 密度/ | 熔点/℃ | 沸点/℃ | 物理性质 |
| 乙酰乙酸乙酯 | 130 | 无色透明液体 | 1.03 | -39 | 180.8 | 微溶于水,易溶于乙醇等有机溶剂 |
| 脱氢乙酸 | 168 | 白色晶体 | — | 109~111 | 269.9 | 微溶于乙醇和冷水,具有较强的还原性 |
| 乙醇 | 46 | 无色透明液体 | 0.79 | -114.1 | 78.3 | 与水任意比例互溶,易溶于有机溶剂 |
①在N2氛围中,向三颈烧瓶中加入100 mL乙酰乙酸乙酯和0.05 g催化剂,磁力搅拌加热10 min后再升高至某温度,回流一段时间。
②反应结束后,将其改为蒸馏装置,控制温度为80℃左右蒸出乙醇,在三颈烧瓶中得到脱氢乙酸粗产品。
Ⅱ.脱氢乙酸的分离与提纯
将盛有脱氢乙酸粗产品的三颈烧瓶改为下图中的装置B,进行水蒸气蒸馏(夹持和加热装置已省略),蒸出乙酰乙酸乙酯和脱氢乙酸,过滤装置C中的混合物,得白色晶体,再用乙醇洗涤该晶体,干燥后得固体产品56.0 g。
(1)步骤Ⅰ中通入N2的目的是
(2)步骤Ⅰ中②过程中不需要用到的仪器为


(5)脱氢乙酸的产率约为___________(填字母)。
| A.54% | B.64% | C.74% | D.84% |
您最近半年使用:0次
昨日更新
|
441次组卷
|
4卷引用:东北三省2024届高三下学期三校二模联考化学试题
东北三省2024届高三下学期三校二模联考化学试题黑龙江省哈尔滨市三校联考2024届高三二模化学试题东北三省2024届高三下学期三校二模联考化学试题(已下线)提升练08 化学实验综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
解题方法
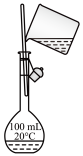
3 . 苯胺是重要的化工原料,某化学兴趣小组在实验室里制备苯胺并提纯苯胺。
有关物质的部分物理性质如表:
I.制备苯胺
将如下图所示装置(夹持装置略,下同)置于热水浴中回流 ,使硝基苯充分还原;冷却后,往三颈烧瓶中加入
,使硝基苯充分还原;冷却后,往三颈烧瓶中加入 溶液。
溶液。 的作用是
的作用是______ ,三颈烧瓶合适的容积是______ 。
a. b.
b. c.
c.
(2)使用水浴加热的优点是______ ,三颈烧瓶中反应生成 和易溶于水的盐酸苯胺(
和易溶于水的盐酸苯胺(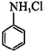 ),该反应的离子方程式为
),该反应的离子方程式为______ 。
(3)加入 的目的是
的目的是______ 。
II.提取苯胺
(4)实验步骤:
①向反应后混合物中通入热的水蒸气进行蒸馏,蒸馏时收集到苯胺与水的混合物;将此混合物分离得到粗苯胺和水溶液。
②向水溶液中加入适量乙醚萃取,然后分液得到乙醚萃取液。分液必须使用到的一种玻璃仪器名称是______ 。
③合并粗苯胺和乙醚萃取液,再加入______ 固体后再次蒸馏,得到纯苯胺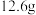 。
。
(5)该实验中苯胺的产率为______ (保留3位小数)。
有关物质的部分物理性质如表:
物质 | 熔点 | 沸点 | 溶解性 | 密度 | 相对分子质量 |
苯胺 |
| 184 | 微溶于水,易溶于乙醚 | 1.02 | 93 |
硝基苯 | 5.7 | 210.9 | 难溶于水,易溶于乙醚 | 1.23 | 123 |
乙醚 |
| 34.6 | 微溶于水 | 0.7134 |
将如下图所示装置(夹持装置略,下同)置于热水浴中回流
 ,使硝基苯充分还原;冷却后,往三颈烧瓶中加入
,使硝基苯充分还原;冷却后,往三颈烧瓶中加入 溶液。
溶液。
 的作用是
的作用是a.
 b.
b. c.
c.
(2)使用水浴加热的优点是
 和易溶于水的盐酸苯胺(
和易溶于水的盐酸苯胺( ),该反应的离子方程式为
),该反应的离子方程式为(3)加入
 的目的是
的目的是II.提取苯胺
(4)实验步骤:
①向反应后混合物中通入热的水蒸气进行蒸馏,蒸馏时收集到苯胺与水的混合物;将此混合物分离得到粗苯胺和水溶液。
②向水溶液中加入适量乙醚萃取,然后分液得到乙醚萃取液。分液必须使用到的一种玻璃仪器名称是
③合并粗苯胺和乙醚萃取液,再加入
 。
。(5)该实验中苯胺的产率为
您最近半年使用:0次
解题方法
4 . 下列实验装置能达到实验目的的是
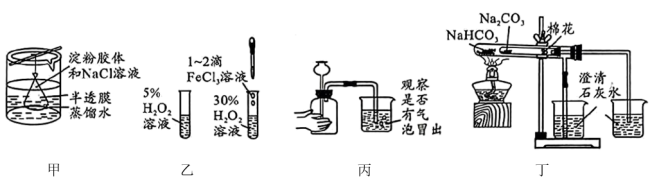
A.图甲装置可除去淀粉胶体中的 |
| B.图乙装置探究催化剂对化学反应速率的影响 |
| C.图丙装置检查装置的气密性 |
D.图丁装置可比较 和 和 的稳定性 的稳定性 |
您最近半年使用:0次
名校
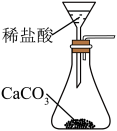
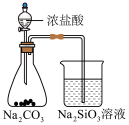
5 . 侯氏制碱法中制取 的原理为
的原理为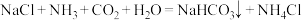 。下列实验装置合理、操作规范,能达到实验目的的是
。下列实验装置合理、操作规范,能达到实验目的的是
 的原理为
的原理为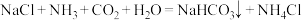 。下列实验装置合理、操作规范,能达到实验目的的是
。下列实验装置合理、操作规范,能达到实验目的的是| 选项 | A | B |
| 目的 | 制取 | 除去 中的 中的 |
| 操作 |
|
|
| 选项 | C | D |
| 目的 | 制备 | 分离出 |
| 操作 |
|
|
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
6 . 下列有关实验仪器与实验操作的叙述正确的是
| A.蒸馏完毕后,应先停止通冷凝水,再停止加热 |
| B.滴定接近终点时,滴定管尖嘴不能触碰锥形瓶内壁 |
| C.粗盐提纯过程中,需要用到的实验仪器有坩埚、漏斗、玻璃棒等 |
| D.用NaOH固体配制一定物质的量浓度溶液时,溶解后冷却至室温再转移到容量瓶中 |
您最近半年使用:0次
7 . 叠氮化钠(NaN3)在防腐、有机合成和汽车行业有着广泛的用途。用氨基钠(NaNH2)制取叠氮化钠的方程式为: 实验室用下列装置制取叠氮化钠。
实验室用下列装置制取叠氮化钠。
(1)仪器a的名称是_______ 。
(2)装置B、D的主要作用分别是_______ 。
(3)检查装置A的气密性的操作是_______ 。
(4)装置A中反应除生成装置C中需要的物质外,还生成SnCl4等。其反应的化学方程式为_______ 。
(5)装置C处充分反应后,应先停止加热,再关闭分液漏斗活塞,原因是_______ 。
(6)取mg反应后装置C中所得固体,用下图所示装置测定产品的纯度(原理为:加入ClO将N1氧化成N2,测定N2的体积,从而计算产品纯度)。_______ 。
②若G的初始读数为V1mL、末读数为V2mL,本实验条件下气体摩尔体积为VL·mol-1,则产品中NaN3的质量分数为_______ 。
 实验室用下列装置制取叠氮化钠。
实验室用下列装置制取叠氮化钠。
(1)仪器a的名称是
(2)装置B、D的主要作用分别是
(3)检查装置A的气密性的操作是
(4)装置A中反应除生成装置C中需要的物质外,还生成SnCl4等。其反应的化学方程式为
(5)装置C处充分反应后,应先停止加热,再关闭分液漏斗活塞,原因是
(6)取mg反应后装置C中所得固体,用下图所示装置测定产品的纯度(原理为:加入ClO将N1氧化成N2,测定N2的体积,从而计算产品纯度)。
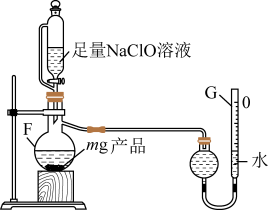
②若G的初始读数为V1mL、末读数为V2mL,本实验条件下气体摩尔体积为VL·mol-1,则产品中NaN3的质量分数为
您最近半年使用:0次
2024高三·全国·专题练习
解题方法
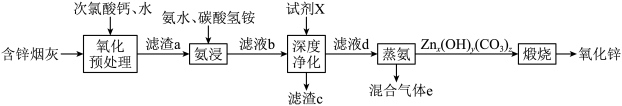
8 . 氧化锌在橡胶、油漆涂料、化工、医疗及食品等行业有着广泛应用。一种以含锌烟灰(含有ZnO、CuO、PbO、FeO、Fe2O3、MnO、MnO2、CdO等)为原料制备氧化锌的工艺流程如图所示:
②25℃时相关物质的Ksp如下表:
③ Zn(OH)2和ZnCO3的分解温度分别为125℃、300℃。
请回答下列问题:
(1)“氧化预处理”阶段得到的氧化产物有FeOOH、MnO2,写出生成FeOOH的离子方程式:___________ ;“氧化预处理”的目的是___________ 。
(2)若“氨浸”阶段溶解ZnO时消耗的n(NH3·H2O)∶n(NH4HCO3)=2∶1,写出该反应的离子方程式:___________ 。
(3)实验室模拟蒸氨装置如图所示。蒸氨时控制温度为95℃左右,在装置b中[Zn(NH3)4]2+转化为碱式碳酸锌沉淀。___________ (填字母)。
A.液面上方但不接触液面 B.略伸入液面下 C.伸入溶液底部
②在不改变水蒸气的温度、浸出液用量和蒸氨时间的条件下,为提高蒸氨效率和锌的沉淀率,可采取的措施是___________ (写出一种)。
③混合气体e可返回至“___________ ”阶段循环利用。
(4)研究发现Znx(OH)y(CO3)z热分解得到ZnO的过程可分为两步。
某实验小组取11.2 g Znx(OH)y(CO3)z固体进行热重分析,两步反应的固体失重率( ×100%)依次为8.0%、19.6%,则Znx(OH)y(CO3)z的化学式为
×100%)依次为8.0%、19.6%,则Znx(OH)y(CO3)z的化学式为___________ 。
②25℃时相关物质的Ksp如下表:
| 物质 | MnS | FeS | ZnS | PbS | CdS | CuS |
| Ksp | 2.5×10-13 | 6.3×10-18 | 1.6×10-24 | 8.0×10-28 | 3.6×10-29 | 5.0×10-36 |
请回答下列问题:
(1)“氧化预处理”阶段得到的氧化产物有FeOOH、MnO2,写出生成FeOOH的离子方程式:
(2)若“氨浸”阶段溶解ZnO时消耗的n(NH3·H2O)∶n(NH4HCO3)=2∶1,写出该反应的离子方程式:
(3)实验室模拟蒸氨装置如图所示。蒸氨时控制温度为95℃左右,在装置b中[Zn(NH3)4]2+转化为碱式碳酸锌沉淀。
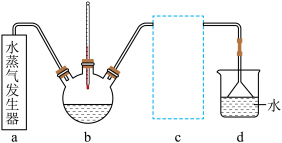
A.液面上方但不接触液面 B.略伸入液面下 C.伸入溶液底部
②在不改变水蒸气的温度、浸出液用量和蒸氨时间的条件下,为提高蒸氨效率和锌的沉淀率,可采取的措施是
③混合气体e可返回至“
(4)研究发现Znx(OH)y(CO3)z热分解得到ZnO的过程可分为两步。
某实验小组取11.2 g Znx(OH)y(CO3)z固体进行热重分析,两步反应的固体失重率(
 ×100%)依次为8.0%、19.6%,则Znx(OH)y(CO3)z的化学式为
×100%)依次为8.0%、19.6%,则Znx(OH)y(CO3)z的化学式为
您最近半年使用:0次
名校
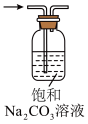
9 . 下列实验装置或操作能够达到实验目的的是
| A | B | C | D |
|
|
|
|
| 转移溶液 | 验证碳酸酸性强于硅酸 | 除去 中混有的少量HCl 中混有的少量HCl | 收集NO |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
昨日更新
|
542次组卷
|
4卷引用:广西壮族自治区柳州市2024届高三第三次模拟考试化学试题
广西壮族自治区柳州市2024届高三第三次模拟考试化学试题广西柳州市2024届高三下学期第三次模拟考试(三模)化学试题四川省内江市威远中学校2023-2024学年高一下学期期中考试化学试题(已下线)押题卷02(15+4题型) -2024高考化学考点必杀300题(新高考通用)
解题方法
10 . 实验室可用环己醇制备环己酮,反应原理和实验装置(部分夹持装置略)如图:
Ⅰ.制备:实验中通过恒压滴液漏斗将酸性 溶液加到盛有
溶液加到盛有 (
(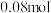 )环己醇的三颈烧瓶中,保持反应温度在55—65℃之间继续搅拌
)环己醇的三颈烧瓶中,保持反应温度在55—65℃之间继续搅拌 后,加入少量草酸,反应液变为墨绿色。
后,加入少量草酸,反应液变为墨绿色。
(1)仪器甲的名称是__________ 。
(2)为控制反应体系温度在55—65℃范围内,可采取的加热方式是__________ 。
(3)上述步骤中,加入草酸的目的是__________ 。
Ⅱ.分离提纯:环己酮的提纯需要经过以下操作: 固体至饱和,静置,分液;
固体至饱和,静置,分液;
b.水层用乙醚(乙醚沸点34.6℃)萃取,萃取液并入有机层;
c.有机层中加入无水 固体,除去少量的水,过滤;
固体,除去少量的水,过滤;
d.将滤液在50—55℃蒸馏除去乙醚:
e.再用如图所示装置蒸馏,收集151—156℃馏分。
(4)①操作b中水层用乙醚萃取的目的是__________ 。
②如果不经操作c,直接蒸馏不能分离环己酮和水的原因是__________ 。
(5)最终得到纯产品 ,则环己酮的产率为
,则环己酮的产率为__________ (计算结果精确到0.1%)。

物质 | 沸点/℃ | 密度 | 溶解性 | 相对分子质量 |
环己醇 | 161.1(97.8) | 0.96 | 能溶于水和醚 | 100 |
环己酮 | 155.6(95.0) | 0.95 | 微溶于水,能溶于醚 | 98 |
 溶液加到盛有
溶液加到盛有 (
(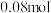 )环己醇的三颈烧瓶中,保持反应温度在55—65℃之间继续搅拌
)环己醇的三颈烧瓶中,保持反应温度在55—65℃之间继续搅拌 后,加入少量草酸,反应液变为墨绿色。
后,加入少量草酸,反应液变为墨绿色。(1)仪器甲的名称是
(2)为控制反应体系温度在55—65℃范围内,可采取的加热方式是
(3)上述步骤中,加入草酸的目的是
Ⅱ.分离提纯:环己酮的提纯需要经过以下操作:
 固体至饱和,静置,分液;
固体至饱和,静置,分液;b.水层用乙醚(乙醚沸点34.6℃)萃取,萃取液并入有机层;
c.有机层中加入无水
 固体,除去少量的水,过滤;
固体,除去少量的水,过滤;d.将滤液在50—55℃蒸馏除去乙醚:
e.再用如图所示装置蒸馏,收集151—156℃馏分。
(4)①操作b中水层用乙醚萃取的目的是
②如果不经操作c,直接蒸馏不能分离环己酮和水的原因是
(5)最终得到纯产品
 ,则环己酮的产率为
,则环己酮的产率为
您最近半年使用:0次