名校
解题方法
1 . 醋酸亚铬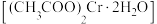 为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一股制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬:二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。某同学将过量锌粒和
为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一股制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬:二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。某同学将过量锌粒和 固体置于c中,加入少量蒸馏水,按下图连接好装置,下列说法
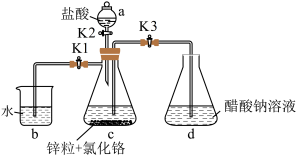
固体置于c中,加入少量蒸馏水,按下图连接好装置,下列说法错误 的是
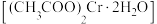 为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一股制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬:二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。某同学将过量锌粒和
为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一股制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬:二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。某同学将过量锌粒和 固体置于c中,加入少量蒸馏水,按下图连接好装置,下列说法
固体置于c中,加入少量蒸馏水,按下图连接好装置,下列说法
| A.实验中所用蒸馏水均需经煮沸后迅速冷却 |
B.实验开始时,应先打开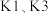 ,再打开 ,再打开 |
| C.d装置中析出砖红色沉淀后,应用冰水冷却后再过滤 |
| D.该同学的制备方法并不能保证得到纯净的醋酸亚铬 |
您最近一年使用:0次
2023-10-13更新
|
905次组卷
|
5卷引用:广东省广州市黄广中学2023-2024学年高一上学期化学竞赛选拔考试
2 . Ⅰ.氧化铁是重要工业颜料,用废铁屑制备氧化铁的流程如图:
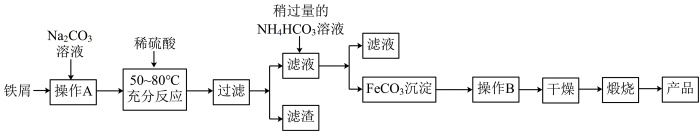
回答下列问题:
(1)检验“操作B”是否彻底的操作为_______ 。
(2)写出加入稍过量的NH4HCO3溶液得到FeCO3的离子方程式:_______ 。
(3)写出在空气中充分加热煅烧FeCO3的化学方程式:_______ 。
Ⅱ.上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中Fe2O3的含量,进行如下实验:
a.称取样品8.00 g,加入足量稀H2SO4溶解,并加水稀释至100 mL;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用酸化的0. 010 00 mol·L-1KMnO4标准液滴定至终点;
d.重复操作b、c 2~3次,得出消耗KMnO4溶液体积的平均值为20.00 mL。
(4)确定滴定达到终点的操作及现象为_______ 。
(5)上述样品的质量分数为_______ 。
(6)下列操作会导致样品中Fe2O3的质量分数测定结果偏低的有_______(填字母) 。

回答下列问题:
(1)检验“操作B”是否彻底的操作为
(2)写出加入稍过量的NH4HCO3溶液得到FeCO3的离子方程式:
(3)写出在空气中充分加热煅烧FeCO3的化学方程式:
Ⅱ.上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中Fe2O3的含量,进行如下实验:
a.称取样品8.00 g,加入足量稀H2SO4溶解,并加水稀释至100 mL;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用酸化的0. 010 00 mol·L-1KMnO4标准液滴定至终点;
d.重复操作b、c 2~3次,得出消耗KMnO4溶液体积的平均值为20.00 mL。
(4)确定滴定达到终点的操作及现象为
(5)上述样品的质量分数为
(6)下列操作会导致样品中Fe2O3的质量分数测定结果偏低的有_______(填字母) 。
| A.未干燥锥形瓶 |
| B.盛装标准液的滴定管没有用标准液润洗 |
| C.滴定开始时平视刻度线读数,滴定结束时仰视刻度线读数 |
| D.量取待测液的滴定管没有润洗 |
您最近一年使用:0次
3 . 某实验室对煤矸石的综合利用课题展开如下探究:
[资料检索]①煤矸石主要含Al2O3、SiO2及Fe2O3②聚合氯化铝([Al2(OH)nCl6-n]m(1≤n≤5,m≤10),商业代号PAC)是一种新型、高效絮凝剂和净水剂。
[探究思路]用煤矸石为原料,采用铝盐水解絮凝法,可制得聚合氯化铝。
[探究实验]
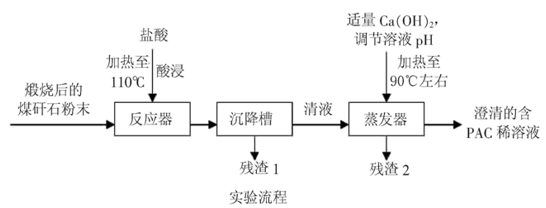
[交流讨论]
(1)用浓盐酸配20%的盐酸所需的玻璃仪器有___ 。
(2)加20%的盐酸酸浸,有关的离子方程式为___ 。
(3)残渣2的主要成分是___ ,设计实验证明你的结论(填“操作”、“现象”):___ 。
(4)从澄清的PAC稀溶液获得聚合氯化铝固体,该实验操作是___ ,得到PAC粗产品中可能含有杂质离子是___ 。
(5)从不引入杂质去考虑,调节溶液的pH可改为___ (填序号)。
[资料检索]①煤矸石主要含Al2O3、SiO2及Fe2O3②聚合氯化铝([Al2(OH)nCl6-n]m(1≤n≤5,m≤10),商业代号PAC)是一种新型、高效絮凝剂和净水剂。
[探究思路]用煤矸石为原料,采用铝盐水解絮凝法,可制得聚合氯化铝。
[探究实验]

[交流讨论]
(1)用浓盐酸配20%的盐酸所需的玻璃仪器有
(2)加20%的盐酸酸浸,有关的离子方程式为
(3)残渣2的主要成分是
(4)从澄清的PAC稀溶液获得聚合氯化铝固体,该实验操作是
(5)从不引入杂质去考虑,调节溶液的pH可改为
| A.NaOH | B.Al | C.氨水 | D.Al2O3 |
您最近一年使用:0次
解题方法
4 . 钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2等]。某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如图:
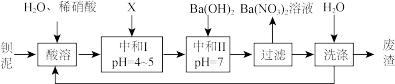
(1)酸溶后溶液的pH=1,Ba(FeO2)2与HNO3反应的化学方程式为___ 。
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是___ ;___ 。
(3)该厂结合本厂实际,选用的X为__ (填化学式);中和I使溶液中___ 离子符号)的浓度减小(中和I引起的溶液体积变化可忽略)。
(4)上述流程中洗涤的目的是___ 。
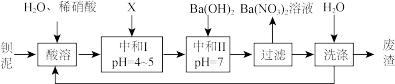
(1)酸溶后溶液的pH=1,Ba(FeO2)2与HNO3反应的化学方程式为
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是
(3)该厂结合本厂实际,选用的X为
(4)上述流程中洗涤的目的是
您最近一年使用:0次
解题方法
5 . 钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、CaO和SiO2等杂质)来制备,其工艺流程如下:

请回答下列问题:
(1)已知FeTiO3与盐酸反应后有TiOCl 生成, 写出该反应的离子方程式
生成, 写出该反应的离子方程式______ 。
(2)流程中的“氧化剂”最好选用什么试剂?为什么______ ?
(3)写出由FePO4制备LiFePO4的化学反应方程式______ 。
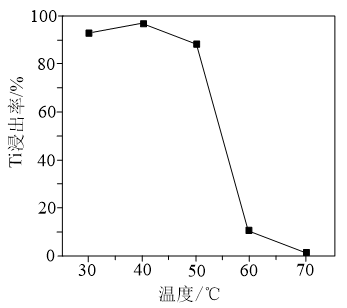
(4)用双氧水和氨水溶解TiO2固体时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti 元素浸出率下降,为什么______ ?
(5)过氧化钛酸锂Li2Ti5O15为一种配合物,请分析说明其中的过氧键(O- O)数目有多少_____ 个。
(6)“浸出”步骤中,温度对铁、钛的浸出效果如下图所示:
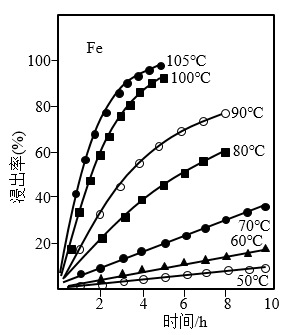

总结温度的影响规律:温度对铁和钛浸出效果的影响相似。请另写出两条规律_____ 。
(7) 25 °C 下,已知FePO4、Ca3(PO4)2与Mg3(PO4)2的标准溶度积常数K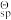 (简称为溶度积常数,简写为Ksp)分别为9.9 ×10-29、 2.0 ×10-33、 9.9 ×10-25, H3PO4的三级标准电离常数K
(简称为溶度积常数,简写为Ksp)分别为9.9 ×10-29、 2.0 ×10-33、 9.9 ×10-25, H3PO4的三级标准电离常数K (简称为电离常数,简写为Kai) 依次为7.1 ×10-3、 6.3 ×10-8、 4.2 ×10-13.若第二次过滤后所得滤液中Fe2+、Ca2+与Mg2+浓度分别为1.0、 0.02、 0.01 mol/L。试问,加入氧化剂和磷酸后(假设此时溶液中H+与H3PO4浓度均为1.0 mol/L),是否有Ca3(PO4)2与Mg3(PO4)2沉淀生成
(简称为电离常数,简写为Kai) 依次为7.1 ×10-3、 6.3 ×10-8、 4.2 ×10-13.若第二次过滤后所得滤液中Fe2+、Ca2+与Mg2+浓度分别为1.0、 0.02、 0.01 mol/L。试问,加入氧化剂和磷酸后(假设此时溶液中H+与H3PO4浓度均为1.0 mol/L),是否有Ca3(PO4)2与Mg3(PO4)2沉淀生成_____ ?
(8)若采用钛酸锂和磷酸亚铁锂作电极组成电池,充电时发生反应为:Li4Ti5O12 + LiFePO4 = Li4+xTi5O12 +Li 1-xFePO4 (0<x<1),请写出该电池放电时的阳极反应方程式_____ 。

请回答下列问题:
(1)已知FeTiO3与盐酸反应后有TiOCl
 生成, 写出该反应的离子方程式
生成, 写出该反应的离子方程式(2)流程中的“氧化剂”最好选用什么试剂?为什么
(3)写出由FePO4制备LiFePO4的化学反应方程式
(4)用双氧水和氨水溶解TiO2固体时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti 元素浸出率下降,为什么

(5)过氧化钛酸锂Li2Ti5O15为一种配合物,请分析说明其中的过氧键(O- O)数目有多少
(6)“浸出”步骤中,温度对铁、钛的浸出效果如下图所示:


总结温度的影响规律:温度对铁和钛浸出效果的影响相似。请另写出两条规律
(7) 25 °C 下,已知FePO4、Ca3(PO4)2与Mg3(PO4)2的标准溶度积常数K
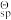 (简称为溶度积常数,简写为Ksp)分别为9.9 ×10-29、 2.0 ×10-33、 9.9 ×10-25, H3PO4的三级标准电离常数K
(简称为溶度积常数,简写为Ksp)分别为9.9 ×10-29、 2.0 ×10-33、 9.9 ×10-25, H3PO4的三级标准电离常数K (简称为电离常数,简写为Kai) 依次为7.1 ×10-3、 6.3 ×10-8、 4.2 ×10-13.若第二次过滤后所得滤液中Fe2+、Ca2+与Mg2+浓度分别为1.0、 0.02、 0.01 mol/L。试问,加入氧化剂和磷酸后(假设此时溶液中H+与H3PO4浓度均为1.0 mol/L),是否有Ca3(PO4)2与Mg3(PO4)2沉淀生成
(简称为电离常数,简写为Kai) 依次为7.1 ×10-3、 6.3 ×10-8、 4.2 ×10-13.若第二次过滤后所得滤液中Fe2+、Ca2+与Mg2+浓度分别为1.0、 0.02、 0.01 mol/L。试问,加入氧化剂和磷酸后(假设此时溶液中H+与H3PO4浓度均为1.0 mol/L),是否有Ca3(PO4)2与Mg3(PO4)2沉淀生成(8)若采用钛酸锂和磷酸亚铁锂作电极组成电池,充电时发生反应为:Li4Ti5O12 + LiFePO4 = Li4+xTi5O12 +Li 1-xFePO4 (0<x<1),请写出该电池放电时的阳极反应方程式
您最近一年使用:0次
解题方法
6 . 水钴矿的主要成分为CoO、Co2O3、 Co(OH)3, 还含SiO2及少量Al2O3、Fe2O3、 CuO、MnO2 等。 一种利用水钻矿制取CoCl2·6H2O的工艺流程如下:

已知部分沉淀的有关数据如下表(“沉淀完全”是指溶液中离子浓度低于1.0 ×10-5mol·L-1)。
请回答下列问题:
(1)写出“浸出”时Co2O3发生反应的离子方程式_______ ,分析加入Na2SO3的必要性_______ 。
(2)写出NaClO3发生主要反应的离子方程式_______ 。若向“浸出液”中加NaClO3时不慎过量,可能会引起什么不良后果_______ 。
(3)假设“氧化”后溶液中Co2+的浓度为0.2 mol·L-1, 通过简要计算说明“沉淀”时应控制溶液pH的范围_______ 。
(4)“系列操作”中包含3个基本实验操作,依次写出它们的名称_______ 、_______ 、_______ 。
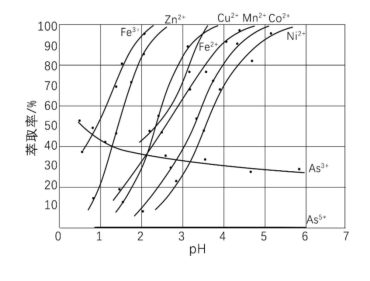
(5)某种萃取剂对部分离子的萃取率与溶液pH的关系如图所示。请写出2条萃取规律_______ 、_______ ,并说明本流程是否可用该萃取剂进行萃取_______ 。
 .
.

已知部分沉淀的有关数据如下表(“沉淀完全”是指溶液中离子浓度低于1.0 ×10-5mol·L-1)。
| 沉淀 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Cu(OH)2 | Mn(OH)2 |
| 沉淀完全时pH | 5.2 | 2.8 | 8.3 | 9.4 | 6.7 | 10.1 |
| 沉淀溶解时pH | 7.8 | — | — | 14 | — | — |
请回答下列问题:
(1)写出“浸出”时Co2O3发生反应的离子方程式
(2)写出NaClO3发生主要反应的离子方程式
(3)假设“氧化”后溶液中Co2+的浓度为0.2 mol·L-1, 通过简要计算说明“沉淀”时应控制溶液pH的范围
(4)“系列操作”中包含3个基本实验操作,依次写出它们的名称
(5)某种萃取剂对部分离子的萃取率与溶液pH的关系如图所示。请写出2条萃取规律
 .
.
您最近一年使用:0次



