名校
解题方法
1 . 以黄铁矿(主要成分是 ,含少量
,含少量 )和软锰矿(主要成分是
)和软锰矿(主要成分是 ,含少量
,含少量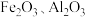 )为原料制备
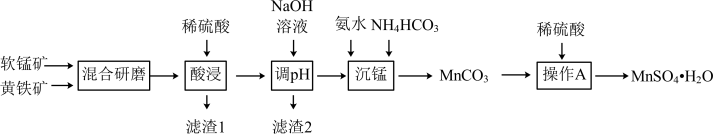
)为原料制备 的工艺流程如下:
的工艺流程如下:
已知: 时,
时,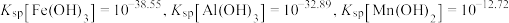 。
。
(1)研磨黄铁矿、软锰矿的目的是_______ 。
(2)酸浸过程得到的滤液中含有的金属阳离子有 和
和_______ ,滤渣1的成分为 和
和_______ 写出酸浸过程中主要反应的离子方程式_______ 。
(3)调 时,若溶液中
时,若溶液中 ,为得到尽可能多且纯净的产品,应控制
,为得到尽可能多且纯净的产品,应控制 的范围是
的范围是_______ 。
(4)沉锰过程需控制温度为 的原因是
的原因是_______ 。
(5)写出沉锰过程中生成 的离子方程式
的离子方程式_______ 。
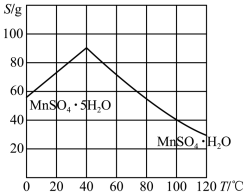
(6)下图为 的溶解度曲线,操作A是加入足量稀硫酸充分反应后,
的溶解度曲线,操作A是加入足量稀硫酸充分反应后,_______ 洗涤干燥。
 ,含少量
,含少量 )和软锰矿(主要成分是
)和软锰矿(主要成分是 ,含少量
,含少量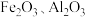 )为原料制备
)为原料制备 的工艺流程如下:
的工艺流程如下:
已知:
 时,
时,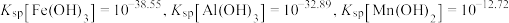 。
。(1)研磨黄铁矿、软锰矿的目的是
(2)酸浸过程得到的滤液中含有的金属阳离子有
 和
和 和
和(3)调
 时,若溶液中
时,若溶液中 ,为得到尽可能多且纯净的产品,应控制
,为得到尽可能多且纯净的产品,应控制 的范围是
的范围是(4)沉锰过程需控制温度为
 的原因是
的原因是(5)写出沉锰过程中生成
 的离子方程式
的离子方程式(6)下图为
 的溶解度曲线,操作A是加入足量稀硫酸充分反应后,
的溶解度曲线,操作A是加入足量稀硫酸充分反应后,
您最近一年使用:0次
2024-03-31更新
|
522次组卷
|
2卷引用:广东省广州市第六十五中学2023-2024学年高三下学期期初综合训练化学试题
名校
解题方法
2 . 铅用途广泛,是电气工业部门制造蓄电池、汽油添加剂和电缆的原材料。工业上常用铅精矿(主要成分是PbS以及少量Zn、Fe、SiO2、MgO、Al2O3)通过如图所示工业流程制取铅。

已知:①PbS在稀硫酸中不会溶解
②常温下,相关金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)滤渣1的成分是___________ ;酸浸后的分离操作是___________ 。
(2)溶液3可以是___________。
(3)反应4中铅单质在___________ 极产生,对应的电极反应式为___________ ;若转移2 mol电子,则生成的铅___________ 克。
(4)已知溶液4的溶质是化合物且为绿色氧化剂,写出反应3的化学方程式___________ 。
(5)根据题目所给信息,请计算出
___________ 。

已知:①PbS在稀硫酸中不会溶解
②常温下,相关金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |  |
| 开始沉淀pH | 6.5 | 2.2 | 5.4 | 9.5 | 3.5 |
完全沉淀( )的pH )的pH | 9.7 | 3.2 | 6.4 | 11.0 | 4.7 |
(1)滤渣1的成分是
(2)溶液3可以是___________。
| A.盐酸 | B.氢氧化钠溶液 | C.食盐水 | D.氯化铵溶液 |
(3)反应4中铅单质在
(4)已知溶液4的溶质是化合物且为绿色氧化剂,写出反应3的化学方程式
(5)根据题目所给信息,请计算出

您最近一年使用:0次
3 . 元素的“价一类”二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。如图为铁元素的“价一类”二维图,箭头表示部分物质间的转化关系。
请回答一下问题:
(1) 中
中 的化合价为
的化合价为_______ 。
(2) 是否为碱性氧化物
是否为碱性氧化物_______ (填是或否),理由:_______ 。
(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:_______ 。其中检验溶液中 的试剂是
的试剂是_______ 。
(4)电子工业常用 的
的 溶液腐蚀敷在绝缘板上的铜箔,从而制造印刷电路板,写出此过程的离子方程式
溶液腐蚀敷在绝缘板上的铜箔,从而制造印刷电路板,写出此过程的离子方程式_______ ;印刷电路板的废液中加入一定量铁粉,充分反应后,准备过滤并收集滤渣。此时,滤渣的成分不可能是_______ 。
aA.没有滤渣 B.有 也有
也有 C.只有
C.只有 D.只有
D.只有

请回答一下问题:
(1)
 中
中 的化合价为
的化合价为(2)
 是否为碱性氧化物
是否为碱性氧化物(3)制备氢氧化亚铁时,现象由白色絮状沉淀最终转化为红褐色沉淀,请用化学方程式解释现象:
 的试剂是
的试剂是(4)电子工业常用
 的
的 溶液腐蚀敷在绝缘板上的铜箔,从而制造印刷电路板,写出此过程的离子方程式
溶液腐蚀敷在绝缘板上的铜箔,从而制造印刷电路板,写出此过程的离子方程式aA.没有滤渣 B.有
 也有
也有 C.只有
C.只有 D.只有
D.只有
您最近一年使用:0次
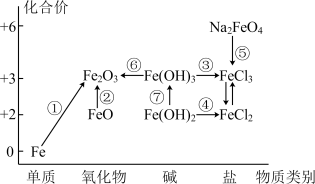
4 . 随着新能源汽车的不断发展,从经济价值、环境保护等多重背景下考虑,废旧锂离子电池中的锂、镍、钴、锰金属的回收利用已经刻不容缓。某科研团队对废旧三元锂电池进行处理,工艺如图所示:
查阅资料显示:
a.正极片预处理后的粉料中主要成分与终端产品2相同,均为 ,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为
,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为 。
。
b.碳酸锂的溶解度随温度升高而减小。
(1)镍位于元素周期表第_______ 周期第_______ 族。
(2)写出粉料中的 通过“浸出还原”得到含
通过“浸出还原”得到含 、
、 、
、 、
、 溶液的化学反应方程式:
溶液的化学反应方程式:______________________________________________ 。
(3)温度、浸出时间对镍、钴、锰的浸出率的影响如下图所示。根据图中信息,应选择的温度为_______  ,浸出时间为
,浸出时间为_______  。除以上两因素外,任写一种对浸出率有影响的因素:
。除以上两因素外,任写一种对浸出率有影响的因素:_____________________ 。

(4)“浸出还原”后,可用低浓度的碳酸氢铵溶液除杂,写出反应的离子方程式_____________________ 。
(5)“共沉淀”后的滤液中含有大量 ,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:
,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:_______ 、_______ 、洗涤、干燥。
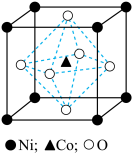
(6)一种钴镍氧化物的立方晶胞结构如图,该晶体的化学式为_______ ;已知晶胞参数为 ,晶胞密度为
,晶胞密度为 ,据此推断阿伏加德罗常数
,据此推断阿伏加德罗常数
_______  。(列出计算式)
。(列出计算式)

查阅资料显示:
a.正极片预处理后的粉料中主要成分与终端产品2相同,均为
 ,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为
,且其中所含镍、钴、锰的化合价均为+3价。杂质主要为 。
。b.碳酸锂的溶解度随温度升高而减小。
(1)镍位于元素周期表第
(2)写出粉料中的
 通过“浸出还原”得到含
通过“浸出还原”得到含 、
、 、
、 、
、 溶液的化学反应方程式:
溶液的化学反应方程式:(3)温度、浸出时间对镍、钴、锰的浸出率的影响如下图所示。根据图中信息,应选择的温度为
 ,浸出时间为
,浸出时间为 。除以上两因素外,任写一种对浸出率有影响的因素:
。除以上两因素外,任写一种对浸出率有影响的因素:
(4)“浸出还原”后,可用低浓度的碳酸氢铵溶液除杂,写出反应的离子方程式
(5)“共沉淀”后的滤液中含有大量
 ,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:
,加碳酸钠后,对溶液采用如下“系列操作”可得到终端产品1:(6)一种钴镍氧化物的立方晶胞结构如图,该晶体的化学式为
 ,晶胞密度为
,晶胞密度为 ,据此推断阿伏加德罗常数
,据此推断阿伏加德罗常数
 。(列出计算式)
。(列出计算式)
您最近一年使用:0次
解题方法
5 . 某硫酸厂用硫铁矿焙烧后的烧渣(主要成分为 、
、 、
、 ,不考虑其他杂质)制备绿矾粗产品
,不考虑其他杂质)制备绿矾粗产品 的流程如下:
的流程如下: 是酸性氧化物。
是酸性氧化物。
回答下列问题:
(1)流程中两次“操作”的名称是________ 。
(2)“还原”步骤中溶液由黄色变浅绿色,写出溶液变浅绿色的离子方程式________ 。
(3)“调pH至5-6”步骤中,写出生成 的离子方程式
的离子方程式________ 。
(4)鉴别滤液a中金属阳离子的实验方案如下,按要求填空:
 、
、 、
、 ,不考虑其他杂质)制备绿矾粗产品
,不考虑其他杂质)制备绿矾粗产品 的流程如下:
的流程如下:
 是酸性氧化物。
是酸性氧化物。回答下列问题:
(1)流程中两次“操作”的名称是
(2)“还原”步骤中溶液由黄色变浅绿色,写出溶液变浅绿色的离子方程式
(3)“调pH至5-6”步骤中,写出生成
 的离子方程式
的离子方程式(4)鉴别滤液a中金属阳离子的实验方案如下,按要求填空:
操作 | 现象 | 结论或离子方程式 |
| 步骤1:取少量滤液a进行① | 火焰呈② | 滤液a中含有 。 。 |
| 步骤2:另取少量滤液a于试管中,依次滴入③ | 溶液先无红色,后变红色。 | 滤液a中含有 ,不含 ,不含 。写出该过程中属于氧化还原反应的离子方程式④ 。写出该过程中属于氧化还原反应的离子方程式④ |
您最近一年使用:0次
2024-01-22更新
|
86次组卷
|
2卷引用:广东省湛江市雷州市第二中学2023-2024学年高一下学期开学化学试题
名校
解题方法
6 . 化工专家侯德榜发明的侯氏制碱法,其工艺流程图如下:
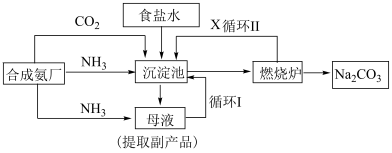
Ⅰ.根据以上流程回答下列问题:
(1)“侯氏制碱法”中的“碱”为___________ (填化学式),其用途有___________ (写一种)。
(2)生产时,先向饱和NaCl溶液中通入较多的NH3(溶液显碱性),再通入足量的CO2,其原因是下列中的___________ 。(填选项)
A.NH3比CO2更易制取
B.使CO2更易被吸收,加快反应速率
C.CO2的密度比NH3大
(3)从沉淀池中分离出NaHCO3晶体的方法是___________ 。
(4)燃烧炉中发生反应的化学方程式为___________ ,循环Ⅱ中X的分子式为___________ 。
Ⅱ.产品分析:
(5)碳酸钠中可能含有氯化钠,检验的操作和现象为___________ 。
(6)把6.0 g含有少量NaCl杂质的Na2CO3样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量Na2O2固体,Na2O2增重1.4 g,回答下列问题:
①气体与Na2O2反应的化学方程式为___________ 。
②产品纯度(质量分数)为___________ (保留3位有效数字)。

Ⅰ.根据以上流程回答下列问题:
(1)“侯氏制碱法”中的“碱”为
(2)生产时,先向饱和NaCl溶液中通入较多的NH3(溶液显碱性),再通入足量的CO2,其原因是下列中的
A.NH3比CO2更易制取
B.使CO2更易被吸收,加快反应速率
C.CO2的密度比NH3大
(3)从沉淀池中分离出NaHCO3晶体的方法是
(4)燃烧炉中发生反应的化学方程式为
Ⅱ.产品分析:
(5)碳酸钠中可能含有氯化钠,检验的操作和现象为
(6)把6.0 g含有少量NaCl杂质的Na2CO3样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸,再通过足量Na2O2固体,Na2O2增重1.4 g,回答下列问题:
①气体与Na2O2反应的化学方程式为
②产品纯度(质量分数)为
您最近一年使用:0次
2023-12-25更新
|
123次组卷
|
3卷引用:广东省惠东荣超中学2023-2024学年高一下学期开学质量检测化学试题
名校
解题方法
7 . 钯(Pd)是一种贵金属,性质类似铂(Pt)。活性炭载钯催化剂广泛应用于石油化工、制药等工业,但使用过程中因生成难溶于酸的PdO而失活。一种从废钯催化剂(杂质主要含有机物、活性炭、及少量Fe、Cu、Al等元素)中回收海绵钯的工艺流程如图: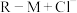 ;R-Na+N+→
;R-Na+N+→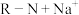 (R-表示树脂的有机成分)。
(R-表示树脂的有机成分)。
②“沉钯”时得到氯钯酸铵 固体,不溶于冷水,可溶于稀盐酸。
固体,不溶于冷水,可溶于稀盐酸。
(1)“焙烧”的目的是___________ 。
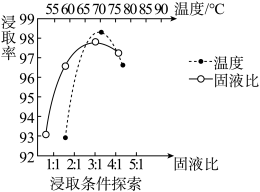
(2)温度、固液比对浸取率的影响如图,则“浸取”的最佳条件为___________ 。
(3)“浸取”时,加入试剂A的目的为将焙烧过程中产生的PdO还原为Pd,若试剂A为甲酸,该反应的化学方程式为___________ 。 有利于Pd的溶解,生成的四氯合钯酸(
有利于Pd的溶解,生成的四氯合钯酸( )为二元强酸。加入浓盐酸和
)为二元强酸。加入浓盐酸和 后主要反应的离子方程式:
后主要反应的离子方程式:___________ 。
(5)“离子交换除杂”应使用_ (填“阳离子”或“阴离子”)树脂,“洗脱”时应使用的洗脱液为___________ (填标号)。
A.硫酸 B.盐酸 C.无水乙醇
(6)“还原”过程 转化为
转化为 ,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为
,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为___________ ,且该产物可循环利用至___________ 环节(填环节名称)。

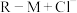 ;R-Na+N+→
;R-Na+N+→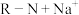 (R-表示树脂的有机成分)。
(R-表示树脂的有机成分)。②“沉钯”时得到氯钯酸铵
 固体,不溶于冷水,可溶于稀盐酸。
固体,不溶于冷水,可溶于稀盐酸。(1)“焙烧”的目的是
(2)温度、固液比对浸取率的影响如图,则“浸取”的最佳条件为
(3)“浸取”时,加入试剂A的目的为将焙烧过程中产生的PdO还原为Pd,若试剂A为甲酸,该反应的化学方程式为
 有利于Pd的溶解,生成的四氯合钯酸(
有利于Pd的溶解,生成的四氯合钯酸( )为二元强酸。加入浓盐酸和
)为二元强酸。加入浓盐酸和 后主要反应的离子方程式:
后主要反应的离子方程式:(5)“离子交换除杂”应使用
A.硫酸 B.盐酸 C.无水乙醇
(6)“还原”过程
 转化为
转化为 ,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为
,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为
您最近一年使用:0次
名校
8 . 孔雀石的主要成分为CuCO3·Cu(OH)2某同学设计从孔雀石中冶炼铜的方案如图:

回答下列问题:
(1)将孔雀石粉碎的目的是_____ ,加入过量稀硫酸,可观察到的现象是_____ 。
(2)操作a的名称是_____ ,在滤液中加入过量铁粉发生的反应有_____ (用离子方程式表示)
(3)A的化学式为_____ ,在悬浊液中加入A的目的是_____ 。
(4)从滤液中获得铜的另外一种方案是: 现有111kgCuCO3·Cu(OH)2,通过这种方案理论上可以制取
现有111kgCuCO3·Cu(OH)2,通过这种方案理论上可以制取_____ kg铜
(5)由孔雀石冶炼铜还可有第二种方案:将孔雀石与焦炭一起加热,可以生成铜、二氧化碳、水。
①该反应的还原剂是_____
②CuCO3·Cu(OH)2与焦炭物质的量之比应该为_____ ,实际中碳要过量一些。

回答下列问题:
(1)将孔雀石粉碎的目的是
(2)操作a的名称是
(3)A的化学式为
(4)从滤液中获得铜的另外一种方案是:
 现有111kgCuCO3·Cu(OH)2,通过这种方案理论上可以制取
现有111kgCuCO3·Cu(OH)2,通过这种方案理论上可以制取(5)由孔雀石冶炼铜还可有第二种方案:将孔雀石与焦炭一起加热,可以生成铜、二氧化碳、水。
①该反应的还原剂是
②CuCO3·Cu(OH)2与焦炭物质的量之比应该为
您最近一年使用:0次
解题方法
9 . 稀土抛光粉 有优良抛光性能。某抛光后产生的抛光渣(含
有优良抛光性能。某抛光后产生的抛光渣(含 、
、 、
、 、
、 、
、 、
、 等的化合物)进行提纯的工艺如下:
等的化合物)进行提纯的工艺如下:
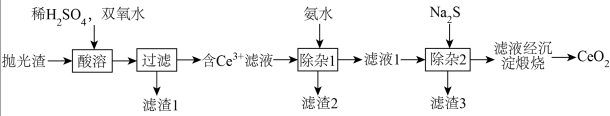
已知:25℃时, ,
,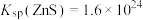 ,
, 。一定条件下,一些金属氢氧化物沉淀时的
。一定条件下,一些金属氢氧化物沉淀时的 如下表:
如下表:
(1)“酸溶”时,需控制80℃水浴加热,若温度过高浸出率降低的原因是_____ 。 发生反应的离子方程式为
发生反应的离子方程式为_____ 。
(2)“滤渣1”的主要成分为_____ 。
(3)“除杂1”中,加入氨水控制 范围为
范围为_____ ,溶液中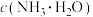
_____  (填“>”“=”或“<”)。“除杂2”中,主要除去的金属元素为
(填“>”“=”或“<”)。“除杂2”中,主要除去的金属元素为_____ 。
(4) 的晶胞结构如图1所示,晶胞参数为
的晶胞结构如图1所示,晶胞参数为 ,
, 原子处于
原子处于 形成的四面体间隙中。则
形成的四面体间隙中。则 原子的配位数为
原子的配位数为_____ ,晶胞密度为_____  。(列出计算式,
。(列出计算式, 的式量为
的式量为 ,阿伏加德罗常数为
,阿伏加德罗常数为 )
)
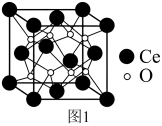
(5)纳米 分散液用于光学玻璃抛光时,
分散液用于光学玻璃抛光时, 值对抛光效果(材料抛光去除速率及抛光后表面粗糙度)的影响如图所示,已知抛光液中,
值对抛光效果(材料抛光去除速率及抛光后表面粗糙度)的影响如图所示,已知抛光液中, 纳米颗粒表面吸附了负电荷相互排斥而稳定。从图2中可看出,最佳
纳米颗粒表面吸附了负电荷相互排斥而稳定。从图2中可看出,最佳 值为
值为_____ ,在较低 值,抛光效果不理想的原因为
值,抛光效果不理想的原因为_____ 。
 有优良抛光性能。某抛光后产生的抛光渣(含
有优良抛光性能。某抛光后产生的抛光渣(含 、
、 、
、 、
、 、
、 、
、 等的化合物)进行提纯的工艺如下:
等的化合物)进行提纯的工艺如下:
已知:25℃时,
 ,
,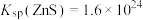 ,
, 。一定条件下,一些金属氢氧化物沉淀时的
。一定条件下,一些金属氢氧化物沉淀时的 如下表:
如下表:| 金属氢氧化物 |  |  |  | 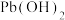 |  |
开始沉淀的 | 2.3 | 3.5 | 6.4 | 7.2 | 6.2 |
完全沉淀的 | 3.2 | 4.6 | 9.0 | 9.1 | 8.2 |
 发生反应的离子方程式为
发生反应的离子方程式为(2)“滤渣1”的主要成分为
(3)“除杂1”中,加入氨水控制
 范围为
范围为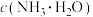
 (填“>”“=”或“<”)。“除杂2”中,主要除去的金属元素为
(填“>”“=”或“<”)。“除杂2”中,主要除去的金属元素为(4)
 的晶胞结构如图1所示,晶胞参数为
的晶胞结构如图1所示,晶胞参数为 ,
, 原子处于
原子处于 形成的四面体间隙中。则
形成的四面体间隙中。则 原子的配位数为
原子的配位数为 。(列出计算式,
。(列出计算式, 的式量为
的式量为 ,阿伏加德罗常数为
,阿伏加德罗常数为 )
) 
(5)纳米
 分散液用于光学玻璃抛光时,
分散液用于光学玻璃抛光时, 值对抛光效果(材料抛光去除速率及抛光后表面粗糙度)的影响如图所示,已知抛光液中,
值对抛光效果(材料抛光去除速率及抛光后表面粗糙度)的影响如图所示,已知抛光液中, 纳米颗粒表面吸附了负电荷相互排斥而稳定。从图2中可看出,最佳
纳米颗粒表面吸附了负电荷相互排斥而稳定。从图2中可看出,最佳 值为
值为 值,抛光效果不理想的原因为
值,抛光效果不理想的原因为
您最近一年使用:0次
名校
10 . 22号元素钛(Ti)的单质被誉为未来金属。工业冶炼Ti后的废渣中有SiO2和含Ti、Ca、Fe、Cu、Mg的化合物,从该废渣中回收Ti,并获得高附加值化工产品(MgF2、活性CaCO3、K2FeO4、X)的一种生产工艺如图所示:

已知:生产条件下MgF2的溶度积为9.0×10-9;NH4+时存在时,不易生成MgCO3沉淀,固体2中有CaCO3、Cu2(OH)2CO3和某含铁化合物。
(1)写出基态Ti原子的价电子排布式:_______ 。
(2)工艺设计要准确分析物质成分,科学加入试剂,准确把握用量,离子物质的量浓度≤1.0×10-5mol/L时,一般认为该离子沉淀完全。
①选择向固体1中加入盐酸而不加入硫酸的原因是_______ 。
②“析晶”过程是向深蓝色溶液3中先加入适量70%的H2SO4中和过量的氨水,再加入适量乙醇,得到深蓝色品体X,产品X的化学式是_______ 。
③“再溶”过程中加入强碱Y的稀溶液,溶液4中加入适量强碱Y的固体,强碱Y的化学式是_______ ;写出固体3“再溶”过程的离子方程式:________ 。
④测得溶液2中c(Mg2+)=0.030mol/L,要确保Mg2+沉淀完全,1L溶液2至少需加入NaF的物质的量为_______ mol(忽略溶液体积变化)。
(3)以上生产工艺中可循环利用的物质有NH3和_______ (填化学式)。
(4)活性碳酸钙晶胞为正方体结构,晶胞结构如图所示,黑点代表Ca2+,白色小圈代表CO ,晶胞边长为anm。
,晶胞边长为anm。

①活性碳酸钙晶体中一个CO 周围与其最近且等距的Ca2+的个数为
周围与其最近且等距的Ca2+的个数为_______ 。
②最近两个Ca2+之间的距离为_______ nm(用含a的代数式表示)。

已知:生产条件下MgF2的溶度积为9.0×10-9;NH4+时存在时,不易生成MgCO3沉淀,固体2中有CaCO3、Cu2(OH)2CO3和某含铁化合物。
(1)写出基态Ti原子的价电子排布式:
(2)工艺设计要准确分析物质成分,科学加入试剂,准确把握用量,离子物质的量浓度≤1.0×10-5mol/L时,一般认为该离子沉淀完全。
①选择向固体1中加入盐酸而不加入硫酸的原因是
②“析晶”过程是向深蓝色溶液3中先加入适量70%的H2SO4中和过量的氨水,再加入适量乙醇,得到深蓝色品体X,产品X的化学式是
③“再溶”过程中加入强碱Y的稀溶液,溶液4中加入适量强碱Y的固体,强碱Y的化学式是
④测得溶液2中c(Mg2+)=0.030mol/L,要确保Mg2+沉淀完全,1L溶液2至少需加入NaF的物质的量为
(3)以上生产工艺中可循环利用的物质有NH3和
(4)活性碳酸钙晶胞为正方体结构,晶胞结构如图所示,黑点代表Ca2+,白色小圈代表CO
 ,晶胞边长为anm。
,晶胞边长为anm。
①活性碳酸钙晶体中一个CO
 周围与其最近且等距的Ca2+的个数为
周围与其最近且等距的Ca2+的个数为②最近两个Ca2+之间的距离为
您最近一年使用:0次



