解题方法
1 . 氯化亚铜(CuCl)是一种重要的化工产品。它不溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4―nCln]。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

回答下列问题:
(1)步骤①中得到的氧化产物是_______________ ,溶解温度应控制在60~70度,温度不宜过高的原因是_______________ 。
(2)步骤③中Cu+的沉淀率与加入的NH4Cl的量关系如图所示。写出步骤③中主要反应的离子方程式_______________ 。提高处于C点状态的混合物中Cu+沉淀率的措施可以是_______________ 。

(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_______________ (写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是_______________ 。
(5)CuCl可用于捕捉CO气体,其反应为CuCl(s)+xCO(g) CuCl∙xCO(s)△H<0,为提高CO的平衡转化率,可采取的措施有
CuCl∙xCO(s)△H<0,为提高CO的平衡转化率,可采取的措施有_______________ (填标号)。
A.降低温度B.增大压强
C.延长反应时间D.把CuCl分散到疏松多孔的分子筛中

回答下列问题:
(1)步骤①中得到的氧化产物是
(2)步骤③中Cu+的沉淀率与加入的NH4Cl的量关系如图所示。写出步骤③中主要反应的离子方程式

(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是
(4)上述工艺中,步骤⑥不能省略,理由是
(5)CuCl可用于捕捉CO气体,其反应为CuCl(s)+xCO(g)
 CuCl∙xCO(s)△H<0,为提高CO的平衡转化率,可采取的措施有
CuCl∙xCO(s)△H<0,为提高CO的平衡转化率,可采取的措施有A.降低温度B.增大压强
C.延长反应时间D.把CuCl分散到疏松多孔的分子筛中
您最近一年使用:0次
名校
2 . MnO2在电池、玻璃、有机合成等工业生产中应用广泛。利用粗MnO2(含有杂质MnO和MnCO3)制取纯MnO2的流程如图:
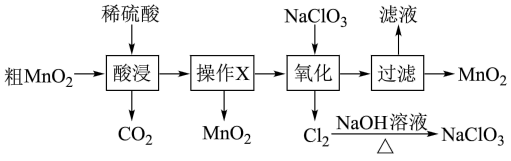
下列说法错误的是

下列说法错误的是
| A.酸浸过程中可以用浓盐酸代替稀硫酸 |
| B.操作X的名称是过滤 |
C.氧化过程发生反应的离子方程式为:5Mn2++2ClO +4H2O=5MnO2↓+Cl2↑+8H+ +4H2O=5MnO2↓+Cl2↑+8H+ |
| D.Cl2与NaOH溶液加热反应得到的NaClO3可以循环使用 |
您最近一年使用:0次
2020-08-24更新
|
1492次组卷
|
9卷引用:湖北省仙桃中学、天门中学(A班)2021-2022学年高二上学期期中考试化学试题
湖北省仙桃中学、天门中学(A班)2021-2022学年高二上学期期中考试化学试题广东省惠州市2021届高三上学期第一次调研考试化学试题湖南省长沙市雅礼中学2021届高三上学期第二次月考化学试题宁夏石嘴山市第三中学2021届高三上学期第二次月考化学试题(已下线)学科网2020年高三11月大联考考后强化卷(新课标Ⅲ卷)(已下线)学科网2020年高三11月大联考考后强化卷(新课标Ⅱ卷)甘肃省嘉峪关市第一中学2021届高三上学期二模考试化学试题甘肃省民乐县第一中学2021-2022学年高三上学期10月诊断考试化学试题新疆第二师八一中学2022-2023学年高三上学期第一次月考化学试题
3 . 己二酸在化工生产中有重要作用。某兴趣小组用50%的硝酸作氧化剂.钒酸铵作催化剂,氧化环己醇制备己二酸,其反应原理为3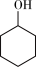 +8HNO3
+8HNO3 3HOOC(CH2)4COOH+8NO↑+7H2O,实验装置如图所示。
3HOOC(CH2)4COOH+8NO↑+7H2O,实验装置如图所示。
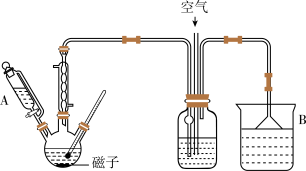
实验步骤:在装有回流冷凝管、温度计的50mL三颈烧瓶中,加入50%HNO3溶液(含0.12molHNO3)及少量钒酸铵(0.01g),缓慢滴加5~6滴环己醇.有红棕色气体二氧化氮产生,将剩余的环己醇滴加完毕,总量为2mL(约0.02mol)。在温度为80~90℃时,反应至无红棕色气体逸出。将反应液倒入50mL的烧杯中,冷却后。析出己二酸。减压过滤,用15mL冷水洗涤,干燥后得到粗产品mg。
回答以下问题.
(1)仪器A的名称为____________ ,仪器B中所盛装的试剂为____________ 。
(2)实验过程中,最适宜的加热方法为____________ ;该加热方法的优点是____________ 。
(3)本实验中称量钒酸铵的仪器应选用____________ (填“托盘天平”或“电子天平”)。
(4)减压过滤后的晶体用冷水洗涤,简述洗涤的操作过程:____________ 。
(5)为测定粗产品中己二酸的含量,将得到的粗产品配成溶液,并用0.100mol•L-1的NaOH标准溶液进行滴定,下列操作可能使实际消耗NaOH标准溶液的体积偏大的是____________ (填标号)。
A使用甲基橙作指示剂
B.滴定前俯视读数,滴定后仰视读数
C.实验用的碱滴定管、锥形瓶水洗后均未润洗
 +8HNO3
+8HNO3 3HOOC(CH2)4COOH+8NO↑+7H2O,实验装置如图所示。
3HOOC(CH2)4COOH+8NO↑+7H2O,实验装置如图所示。
实验步骤:在装有回流冷凝管、温度计的50mL三颈烧瓶中,加入50%HNO3溶液(含0.12molHNO3)及少量钒酸铵(0.01g),缓慢滴加5~6滴环己醇.有红棕色气体二氧化氮产生,将剩余的环己醇滴加完毕,总量为2mL(约0.02mol)。在温度为80~90℃时,反应至无红棕色气体逸出。将反应液倒入50mL的烧杯中,冷却后。析出己二酸。减压过滤,用15mL冷水洗涤,干燥后得到粗产品mg。
回答以下问题.
(1)仪器A的名称为
(2)实验过程中,最适宜的加热方法为
(3)本实验中称量钒酸铵的仪器应选用
(4)减压过滤后的晶体用冷水洗涤,简述洗涤的操作过程:
(5)为测定粗产品中己二酸的含量,将得到的粗产品配成溶液,并用0.100mol•L-1的NaOH标准溶液进行滴定,下列操作可能使实际消耗NaOH标准溶液的体积偏大的是
A使用甲基橙作指示剂
B.滴定前俯视读数,滴定后仰视读数
C.实验用的碱滴定管、锥形瓶水洗后均未润洗
您最近一年使用:0次
名校
解题方法
4 . 目前世界锂离子电池总产量超过30亿只,锂电池消耗量巨大,黄石一重点中学化学研究小组对某废旧锂离子电池正极材料(图中简称废料,成分为LiMn2O4、石墨粉和铝箔)进行回收研究,工艺流程如图:

已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。
(1)写出氢氧化钠的电子式___ 。
(2)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是___ 。
(3)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求___ 。
(4)写出反应④生成沉淀X的离子方程式___ 。
(5)已知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的离子反应方程式:___ 。
(6)生成Li2CO3的化学反应方程式为___ 。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应___ 。

已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。
(1)写出氢氧化钠的电子式
(2)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是
(3)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求
(4)写出反应④生成沉淀X的离子方程式
(5)已知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的离子反应方程式:
(6)生成Li2CO3的化学反应方程式为
您最近一年使用:0次
2010·湖北武汉·一模
5 . 某实验小组欲制取氧化铜并证明其能加快氯酸钾的分解,进行如下实验:
I.制取氧化铜
①称取2gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液。直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是__________ (填实验序号),步骤①、③中研磨固体所用仪器的名称是____________ 。
(2)步骤③中洗涤沉淀的操作是__________ 。
Ⅱ.证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较。实验时均以生成25 mL气体为准,其他可能影响实验的因素均已忽略,相关数据见下表:
回答下列问题:
(3)上述实验中的“待测数据”指________ 。
(4)若要证明实验中产生的气体是O2,可用小试管收集气体,后续操作为_____ 。
(5)为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a.__________ 。
b. CuO的化学性质有没有改变。
I.制取氧化铜
①称取2gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;
②向上述CuSO4溶液中逐滴加入NaOH溶液。直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;
③将步骤②所得混合物过滤、洗涤,晾干后研细备用。
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是
(2)步骤③中洗涤沉淀的操作是
Ⅱ.证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较。实验时均以生成25 mL气体为准,其他可能影响实验的因素均已忽略,相关数据见下表:
实验序号 | KClO3质量 | 其他物质的质量 | 待测数据 |
④ | 1.2g | 无其他物质 | |
⑤ | 1.2g | CuO 0.5g | |
⑥ | 1.2g | MnO2 0.5g |
(3)上述实验中的“待测数据”指
(4)若要证明实验中产生的气体是O2,可用小试管收集气体,后续操作为
(5)为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a.
b. CuO的化学性质有没有改变。
您最近一年使用:0次



