1 . 纯碱是一种重要的化工原料,具有广泛的用途。实验室利用氯化钠和碳酸氢铵制备纯碱并测定产品中碳酸氢钠的含量,具体步骤如下:
步骤i.精制氯化钠
取饱和粗盐水并加热,向其中加入饱和 溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
步骤ⅱ.制备纯碱
在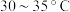 水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
步骤ⅲ.产品中碳酸氢钠含量的测定
称取a g产品加水溶解,滴加指示剂M,用 盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸
盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸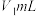 ;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积
;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积 。
。
已知:相关物质的溶解度如下
说明:“—”表示该物质在相应温度下已开始分解。
回答下列问题:
(1)步骤ⅰ中,胶状沉淀的成分为 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为________________ ;
(2)步骤ⅰ中,沉淀析出后需继续加热煮沸一段时间,其目的为________________ ;
(3)步骤ⅱ中,选择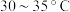 水浴的原因为
水浴的原因为________________ ;
(4)步骤ⅱ中,用碳酸氢钠饱和过的酒精水溶液洗涤晶体可除去的杂质为________________ ;
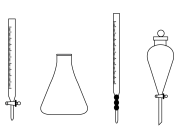
(5)步骤ⅲ中,用到的玻璃仪器除胶头滴管外还需要下列仪器中的________ (填仪器名称);________ ;滴定过程中,盐酸需要逐滴加入并不断振荡的原因为________________ ;选择指示剂N时,滴定终点溶液颜色变化为________________ ;
(7)产品中碳酸氢钠的质量分数为________ (用含字母的代数式表示)。
步骤i.精制氯化钠
取饱和粗盐水并加热,向其中加入饱和
 溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。步骤ⅱ.制备纯碱
在
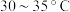 水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。步骤ⅲ.产品中碳酸氢钠含量的测定
称取a g产品加水溶解,滴加指示剂M,用
 盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸
盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸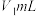 ;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积
;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积 。
。已知:相关物质的溶解度如下
温度 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| 15.8 | 21.0 | 27.0 | — | — | — | — |
| 8.15 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
| 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |
回答下列问题:
(1)步骤ⅰ中,胶状沉淀的成分为
 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为(2)步骤ⅰ中,沉淀析出后需继续加热煮沸一段时间,其目的为
(3)步骤ⅱ中,选择
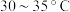 水浴的原因为
水浴的原因为(4)步骤ⅱ中,用碳酸氢钠饱和过的酒精水溶液洗涤晶体可除去的杂质为
(5)步骤ⅲ中,用到的玻璃仪器除胶头滴管外还需要下列仪器中的
(7)产品中碳酸氢钠的质量分数为
您最近一年使用:0次
今日更新
|
126次组卷
|
3卷引用:河北省石家庄市2024届普通高中学校高三毕业年级教学质量检测(三)化学试卷
2 . 某学习小组在实验室模拟工业制备硫氰化钾并测定产品中KSCN的含量。制备原理: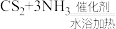
 (反应较缓慢)、
(反应较缓慢)、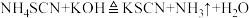 。
。
已知: 不溶于水,密度比水大;
不溶于水,密度比水大; 不溶于
不溶于 ;
; 在300℃左右分解。具体步骤如下:
在300℃左右分解。具体步骤如下:
Ⅰ.连接实验仪器,并检查装置的气密性。
Ⅱ.称取氯化铵、消石灰,经系列操作,将产生的气体通过碱石灰干燥。
Ⅲ.将干燥后的气体缓缓通入盛有 、
、 和固体催化剂的三颈烧瓶中,水浴加热较长时间直至油层消失。
和固体催化剂的三颈烧瓶中,水浴加热较长时间直至油层消失。
Ⅳ.移开水浴,将三颈烧瓶继续加热至105℃,一段时间后,缓缓滴入适量的KOH溶液并继续保持液温105℃。
Ⅴ.过滤三颈烧瓶中的混合物,将滤液蒸发浓缩、冷却结晶,再过滤、洗涤、干燥,得到KSCN晶体。
回答下列问题:
(1)步骤Ⅱ中用到的部分实验仪器如下:_______ ,“系列操作”中,为加快制备气体速率而进行的操作为_______ 。
(2)步骤Ⅲ中,“加热较长时间”的原因是_______ 。
(3)步骤Ⅳ中,将三颈烧瓶继续加热至105℃一段时间,该过程中发生反应的化学方程式为_____ ,实验时需将三颈烧瓶中逸出的尾气进行处理,下列试剂中最合适的是_______ (填标号)。
A.饱和食盐水 B.酸性 溶液 C.饱和NaHS溶液
溶液 C.饱和NaHS溶液
(4)步骤Ⅴ中,第一次过滤的目的是_______ 。
(5)测定晶体中KSCN的含量:称取4.0g样品,配成250mL溶液。量取75.00mL溶液并加入适量稀硝酸调节pH,再加入几滴 溶液,然后将溶液等分成三份,用0.1000mol/L
溶液,然后将溶液等分成三份,用0.1000mol/L  标准溶液分别滴定,达到滴定终点时平均消耗24.00mL
标准溶液分别滴定,达到滴定终点时平均消耗24.00mL  溶液。
溶液。
①滴定时发生的反应: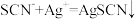 (白色)。则判断到达滴定终点的现象是
(白色)。则判断到达滴定终点的现象是________ 。
②晶体中KSCN的质量分数为_______ %(计算结果保留1位小数)。
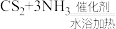
 (反应较缓慢)、
(反应较缓慢)、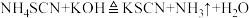 。
。已知:
 不溶于水,密度比水大;
不溶于水,密度比水大; 不溶于
不溶于 ;
; 在300℃左右分解。具体步骤如下:
在300℃左右分解。具体步骤如下:Ⅰ.连接实验仪器,并检查装置的气密性。
Ⅱ.称取氯化铵、消石灰,经系列操作,将产生的气体通过碱石灰干燥。
Ⅲ.将干燥后的气体缓缓通入盛有
 、
、 和固体催化剂的三颈烧瓶中,水浴加热较长时间直至油层消失。
和固体催化剂的三颈烧瓶中,水浴加热较长时间直至油层消失。Ⅳ.移开水浴,将三颈烧瓶继续加热至105℃,一段时间后,缓缓滴入适量的KOH溶液并继续保持液温105℃。
Ⅴ.过滤三颈烧瓶中的混合物,将滤液蒸发浓缩、冷却结晶,再过滤、洗涤、干燥,得到KSCN晶体。
回答下列问题:
(1)步骤Ⅱ中用到的部分实验仪器如下:
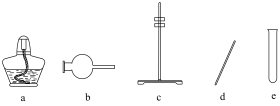
(2)步骤Ⅲ中,“加热较长时间”的原因是
(3)步骤Ⅳ中,将三颈烧瓶继续加热至105℃一段时间,该过程中发生反应的化学方程式为
A.饱和食盐水 B.酸性
 溶液 C.饱和NaHS溶液
溶液 C.饱和NaHS溶液(4)步骤Ⅴ中,第一次过滤的目的是
(5)测定晶体中KSCN的含量:称取4.0g样品,配成250mL溶液。量取75.00mL溶液并加入适量稀硝酸调节pH,再加入几滴
 溶液,然后将溶液等分成三份,用0.1000mol/L
溶液,然后将溶液等分成三份,用0.1000mol/L  标准溶液分别滴定,达到滴定终点时平均消耗24.00mL
标准溶液分别滴定,达到滴定终点时平均消耗24.00mL  溶液。
溶液。①滴定时发生的反应:
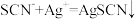 (白色)。则判断到达滴定终点的现象是
(白色)。则判断到达滴定终点的现象是②晶体中KSCN的质量分数为
您最近一年使用:0次
3 . 工业锌粉常用于制造防锈漆等,其主要成分为金属锌,还有少量含锌化合物及其他杂质,锌单质的含量及锌元素的总量影响着工业锌粉的等级。
I.锌的制备
(1)氯氨法炼锌:一定条件下,通入 ,以
,以 浓溶液为浸取剂浸锌,可将矿物中难溶的
浓溶液为浸取剂浸锌,可将矿物中难溶的 转化为
转化为 、
、 等,同时生成S,结合平衡移动原理解释
等,同时生成S,结合平衡移动原理解释 、
、 对浸锌的作用:
对浸锌的作用:_________ 。
(2)酸性介质中电沉积制锌粉:以 和
和 混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。
混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。
①阴极的电极反应有_________ 。
②制得65g锌粉时,电解质溶液中 的物质的量至少增加
的物质的量至少增加_________ mol。
(3)离子液体电沉积制锌:80℃时,将 溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因:
溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因:_________ 。
i.二甲酚橙(In)与 反应:
反应:
EDTA与 反应:
反应: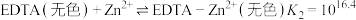
ii. 溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。
溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。
(4)滴定终点时的现象是_________ 。
(5)计算样品中锌元素的质量分数还需要的实验数据有_________ 。
I.锌的制备
(1)氯氨法炼锌:一定条件下,通入
 ,以
,以 浓溶液为浸取剂浸锌,可将矿物中难溶的
浓溶液为浸取剂浸锌,可将矿物中难溶的 转化为
转化为 、
、 等,同时生成S,结合平衡移动原理解释
等,同时生成S,结合平衡移动原理解释 、
、 对浸锌的作用:
对浸锌的作用:(2)酸性介质中电沉积制锌粉:以
 和
和 混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。
混合液(pH为4~6)为电解质溶液,用下图装置电解制锌粉,一定条件下,实验测得电流效率为80%。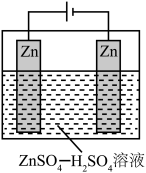

①阴极的电极反应有
②制得65g锌粉时,电解质溶液中
 的物质的量至少增加
的物质的量至少增加(3)离子液体电沉积制锌:80℃时,将
 溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因:
溶解于EMIC(结构如图)中,电解制锌。离子化合物EMIC的熔点约为79℃,从结构角度解释其熔点低的原因: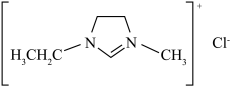

i.二甲酚橙(In)与
 反应:
反应:
EDTA与
 反应:
反应: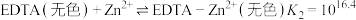
ii.
 溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。
溶液可排除其他金属阳离子的干扰,避免其与EDTA和In作用。(4)滴定终点时的现象是
(5)计算样品中锌元素的质量分数还需要的实验数据有
您最近一年使用:0次
4 . 重铬酸钾( )是实验室常用的氧化剂。某实验小组以铬铁矿(主要成分为
)是实验室常用的氧化剂。某实验小组以铬铁矿(主要成分为 ,含
,含 、
、 等杂质)为原料制备重铬酸钾,并进行性质验证实验。
等杂质)为原料制备重铬酸钾,并进行性质验证实验。
已知:相关物质在不同温度时的溶解度/g如下表:
实验一:重铬酸钾的制备
步骤Ⅰ:将一定量NaOH和 的固体置于铁坩埚内,加热至熔融,再加铬铁矿粉与
的固体置于铁坩埚内,加热至熔融,再加铬铁矿粉与 继续加热50分钟,发生反应:
继续加热50分钟,发生反应: ,自然冷却。
,自然冷却。
步骤Ⅱ:取出坩埚中的熔块,置于烧杯中,加水并加热煮沸15分钟,冷却后抽滤,弃去含铁固体物质。
步骤Ⅲ:用冰醋酸调节上述滤液pH为7到8,产生浑浊,加热后过滤除去 和
和 ,将滤液转移至蒸发皿中,加冰醋酸调节pH为5。
,将滤液转移至蒸发皿中,加冰醋酸调节pH为5。
步骤Ⅳ:向上述溶液中加KCl,出现少量晶体再次调pH并进行结晶操作,有大量橙色晶体析出,抽滤,用少量冷水洗涤晶体,干燥得 晶体。
晶体。
回答下列问题:
(1)步骤Ⅰ中下列仪器不需要的是_____ (填仪器名称)。

(2)步骤Ⅲ中调节滤液pH用冰醋酸,不用强酸的原因是_______ ,过滤前先加热的目的是________ 。
(3)步骤Ⅳ中的结晶方法是_______ (填“蒸发结晶”或“冷却结晶”),有同学制得的重铬酸钾晶体颜色偏黄,可能的原因是_______ 。
实验二:用重铬酸钾测定 固体试样中铁的含量
固体试样中铁的含量
已知:二苯胺磺酸钠还原态为无色,氧化态为紫红色。
(4)取重铬酸钾晶体配制成0.02mol/L的标准液。称取2.00g 固体试样于锥形瓶中,加15.00mL混合酸,再加水配成100mL溶液,取10.00mL
固体试样于锥形瓶中,加15.00mL混合酸,再加水配成100mL溶液,取10.00mL 溶液于锥形瓶,加入几滴二苯胺磺酸钠作指示剂,用重铬酸钾标准液滴定至由绿色变为紫红色,消耗标准液8.00mL。
溶液于锥形瓶,加入几滴二苯胺磺酸钠作指示剂,用重铬酸钾标准液滴定至由绿色变为紫红色,消耗标准液8.00mL。
①写出滴定时重铬酸钾和硫酸亚铁反应的离子方程式________ 。
②测定 固体试样中铁的质量分数为
固体试样中铁的质量分数为_____ (保留两位小数)。
③测定结果偏大的可能原因是_______ 。
 )是实验室常用的氧化剂。某实验小组以铬铁矿(主要成分为
)是实验室常用的氧化剂。某实验小组以铬铁矿(主要成分为 ,含
,含 、
、 等杂质)为原料制备重铬酸钾,并进行性质验证实验。
等杂质)为原料制备重铬酸钾,并进行性质验证实验。已知:相关物质在不同温度时的溶解度/g如下表:
| 物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
| 重铬酸钾 | 4.7 | 12.3 | 26.3 | 45.6 | 73 |
| 重铬酸钠 | 163 | 183 | 215 | 269 | 76 |
步骤Ⅰ:将一定量NaOH和
 的固体置于铁坩埚内,加热至熔融,再加铬铁矿粉与
的固体置于铁坩埚内,加热至熔融,再加铬铁矿粉与 继续加热50分钟,发生反应:
继续加热50分钟,发生反应: ,自然冷却。
,自然冷却。步骤Ⅱ:取出坩埚中的熔块,置于烧杯中,加水并加热煮沸15分钟,冷却后抽滤,弃去含铁固体物质。
步骤Ⅲ:用冰醋酸调节上述滤液pH为7到8,产生浑浊,加热后过滤除去
 和
和 ,将滤液转移至蒸发皿中,加冰醋酸调节pH为5。
,将滤液转移至蒸发皿中,加冰醋酸调节pH为5。步骤Ⅳ:向上述溶液中加KCl,出现少量晶体再次调pH并进行结晶操作,有大量橙色晶体析出,抽滤,用少量冷水洗涤晶体,干燥得
 晶体。
晶体。回答下列问题:
(1)步骤Ⅰ中下列仪器不需要的是

(2)步骤Ⅲ中调节滤液pH用冰醋酸,不用强酸的原因是
(3)步骤Ⅳ中的结晶方法是
实验二:用重铬酸钾测定
 固体试样中铁的含量
固体试样中铁的含量已知:二苯胺磺酸钠还原态为无色,氧化态为紫红色。
(4)取重铬酸钾晶体配制成0.02mol/L的标准液。称取2.00g
 固体试样于锥形瓶中,加15.00mL混合酸,再加水配成100mL溶液,取10.00mL
固体试样于锥形瓶中,加15.00mL混合酸,再加水配成100mL溶液,取10.00mL 溶液于锥形瓶,加入几滴二苯胺磺酸钠作指示剂,用重铬酸钾标准液滴定至由绿色变为紫红色,消耗标准液8.00mL。
溶液于锥形瓶,加入几滴二苯胺磺酸钠作指示剂,用重铬酸钾标准液滴定至由绿色变为紫红色,消耗标准液8.00mL。①写出滴定时重铬酸钾和硫酸亚铁反应的离子方程式
②测定
 固体试样中铁的质量分数为
固体试样中铁的质量分数为③测定结果偏大的可能原因是
您最近一年使用:0次
解题方法
5 . 硫酸镍( ,易溶于水)是一种重要的化工原料,主要应用于石油化工、机械制造、医药、动力电池制造及电镀等行业领域中.利用铜冶炼过程中产生的副产物粗硫酸镍制备
,易溶于水)是一种重要的化工原料,主要应用于石油化工、机械制造、医药、动力电池制造及电镀等行业领域中.利用铜冶炼过程中产生的副产物粗硫酸镍制备 的工艺流程如下:
的工艺流程如下: 等多种离子;
等多种离子; ,离子浓度
,离子浓度 即可认为沉淀完全.
即可认为沉淀完全.
回答下列问题:
(1)“滤渣1”的主要成分是________ (写化学式);
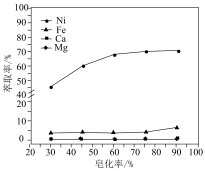
(2)NaHS作“除铜”沉淀剂的缺点是_______ ;
(3)对萃取剂进行皂化是一种强化萃取的常见方法,“萃镍”时加入HBL110萃取剂的同时加入NaOH溶液对萃取剂进行皂化,可以提高镍萃取率,从平衡移动的角度分析原因_____________ .萃取剂皂化率对金属阳离子的萃取率影响如图所示,皂化率最佳取值为_________ .结合图中信息分析,实际生产中将“滤液A”返回至“萃取”工序的原因为__________________ ;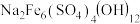 ],“除铁”的离子方程式为
],“除铁”的离子方程式为________ ;
(5)若溶液中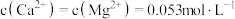 ,“除
,“除 ”时,缓慢滴加NaF溶液,则先产生的沉淀1是
”时,缓慢滴加NaF溶液,则先产生的沉淀1是________ (填化学式),当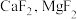 开始共沉淀时,溶液中“沉淀1”是否沉淀完全?
开始共沉淀时,溶液中“沉淀1”是否沉淀完全?____________ (填“是”或“否”);
(6)滴定法测定 产品中镍元素含量:取3.00g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中,滴入几滴紫脲酸胺指示剂,用浓度为
产品中镍元素含量:取3.00g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中,滴入几滴紫脲酸胺指示剂,用浓度为 的
的 标准液滴定,重复操作2~3次,平均消耗
标准液滴定,重复操作2~3次,平均消耗 标准液17.60mL;
标准液17.60mL;
已知:ⅰ. ;ⅱ.紫脲酸胺:紫色试剂,遇
;ⅱ.紫脲酸胺:紫色试剂,遇 显橙黄色。
显橙黄色。
①滴定至终点时溶液颜色变化为___________ ;
②样品中镍元素的质量分数为__________ %(保留3位有效数字)。
 ,易溶于水)是一种重要的化工原料,主要应用于石油化工、机械制造、医药、动力电池制造及电镀等行业领域中.利用铜冶炼过程中产生的副产物粗硫酸镍制备
,易溶于水)是一种重要的化工原料,主要应用于石油化工、机械制造、医药、动力电池制造及电镀等行业领域中.利用铜冶炼过程中产生的副产物粗硫酸镍制备 的工艺流程如下:
的工艺流程如下: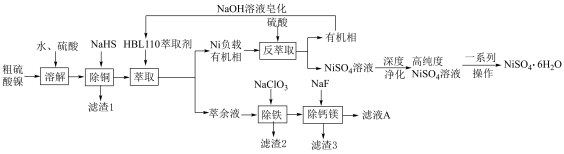
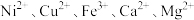 等多种离子;
等多种离子;②HBL110萃取剂是由酯类有机物B与磺酸类有机物HA按一定比例混合组成,萃取 原理为:
原理为: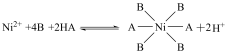 ;
;
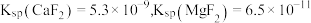 ,离子浓度
,离子浓度 即可认为沉淀完全.
即可认为沉淀完全.回答下列问题:
(1)“滤渣1”的主要成分是
(2)NaHS作“除铜”沉淀剂的缺点是
(3)对萃取剂进行皂化是一种强化萃取的常见方法,“萃镍”时加入HBL110萃取剂的同时加入NaOH溶液对萃取剂进行皂化,可以提高镍萃取率,从平衡移动的角度分析原因
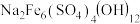 ],“除铁”的离子方程式为
],“除铁”的离子方程式为(5)若溶液中
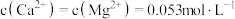 ,“除
,“除 ”时,缓慢滴加NaF溶液,则先产生的沉淀1是
”时,缓慢滴加NaF溶液,则先产生的沉淀1是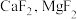 开始共沉淀时,溶液中“沉淀1”是否沉淀完全?
开始共沉淀时,溶液中“沉淀1”是否沉淀完全?(6)滴定法测定
 产品中镍元素含量:取3.00g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中,滴入几滴紫脲酸胺指示剂,用浓度为
产品中镍元素含量:取3.00g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中,滴入几滴紫脲酸胺指示剂,用浓度为 的
的 标准液滴定,重复操作2~3次,平均消耗
标准液滴定,重复操作2~3次,平均消耗 标准液17.60mL;
标准液17.60mL;已知:ⅰ.
 ;ⅱ.紫脲酸胺:紫色试剂,遇
;ⅱ.紫脲酸胺:紫色试剂,遇 显橙黄色。
显橙黄色。①滴定至终点时溶液颜色变化为
②样品中镍元素的质量分数为
您最近一年使用:0次
7日内更新
|
114次组卷
|
2卷引用:河北省衡水市2024届高三下学期高考预测卷化学试题
6 . 白云石的主要成分为 ,还含有少量的
,还含有少量的 和
和 。利用白云石制备碳酸钙和氧化镁,其主要流程的示意图如下。
。利用白云石制备碳酸钙和氧化镁,其主要流程的示意图如下。
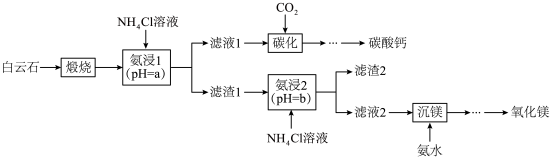
已知: 。
。
(1)组成 的四种元素,电负性由大到小的顺序是
的四种元素,电负性由大到小的顺序是___________ 。
(2)“氨浸1”在室温下进行,写出氯化铵浸取氧化钙总反应的离子方程式___________ 。
(3)两次“氨浸”的pH比较;a___________ b(填“>”“=”或“<”)。
(4)“碳化”时,测得碳酸钙的产率及碳酸钙中镁元素的含量随溶液pH的变化如图所示。
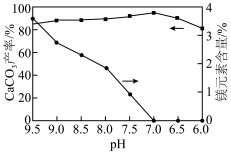

___________ 时,碳化效果最佳。低于该pH,碳酸钙的产率下降,其原因用离子方程式表示:___________ 。
(5)“沉镁”发生反应: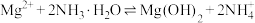 ,其平衡常数
,其平衡常数
___________ (用含氢氧化的 和
和 的
的 的代数式表示)。
的代数式表示)。
(6)制备过程除了充分利用 ,还可以循环利用的1种物质是
,还可以循环利用的1种物质是___________ (填化学式)。
(7)称取 试样置于烧杯中,加蒸馏水数滴润湿,盖一表面皿,滴加盐酸至固体完全溶解,定容在
试样置于烧杯中,加蒸馏水数滴润湿,盖一表面皿,滴加盐酸至固体完全溶解,定容在 的容量瓶内,用移液管吸取
的容量瓶内,用移液管吸取 待测液于锥形瓶中,加入相关试剂,摇匀后用
待测液于锥形瓶中,加入相关试剂,摇匀后用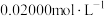 EDTA溶液滴定至终点(
EDTA溶液滴定至终点( 与EDTA以等物质的量比反应)。进行平行实验,测得平均消耗EDTA溶液
与EDTA以等物质的量比反应)。进行平行实验,测得平均消耗EDTA溶液 。产品中碳酸钙质量分数为
。产品中碳酸钙质量分数为___________ (列出计算式)。
(8)碳酸钙的某种晶胞结构如下图所示。

①每个晶胞中含有___________ 个“ ”单元。
”单元。
②每个阴离子团的配位数(紧邻的阳离子数)为___________ 。
 ,还含有少量的
,还含有少量的 和
和 。利用白云石制备碳酸钙和氧化镁,其主要流程的示意图如下。
。利用白云石制备碳酸钙和氧化镁,其主要流程的示意图如下。
已知:
 。
。(1)组成
 的四种元素,电负性由大到小的顺序是
的四种元素,电负性由大到小的顺序是(2)“氨浸1”在室温下进行,写出氯化铵浸取氧化钙总反应的离子方程式
(3)两次“氨浸”的pH比较;a
(4)“碳化”时,测得碳酸钙的产率及碳酸钙中镁元素的含量随溶液pH的变化如图所示。


(5)“沉镁”发生反应:
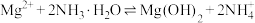 ,其平衡常数
,其平衡常数
 和
和 的
的 的代数式表示)。
的代数式表示)。(6)制备过程除了充分利用
 ,还可以循环利用的1种物质是
,还可以循环利用的1种物质是(7)称取
 试样置于烧杯中,加蒸馏水数滴润湿,盖一表面皿,滴加盐酸至固体完全溶解,定容在
试样置于烧杯中,加蒸馏水数滴润湿,盖一表面皿,滴加盐酸至固体完全溶解,定容在 的容量瓶内,用移液管吸取
的容量瓶内,用移液管吸取 待测液于锥形瓶中,加入相关试剂,摇匀后用
待测液于锥形瓶中,加入相关试剂,摇匀后用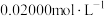 EDTA溶液滴定至终点(
EDTA溶液滴定至终点( 与EDTA以等物质的量比反应)。进行平行实验,测得平均消耗EDTA溶液
与EDTA以等物质的量比反应)。进行平行实验,测得平均消耗EDTA溶液 。产品中碳酸钙质量分数为
。产品中碳酸钙质量分数为(8)碳酸钙的某种晶胞结构如下图所示。

①每个晶胞中含有
 ”单元。
”单元。②每个阴离子团的配位数(紧邻的阳离子数)为
您最近一年使用:0次
名校
解题方法
7 . 贵州是国内唯一兼具高海拔、低纬度、寡日照、多云雾适宜种茶制茶条件的茶区,是国内业界公认的高品质绿茶重要产地。茶叶中有两种含量最多的功效成分,一是咖啡因,它易溶于水、乙醇、氯仿,二是茶多酚,是一种天然抗氧化剂(其抗氧化能力是VC的5~10倍),它易溶于水、乙醇、乙酸乙酯,难溶于氯仿。实验室提取茶多酚主要实验步骤如下:
②提取:称取10g茶叶末,用滤纸包好,按如图所示装置进行提取操作。

③分离:将提取液分别过滤后合并滤液,并将滤液按1∶2的体积比与氯仿混合,并搅拌均匀,再用分液漏斗静止分层。取上层液按1∶2体积比加入乙酸乙酯,混合均匀后搅拌3~5分钟,然后倒入分液漏斗中静置,最后分层,操作2次,合并萃取液,用水浴加热减压蒸馏除去乙酸乙酯。
④浓缩:趁热将残液移入洁净干燥的蒸发皿,用蒸汽浴继续浓缩至近干
⑤结晶:冷却至室温,移入冰箱冷冻干燥,得到白色粉末状的茶多酚粗制品。将粗制品用蒸馏水进行1~2次重结晶,得到茶多酚精品。
回答下列问题:
(1)步骤2中滤纸包好的茶叶末装入___________ 中,圆底烧瓶内加___________ 和适量乙醇,通冷凝水,加热套加热,当乙醇被加热沸腾后,控制加热套温度在90℃。为使恒压漏斗内液面高出茶叶包约0.5cm,并保持约1h,可行的操作方法是___________ 。
(2)步骤3中氯仿的作用是___________ 。
(3)下列关于萃取过程中振摇操作的示意图,正确的是___________ (填序号)。
A. B.
B.  C.
C.
(4)与常压蒸馏相比,减压蒸馏的优点是___________ 。
(5)在酸性介质中,茶多酚能将 还原为
还原为 ,
, 与
与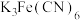 生成的深蓝色配位化合物
生成的深蓝色配位化合物 对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
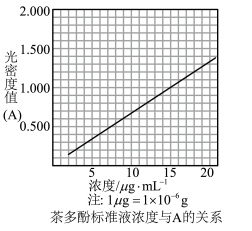
称取1.25g粗产品,用蒸馏水溶解并定容至1000mL,移取该溶液1.00mL,加过量 和
和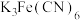 酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值
酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值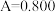 ,则产品的纯度是
,则产品的纯度是___________ (以质量分数表示)。
①准备工作:称取适量干燥的绿茶样品,并将其粉碎成细粉末。
②提取:称取10g茶叶末,用滤纸包好,按如图所示装置进行提取操作。

③分离:将提取液分别过滤后合并滤液,并将滤液按1∶2的体积比与氯仿混合,并搅拌均匀,再用分液漏斗静止分层。取上层液按1∶2体积比加入乙酸乙酯,混合均匀后搅拌3~5分钟,然后倒入分液漏斗中静置,最后分层,操作2次,合并萃取液,用水浴加热减压蒸馏除去乙酸乙酯。
④浓缩:趁热将残液移入洁净干燥的蒸发皿,用蒸汽浴继续浓缩至近干
⑤结晶:冷却至室温,移入冰箱冷冻干燥,得到白色粉末状的茶多酚粗制品。将粗制品用蒸馏水进行1~2次重结晶,得到茶多酚精品。
回答下列问题:
(1)步骤2中滤纸包好的茶叶末装入
(2)步骤3中氯仿的作用是
(3)下列关于萃取过程中振摇操作的示意图,正确的是
A.
 B.
B.  C.
C.
(4)与常压蒸馏相比,减压蒸馏的优点是
(5)在酸性介质中,茶多酚能将
 还原为
还原为 ,
, 与
与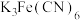 生成的深蓝色配位化合物
生成的深蓝色配位化合物 对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
称取1.25g粗产品,用蒸馏水溶解并定容至1000mL,移取该溶液1.00mL,加过量
 和
和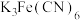 酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值
酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值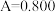 ,则产品的纯度是
,则产品的纯度是
您最近一年使用:0次
名校
解题方法
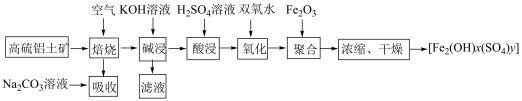
8 . 以高硫铝土矿(主要成分为 、
、 、
、 ,还含少量
,还含少量 和硫酸盐)为原料制备聚合硫酸铁
和硫酸盐)为原料制备聚合硫酸铁 (
(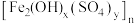 )的工艺流程如图:
)的工艺流程如图:
已知:常温下,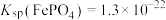 ,
,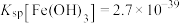 。
。
(1)铁元素位于元素周期表的第______ 周期第______ 族。
(2)①“焙烧”过程会产生 ,足量
,足量 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为___________ 。
②用某浓度的 溶液吸收
溶液吸收 的过程中,溶液的
的过程中,溶液的 随吸收时间的关系、尾气中
随吸收时间的关系、尾气中 质量分数与溶液
质量分数与溶液 的关系分别如图所示。
的关系分别如图所示。
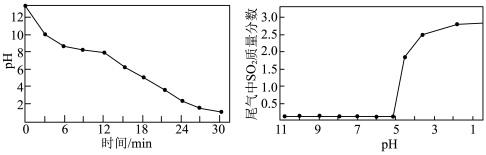
则每隔___________  需要更换
需要更换 溶液。
溶液。
(3)若在实验室“焙烧”,则盛放固体物质的容器名称为___________ ;“碱浸”时应将焙烧渣粉碎后再研磨成细粉,目的是___________ 。
(4)聚合硫酸铁(PFS)是一种新型的无机高分子絮凝剂,能有效去除污水中的含磷化合物。处理后的污水中的不同含磷物质的浓度(计为磷浓度,单位略)与PFS投加量的关系如图所示。
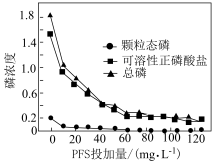
①当PFS投加量小于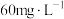 时,可溶性正磷酸盐浓度显著下降的原因为
时,可溶性正磷酸盐浓度显著下降的原因为___________ 。
②随着PFS投加量的增加,污水中颗粒态磷的浓度几乎为零的原因为___________ 。
(5)已知:聚合硫酸铁一等品质总铁含量指标要求为铁的质量分数大于11.0%。为测定某聚合硫酸铁样品中铁的含量是否达到一等品质指标要求,进行如下实验:
a.准确称取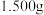 该聚合硫酸铁样品溶于适量硫酸,配成
该聚合硫酸铁样品溶于适量硫酸,配成 溶液
溶液 。
。
b.准确量取 溶液
溶液 ,加入足量铜粉中,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并得到溶液
,加入足量铜粉中,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并得到溶液 。
。
c.用 的酸性
的酸性 溶液滴定溶液
溶液滴定溶液 ,恰好反应完全时消耗酸性
,恰好反应完全时消耗酸性 溶液的体积为
溶液的体积为 。
。
该聚合硫酸铁样品中铁的含量___________ (填“已达到”或“未达到”)一等品质指标要求。
 、
、 、
、 ,还含少量
,还含少量 和硫酸盐)为原料制备聚合硫酸铁
和硫酸盐)为原料制备聚合硫酸铁 (
(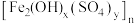 )的工艺流程如图:
)的工艺流程如图:
已知:常温下,
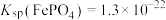 ,
,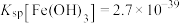 。
。(1)铁元素位于元素周期表的第
(2)①“焙烧”过程会产生
 ,足量
,足量 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为②用某浓度的
 溶液吸收
溶液吸收 的过程中,溶液的
的过程中,溶液的 随吸收时间的关系、尾气中
随吸收时间的关系、尾气中 质量分数与溶液
质量分数与溶液 的关系分别如图所示。
的关系分别如图所示。
则每隔
 需要更换
需要更换 溶液。
溶液。(3)若在实验室“焙烧”,则盛放固体物质的容器名称为
(4)聚合硫酸铁(PFS)是一种新型的无机高分子絮凝剂,能有效去除污水中的含磷化合物。处理后的污水中的不同含磷物质的浓度(计为磷浓度,单位略)与PFS投加量的关系如图所示。

①当PFS投加量小于
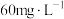 时,可溶性正磷酸盐浓度显著下降的原因为
时,可溶性正磷酸盐浓度显著下降的原因为②随着PFS投加量的增加,污水中颗粒态磷的浓度几乎为零的原因为
(5)已知:聚合硫酸铁一等品质总铁含量指标要求为铁的质量分数大于11.0%。为测定某聚合硫酸铁样品中铁的含量是否达到一等品质指标要求,进行如下实验:
a.准确称取
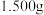 该聚合硫酸铁样品溶于适量硫酸,配成
该聚合硫酸铁样品溶于适量硫酸,配成 溶液
溶液 。
。b.准确量取
 溶液
溶液 ,加入足量铜粉中,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并得到溶液
,加入足量铜粉中,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并得到溶液 。
。c.用
 的酸性
的酸性 溶液滴定溶液
溶液滴定溶液 ,恰好反应完全时消耗酸性
,恰好反应完全时消耗酸性 溶液的体积为
溶液的体积为 。
。该聚合硫酸铁样品中铁的含量
您最近一年使用:0次
2024高三下·全国·专题练习
9 . 制备的泄盐样品中MgSO4·7H2O的含量可用EDTA二钠盐(用Na2H2Y表示)进行测定,实验测定方法如下:
则制得的泄盐样品中MgSO4·7H2O的质量分数为___________ 。
| 实验测定方法 | 涉及的反应 |
| ①在1.5 g样品中加入足量的EDTA二钠盐溶液,配成pH=9~10的100.00 mL甲溶液 | Mg2++H2Y2-=MgH2Y |
| ②取25.00 mL甲溶液于锥形瓶中,用含0.100 mol·L-1 Zn2+的标准液进行滴定,消耗20.00 mL含Zn2+标准液 | Zn2++H2Y2-=ZnH2Y |
| ③再取25.00 mL甲溶液于另一锥形瓶中,调节pH为5~6,用含0.100 mol·L-1 Zn2+的标准液进行滴定,消耗35.00 mL含Zn2+标准液 | Zn2++MgH2Y=Mg2++ZnH2Y、Zn2++H2Y2-=ZnH2Y |
您最近一年使用:0次
10 . 某研究小组以白云石(主要成分为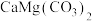 )为原料制备无水碳酸镁,流程如下:
)为原料制备无水碳酸镁,流程如下:______ ,步骤III,重镁水溶液中主要溶质的化学式是______ 。
(2)下列说法正确的是______。
(3)步骤III过程中需将温度控制在 ,原因是
,原因是______ 。
(4)为测定产品中微量的钙元素含量,可用已知浓度为 的
的 标准溶液进行滴定。从下列选项中选择合理的仪器和操作,补全如下步骤[“_____”上填写一件最关键仪器,“( )”内填写一种操作,均用字母表示]。
标准溶液进行滴定。从下列选项中选择合理的仪器和操作,补全如下步骤[“_____”上填写一件最关键仪器,“( )”内填写一种操作,均用字母表示]。
用分析天平(称量 产品)
产品) 用烧杯
用烧杯______  用
用______ (配制 的溶液
的溶液 )
) 用移液管
用移液管______  在
在______ 中______  用
用______ (盛装 溶液滴定
溶液滴定 ,消耗
,消耗 )
)
仪器:a.烧杯;b.滴定管;c.容量瓶;d.锥形瓶
操作:e.加水溶解;f.加盐酸溶解;g.加入三乙醇胺、 和钙指示剂;h.量取
和钙指示剂;h.量取 溶液
溶液
(5)如要测定产品中 含量,还需继续以下实验:量取
含量,还需继续以下实验:量取 溶液
溶液 ,稀释至
,稀释至 得到溶液
得到溶液 ,另取
,另取 溶液
溶液 于锥形瓶中,加入三乙醇胺、缓冲溶液与铬黑
于锥形瓶中,加入三乙醇胺、缓冲溶液与铬黑 指示剂后,用上述
指示剂后,用上述 标准溶液滴定
标准溶液滴定 、
、 总量(
总量( 、
、 与
与 按物质的量
按物质的量 反应),消耗
反应),消耗 ,根据本次实验计算产品中镁元素的质量分数
,根据本次实验计算产品中镁元素的质量分数______ 。
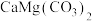 )为原料制备无水碳酸镁,流程如下:
)为原料制备无水碳酸镁,流程如下:
(2)下列说法正确的是______。
A.步骤II,在溶解过程中可加入硫酸,加入 可适当除去原料中的钙元素 可适当除去原料中的钙元素 |
B.步骤IV产生的 和滤液可循环利用 和滤液可循环利用 |
C.步骤IV热解过程中通入空气的目的是除去体系中溶解的 ,促进反应正向进行 ,促进反应正向进行 |
| D.步骤V,可通过直接加热的方式制得无水碳酸镁 |
 ,原因是
,原因是(4)为测定产品中微量的钙元素含量,可用已知浓度为
 的
的 标准溶液进行滴定。从下列选项中选择合理的仪器和操作,补全如下步骤[“_____”上填写一件最关键仪器,“( )”内填写一种操作,均用字母表示]。
标准溶液进行滴定。从下列选项中选择合理的仪器和操作,补全如下步骤[“_____”上填写一件最关键仪器,“( )”内填写一种操作,均用字母表示]。用分析天平(称量
 产品)
产品) 用烧杯
用烧杯 用
用 的溶液
的溶液 )
) 用移液管
用移液管 在
在 用
用 溶液滴定
溶液滴定 ,消耗
,消耗 )
)仪器:a.烧杯;b.滴定管;c.容量瓶;d.锥形瓶
操作:e.加水溶解;f.加盐酸溶解;g.加入三乙醇胺、
 和钙指示剂;h.量取
和钙指示剂;h.量取 溶液
溶液
(5)如要测定产品中
 含量,还需继续以下实验:量取
含量,还需继续以下实验:量取 溶液
溶液 ,稀释至
,稀释至 得到溶液
得到溶液 ,另取
,另取 溶液
溶液 于锥形瓶中,加入三乙醇胺、缓冲溶液与铬黑
于锥形瓶中,加入三乙醇胺、缓冲溶液与铬黑 指示剂后,用上述
指示剂后,用上述 标准溶液滴定
标准溶液滴定 、
、 总量(
总量( 、
、 与
与 按物质的量
按物质的量 反应),消耗
反应),消耗 ,根据本次实验计算产品中镁元素的质量分数
,根据本次实验计算产品中镁元素的质量分数
您最近一年使用:0次







