1 . 我国法律规定,禁止酒后驾车。
(1)手持式酒精检测仪,检测呼出气体中乙醇浓度(BrAC)的主要原理为: 2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3+2K2SO4+3___________+11H2O
①在横线上填相应的产物___________ 。
②判断司机酒驾所依据的现象是___________ 。
(2)BrAC一般作为酒驾检测的初筛手段,进一步是检测血液的乙醇浓度(BAC)。法律规定,20mg/10mL<BAC<80mg/100mL为酒后驾驶;BAC≥80mg/100mL为醉酒驾驶,BrAC与BAC的关系是:BAC(mg/L)=BrAC(mg/L)×2200,裁定醉酒驾驶BrAC的大小范围是___________ mg/L。
(3)近年又发展检测唾液中乙醇含量的方法,原理如下:
Ⅰ.将试纸浸入唾液10秒后取出,试纸中的乙醇在酶的作用下被空气氧化为CH3CHO和H2O2,写出化学方程式___________ 。
Ⅱ.H2O2与3,3′,5,5′—四甲基联苯胺(图1)反应反应一种有色化合物,颜色变化程度与乙醇含量成正比。

①被定义为“1”和“1”的碳原子是哪两个,在图1所示结构简式上将之涂黑。___________
②图2所示有机物的名称是___________ 。
(1)手持式酒精检测仪,检测呼出气体中乙醇浓度(BrAC)的主要原理为: 2K2Cr2O7+3C2H5OH+8H2SO4=2Cr2(SO4)3+2K2SO4+3___________+11H2O
①在横线上填相应的产物
②判断司机酒驾所依据的现象是
(2)BrAC一般作为酒驾检测的初筛手段,进一步是检测血液的乙醇浓度(BAC)。法律规定,20mg/10mL<BAC<80mg/100mL为酒后驾驶;BAC≥80mg/100mL为醉酒驾驶,BrAC与BAC的关系是:BAC(mg/L)=BrAC(mg/L)×2200,裁定醉酒驾驶BrAC的大小范围是
(3)近年又发展检测唾液中乙醇含量的方法,原理如下:
Ⅰ.将试纸浸入唾液10秒后取出,试纸中的乙醇在酶的作用下被空气氧化为CH3CHO和H2O2,写出化学方程式
Ⅱ.H2O2与3,3′,5,5′—四甲基联苯胺(图1)反应反应一种有色化合物,颜色变化程度与乙醇含量成正比。

①被定义为“1”和“1”的碳原子是哪两个,在图1所示结构简式上将之涂黑。
②图2所示有机物的名称是
您最近一年使用:0次
名校
2 . 回答下列问题:
(1)在密闭容器中加入NaHCO3和NaOH的混合物共18.4g,加热至300℃,经充分反应后排出气体,冷却得到剩余固体质量为16.6g。试确定混合物的组成:m(NaHCO3)=__ g。
(2)为测定镁铝合金的成分,取13.5g合金全部溶于500mL3mol/L的H2SO4中,充分反应后,再加入400mL8mol/L的NaOH溶液,结果得到了白色沉淀和滤液B。
①滤液B中n(NaAlO2)=__ mol。
②若白色沉淀只有一种成分,则合金中镁的质量分数范围为__ 。
(1)在密闭容器中加入NaHCO3和NaOH的混合物共18.4g,加热至300℃,经充分反应后排出气体,冷却得到剩余固体质量为16.6g。试确定混合物的组成:m(NaHCO3)=
(2)为测定镁铝合金的成分,取13.5g合金全部溶于500mL3mol/L的H2SO4中,充分反应后,再加入400mL8mol/L的NaOH溶液,结果得到了白色沉淀和滤液B。
①滤液B中n(NaAlO2)=
②若白色沉淀只有一种成分,则合金中镁的质量分数范围为
您最近一年使用:0次
解题方法
3 . 取四份不同质量的(NH4)2SO4和NH4HSO4的混合物样品,分别加入到200mL1 mol/L的NaOH溶液中,充分反应,加热,再将逸出气体干燥后用浓H2SO4吸收,测定结果如下表:
回答下列问题:
(1)分析上表中的数据,求m的值。
(2)在研究时发现,浓硫酸增加的质量(g)与样品的质量(g)之间满足一定的函数关系。假设样品的质量为x,浓硫酸增加的质量为y,写出当x在不同范围时y与x的函数关系。
| 实验编号 | I | II | III | IV |
| 样品的质量(g) | 9.88 | 19.76 | 29.64 | 49.40 |
| 浓硫酸增加的质量(g) | m | m | 1.36 | 0 |
(1)分析上表中的数据,求m的值。
(2)在研究时发现,浓硫酸增加的质量(g)与样品的质量(g)之间满足一定的函数关系。假设样品的质量为x,浓硫酸增加的质量为y,写出当x在不同范围时y与x的函数关系。
您最近一年使用:0次
4 . 某不活泼金属A重019g,在氯气中燃烧后,所得到产物经高温灼烧,恒重后得B,溶于浓盐酸中得到黄色溶液C。此金属在氯气中燃烧后的产物再经高温灼烧时所得气体通入KI溶液后,再用0.1000mol/LNa2S2O3标准溶液滴定至终点,消耗25.00mLNa2S2O3溶液。
(1)通过计算写出A、B、C的化学式:_______ 、_______ 、_______ 。
(2)写出由A变成C的化学反应方程式_______ 。
(1)通过计算写出A、B、C的化学式:
(2)写出由A变成C的化学反应方程式
您最近一年使用:0次
5 . 最近,我国某高校一研究小组将0.383gAgCl,0.160gSe和0.21gNaOH装入充满蒸馏水的反应釜中加热到115°C,10小时后冷至室温,用水洗净可溶物后,得到难溶于水的金属色晶体A.在显微镜下观察,发现A的单晶竟是六角微型管(如下图所示),有望开发为特殊材料。现代物理方法证实A由银和硒两种元素组成,Se的质量几近原料的2/3;A的理论产量约0.39g。
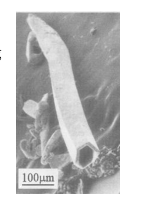
(1)写出合成A的化学方程式_______ ,标明A是什么_________ 。
(2)溶于水的物质有:_______ 。

(1)写出合成A的化学方程式
(2)溶于水的物质有:
您最近一年使用:0次
6 . 用EDTA配位滴定法可测定与Cu2+和Zn2+共存的Al3+的含量,以PAN为指示剂,测定的相对误差≤±0.1%。测定过程可表述如下(注:表中的配合物电荷数被省略;游离的EDTA的各种形体均被简写为Y):
附:配合物稳定常数的对数值lgK稳的数据:

附:配合物稳定常数的对数值lgK稳的数据:CuY 18. 8 ZnY 16.5 AlY 16. 1 AlF 19.7 Cu- PAN 16.1
19.7 Cu- PAN 16.1
(1)写出从D框状态到E框状态的反应式并配平_______ 。
(2)F框状态内还应存在何种物质_______ ?
(3)是否需确知所用EDTA溶液的准确浓度_______ ?V1是否需要准确读取并记录_______ ?简述原因_______ 。
(4)若从C框状态到D框状态时Cu2+溶液滴过量了,问:
①对最终的测定结果将引入正误差还是负误差?还是无影响_______ ?
②如你认为有影响,在实验方面应如何处理_______ ?
(5)设试液取量V0和V1、V2、V3均以mL为单位,MAl为Al的摩尔质量(g·mol-1),c(EDTA)、c(Cu)分别为EDTA和Cu2+溶液的浓度(mol·L-1),列出试液中Al含量(g·L-1)的计算式_______ 。
附:配合物稳定常数的对数值lgK稳的数据:

附:配合物稳定常数的对数值lgK稳的数据:CuY 18. 8 ZnY 16.5 AlY 16. 1 AlF
 19.7 Cu- PAN 16.1
19.7 Cu- PAN 16.1(1)写出从D框状态到E框状态的反应式并配平
(2)F框状态内还应存在何种物质
(3)是否需确知所用EDTA溶液的准确浓度
(4)若从C框状态到D框状态时Cu2+溶液滴过量了,问:
①对最终的测定结果将引入正误差还是负误差?还是无影响
②如你认为有影响,在实验方面应如何处理
(5)设试液取量V0和V1、V2、V3均以mL为单位,MAl为Al的摩尔质量(g·mol-1),c(EDTA)、c(Cu)分别为EDTA和Cu2+溶液的浓度(mol·L-1),列出试液中Al含量(g·L-1)的计算式
您最近一年使用:0次
7 . 一种鲜花保存剂(preservativeofcutflowers)B可按以下方法制备:把丙酮肟、溴乙酸、氢氧化钾混合在1,4-二氧六环(溶剂)中反应,酸化后用乙醚提取,蒸去乙醚后经减压蒸馏析离出中间产物A,A用1:1盐酸水溶液水解,水解液浓缩后加入异丙醇(降低溶解度),冷却,即得到晶态目标产物B,B的熔点152~153℃(分解),可溶于水,与AgNO3溶液形成AgCl沉淀。用银定量法以回滴方式(用NH4SCN回滴过量的AgNO3)测定目标产物B的相对分子质量,实验过程及实验数据如下:
①用250毫升容量瓶配制约0.05mol/L的AgNO3溶液,同时配置250mL浓度相近的NH4SCN溶液。
②准确称量烘干的NaCl207.9mg,用100毫升容量瓶定容。
③用10毫升移液管移取上述AgNO3溶液到50毫升锥瓶中,加入4mL4mol/LHNO3和1mL饱和铁铵矾溶液,用NH4SCN溶液滴定,粉红色保持不褪色时为滴定终点,三次实验的平均值6.30mL。
④用10毫升移液管移取NaCl溶液到50毫升锥瓶中,加入10mLAgNO3溶液、4mL4.mol/LHNO3和1mL饱和铁铵矾溶液,用回滴过量的AgNO3,三次实验结果平均为1.95mL。
⑤准确称量84.0mg产品B,转移到50毫升锥瓶中,加适量水使其溶解,加入10mLAgNO3溶液、4mL4mol/LHNO3和1mL饱和铁铵矾溶液,用NH4SCN溶液回滴,消耗了1.65mL。
⑥重复步骤⑤,称量的B为81.6mg,消耗的NH4SCN溶液为1.77mL;称量的B为76.8mg,消耗的NH4SCN溶液为2.02mL。
(1)按以上实验数据计算出产物B的平均相对分子质量_______ 。用质谱方法测得液相中B的最大正离子的相对式量为183。
(2)试写出中间产物A和目标产物B的结构式:A_______ 、B_______ 。
①用250毫升容量瓶配制约0.05mol/L的AgNO3溶液,同时配置250mL浓度相近的NH4SCN溶液。
②准确称量烘干的NaCl207.9mg,用100毫升容量瓶定容。
③用10毫升移液管移取上述AgNO3溶液到50毫升锥瓶中,加入4mL4mol/LHNO3和1mL饱和铁铵矾溶液,用NH4SCN溶液滴定,粉红色保持不褪色时为滴定终点,三次实验的平均值6.30mL。
④用10毫升移液管移取NaCl溶液到50毫升锥瓶中,加入10mLAgNO3溶液、4mL4.mol/LHNO3和1mL饱和铁铵矾溶液,用回滴过量的AgNO3,三次实验结果平均为1.95mL。
⑤准确称量84.0mg产品B,转移到50毫升锥瓶中,加适量水使其溶解,加入10mLAgNO3溶液、4mL4mol/LHNO3和1mL饱和铁铵矾溶液,用NH4SCN溶液回滴,消耗了1.65mL。
⑥重复步骤⑤,称量的B为81.6mg,消耗的NH4SCN溶液为1.77mL;称量的B为76.8mg,消耗的NH4SCN溶液为2.02mL。
(1)按以上实验数据计算出产物B的平均相对分子质量
(2)试写出中间产物A和目标产物B的结构式:A
您最近一年使用:0次
8 . 皂化当量是指每摩尔氢氧根离子所能皂化的酯(样品)的质量(mg)。可用如下方法测定皂化当量(适用范围:皂化当量100-1000mgmol-1,样品量5-100mg):准确称取X(mg)样品,置于皂化瓶中,加入适量0.5molL-1氢氧化钾醇溶液,接上回流冷凝管和碱石灰管,加热回流0.5~3小时;皂化完成后,用1~2mL乙醇淋洗冷凝管内壁,拆去冷凝管,立即加入5滴酚酞,用0.5mol·L-1盐酸溶液酸化,使酸稍过量;将酸化后的溶液转移到锥形瓶中,用乙醇淋洗皂化瓶数遍,洗涤完的醇溶液也均移入锥形瓶中;向锥形瓶滴加0.5mol·L-1氢氧化钾醇溶液,直至溶液显浅红色;然后用0.0250mol·L-1盐酸溶液滴定至刚好无色,消耗盐酸V1(mL);再加入3滴溴酚蓝指示剂,溶液显蓝色,用0.0250mol·L-1盐酸溶液滴定至刚刚呈现绿色,即为滴定终点,消耗盐酸V2(mL)。在没有酯存在下重复上述实验步骤,消耗标准盐酸溶液分别为V3和V4(mL)。
(1)碱石灰管起什么作用_______ ?
(2)写出计算皂化当量的公式_______ 。
(3)样品中的游离羧酸将对分析结果有什么影响_______ ?如何消除影响_______ ?
(1)碱石灰管起什么作用
(2)写出计算皂化当量的公式
(3)样品中的游离羧酸将对分析结果有什么影响
您最近一年使用:0次
9 . CuO和Ba(NO3)2以物质的量比1 : 1混合,加热溶解于稀硝酸中,将获得溶液进行喷雾冷冻成小颗粒,并低温干燥,干燥后物质移入铂坩埚中,在1.0 ×105 Pa的氧气中加热至620°C,并保温18小时,获得固体物质A和B的混合物,分离得到物质A和B。
元素和结构分析表明,物质A由Ba,Cu,O三种元素组成,Cu原子位于由O原子构成的四边形的中心,四边形通过共棱组成一维的铜氧链,Ba位于链之间。将1.00克A与足量碘化钾混合,在氩气气氛下滴入3 mol·L-1 盐酸,直至固体完全溶解,得到溶液S(反应式1)。溶液S加水稀释,得到白色固体沉淀C(反应式2);溶液S加入少量淀粉,得到蓝色溶液,用0.100 mol·L-1硫代硫酸钠溶液滴定,消耗44.54 mL(反应式3)。若A先用盐酸溶解(反应式4),再滴入碘化钾溶液(反应式5),直接得到含有沉淀C的溶液,该溶液用0.100 mol·L-1硫代硫酸钠溶液滴定,消耗26.72 mL。
物质B在20%氧气+ 80%氮气混合气氛保护下缓慢加热至820 °C,失重9.45%(反应式6),得到物。质D,而缓慢降温至400 °C后,又恢复到原重量。
原子量: Ba: 137.33, Cu: 63.55,O: 16.00 。
(1)写出A、B、C和D的化学式______ 、______ 、______ 、______ 。
(2)写出反应的反应方程式(溶液中反应必须用离子方程式表示)______ 。
(3)在上述滴定实验中,用硫代硫酸钠溶液滴定到接近终点时,常加入少量KSCN以提高测定精确度,阐明原理及必须在接近终点时才加入KSCN的理由______ 。
元素和结构分析表明,物质A由Ba,Cu,O三种元素组成,Cu原子位于由O原子构成的四边形的中心,四边形通过共棱组成一维的铜氧链,Ba位于链之间。将1.00克A与足量碘化钾混合,在氩气气氛下滴入3 mol·L-1 盐酸,直至固体完全溶解,得到溶液S(反应式1)。溶液S加水稀释,得到白色固体沉淀C(反应式2);溶液S加入少量淀粉,得到蓝色溶液,用0.100 mol·L-1硫代硫酸钠溶液滴定,消耗44.54 mL(反应式3)。若A先用盐酸溶解(反应式4),再滴入碘化钾溶液(反应式5),直接得到含有沉淀C的溶液,该溶液用0.100 mol·L-1硫代硫酸钠溶液滴定,消耗26.72 mL。
物质B在20%氧气+ 80%氮气混合气氛保护下缓慢加热至820 °C,失重9.45%(反应式6),得到物。质D,而缓慢降温至400 °C后,又恢复到原重量。
原子量: Ba: 137.33, Cu: 63.55,O: 16.00 。
(1)写出A、B、C和D的化学式
(2)写出反应的反应方程式(溶液中反应必须用离子方程式表示)
(3)在上述滴定实验中,用硫代硫酸钠溶液滴定到接近终点时,常加入少量KSCN以提高测定精确度,阐明原理及必须在接近终点时才加入KSCN的理由
您最近一年使用:0次
10 . 腐殖质是土壤中结构复杂的有机物,土壤肥力与腐殖质含量密切相关。可采用重铬酸钾法测定土壤中腐殖质的含量:称取0.1500 g风干的土样,加入5 mL0. 10 mol·L-1K2Cr2O7的H2SO4溶液,充分加热,氧化其中的碳(C→CO2,腐殖质中含碳58% , 90%的碳可被氧化)。以邻菲罗啉为指示剂,用0.1221 mol·L-1的(NH4)2SO4 ·FeSO4溶液滴定,消耗10.02 mL。空白实验如下:上述土壤样品经高温灼烧后,称取同样质量,采用相同的条件处理和滴定,消耗(NH4)2SO4·FeSO4溶液22.35mL。
(1)写出在酸性介质中K2Cr2O7,将碳氧化为CO2的方程式_____ 。
(1)写出硫酸亚铁铵滴定过程的方程式______ 。
(3)计算土壤中腐殖质的质量分数____ 。
(1)写出在酸性介质中K2Cr2O7,将碳氧化为CO2的方程式
(1)写出硫酸亚铁铵滴定过程的方程式
(3)计算土壤中腐殖质的质量分数
您最近一年使用:0次



